鹿血的酶解工艺优化及其抗运动疲劳活性评价
2021-08-13杜小琴张小琴张万超梁正杰吕君江吴中宝
杜小琴, 夏 炎, 张小琴, 张万超, 梁正杰,吕君江, 吴中宝*
鹿血的酶解工艺优化及其抗运动疲劳活性评价
杜小琴1, 夏 炎1, 张小琴1, 张万超1, 梁正杰1,吕君江2, 吴中宝1*
(1. 重庆市药物种植研究所,特色生物资源研究与利用川渝共建重点实验室,南川 408435;2. 重庆医药高等专科学校,重庆 401331)
对鹿血酶解工艺进行优化,并对鹿血酶解液进行液相色谱分析及抗运动疲劳活性评价。以氨基酸态氮含量、干燥失重为指标,研究动物蛋白酶的添加量、酶解时间和酶解温度对鹿血酶解效果的影响;以小鼠负重游泳时间、血尿氮含量、肝糖原含量为指标,研究鹿血及酶解液的抗运动疲劳活性。结果表明,动物蛋白酶的添加量为4 g·L-1,酶解时间为6 h,酶解温度为55 ℃为较优条件,此时氨基酸态氮含量为0.63 g·100 mL-1,干燥失重为60.0%。高效液相色谱图显示鹿血酶解液色谱峰明显,而鹿血粉在该色谱条件下色谱峰较少。与空白组相比,鹿血酶解液给药可极显著(<0.01)提高小鼠负重游泳时间、肝糖原含量和降低小鼠血尿氮含量;鹿血粉给药可极显著(<0.01)提高小鼠负重游泳时间,显著(<0.05)降低小鼠血尿氮含量,但对肝糖原含量影响较小。鹿血具有较强的抗运动疲劳活性,鹿血酶解液的抗运动疲劳活性优于鹿血粉。
鹿血;酶解;高效液相色谱;运动疲劳
鹿血是鹿科动物梅花鹿()或马鹿()的膛血或茸血。鹿血在我国有较长的食用历史,2012年国家卫生部将梅花鹿血作为普通食品(卫监督函〔2012〕8号)。鲜鹿血中水分含量占80%左右,有机成分占16%~17%,其中蛋白质含量占13%以上[1],是鹿血中的主要成分,主要含有17种氨基酸[2]。现代药理研究表明,鹿血具有抗运动疲劳、降血压[3]、增强免疫力[4]等生理活性。
运动疲劳是指机体不能将它的功能保持在某一特定水平或不能维持某一预定的运动强度[5],表现为运动时能量体系输出功率和肌肉力量的下降或内脏器官功能的下降而不能维持运动强度。关于鹿血的抗运动疲劳活性,有关研究发现鹿血肽能显著增加小鼠断头喘气时间、爬杆时间和负重游泳时间及显著降低游泳后血乳酸的增加量[6-7]。尹晓平等[8]进一步研究不同水解程度鹿血肽的抗疲劳活性,发现水解程度越高其抗疲劳效果越明显,抗疲劳肽的相对分子量分布在500 ~25 000之间。另有人认为相对分子量小于1 000 D的鹿血多肽具有较好的抗疲劳效果[9]。在木瓜蛋白酶酶解的鹿血肽中,必须氨基酸含量为总氨基酸的55.34%,是一种理想的运动蛋白,支链氨基酸为总氨基酸的21.9%[10],有助于延缓疲劳的出现[11]。
鹿血肽的分子量、含量及水解氨基酸含量及结构影响其抗运动疲劳活性,然而目前对此还知之甚少。因此,本实验对鹿血粉进行超微粉碎处理,以氨基酸态氮、干燥失重为考察指标优化其酶解条件,并进行液相色谱分析及抗运动疲劳活性评价,以期为鹿血的合理利用及产品开发提供理论依据。
1 材料与方法
1.1 材料
鹿血为梅花鹿()膛血的真空冷冻干燥粉,吉林省吉鹿源生物科技有限公司提供;动物蛋白酶(活性为1 500 U·g-1),南宁庞博生物工程有限公司;粮食酒基,重粮酒业有限公司;实验动物:雄性昆明小鼠,4~6周龄,体重20~25 g,重庆医科大学实验动物中心;血尿氮试剂盒C013-1-1、肝糖原试剂盒A043-1-1,南京建成生物工程研究所有限公司。
Agilent 1260(Ⅱ)高效液相色谱仪,美国安捷伦科技有限公司;DXFT-12型精研混炼机,山东鼎信超微粉碎技术有限公司;AB145S 型电子天平,上海上天精密仪器有限公司;RE-201型旋转蒸发仪,郑州凯祥仪器设备有限公司。
1.2 方法
1.2.1 鹿血粉处理 精研混炼机进行超微粉碎,粉碎时间25 min,粉碎温度–19 ~–13 ℃。
1.2.2 鹿血粉酶解 在预实验基础上略作修改。鹿血粉中加入5倍重量的蒸馏水搅拌均匀,按照4 g·L-1比例加入动物蛋白酶,搅拌水浴(50 ℃)酶解6 h后90 ℃灭酶20 min,之后迅速冷却至20 ℃,加入4倍重量57 ℃粮食酒基,搅拌均匀后常温静置24 h,真空抽滤,得鹿血酶解液,4 ℃保存。以未进行超微粉碎鹿血酶解液为对照,以氨基酸态氮、干燥失重为考察指标,评价鹿血酶解效果。氨基酸态氮测定方法参照GB5009.235食品中氨基酸态氮测定方法进行,干燥失重计算方法见公式(1)。

1.2.3 鹿血酶解条件优化 以鹿血超微粉为原料,以氨基酸态氮、干燥失重为指标,考察添加量、酶解时间和酶解温度对鹿血酶解效果的影响,具体操作见1.2.2。在单因素试验基础上,设计L9(34)进行正交试验,因素水平见表1。

表1 鹿血酶解工艺因素水平
1.2.4 鹿血及酶解液HPLC成分分析 色谱条件:色谱柱Cosmosil PBr(4.6×250 mm,5 μm),流动相为0.05%三氟乙酸水溶液(A)- 80%乙腈/0.05%三氟乙酸水溶液(B),梯度洗脱程序为:0~5 min 5% B,5~40 min 5% ~60% B,40~53 min 60%~100% B,53~60 min 100%~5% B,柱温25 ℃,流速1.0 mL·min-1,检测波长220 nm,进样量5 μL。供试品处理:鹿血酶解液旋转蒸发挥去乙醇、水,低温干燥得固体粉末。精密称取粉末25 mg,置25 mL容量瓶中,加水至刻度摇匀,过滤,取滤液,用0.45 μm微孔滤膜过滤即得,同时以未酶解鹿血粉为对照。
1.2.5 鹿血及酶解液抗运动疲劳活性测定 给药:选用雄性昆明小鼠42只,分为3组,每组14只。第1组为鹿血粉给药,第2组为鹿血酶解液给药(以正交试验优化条件制得),第3组为生理盐水给药。各组小鼠自由进食、进水2 d后开始给药,第1、2组每天18:00灌胃给药0.2 mL,灌胃剂量150 mg·kg-1,第3组灌胃给同剂量生理盐水,并自由进食和进水,连续给药10 d。末次给药30 min后,每组取其中7只进行强迫负重游泳力竭实验,另外7只进行强迫负重游泳15 min,测定血尿氮、肝糖原含量。
负重游泳力竭实验:参照Liu等[12]的方法,略有改动。末次给药30 min后,小鼠尾部负重5%体重的锁扣,置于25 ℃恒温水域中游泳,并记录游泳力竭时间。小鼠开始游泳至小鼠头部完全没入水面以下10 s不能浮出水面为游泳力竭时间。若小鼠浮在水面上不动,用玻璃棒在其附近搅动,使其运动。
血尿氮含量测定:末次给药30 min后,将小鼠置于25 ℃恒温水中游泳15 min,心脏取血,制备血浆(EDTA抗凝血,2 000 r·min-1、20 ℃离心20 min,得血浆),使用二乙酰-肟法测定血尿氮的含量(按试剂盒使用说明测定)。
肝糖原含量测定:未次给药30 min 后,将小鼠置于25 ℃恒温水中游泳15 min,取小鼠新鲜肝脏,经生理盐水漂洗后用滤纸吸干,精确称取肝脏100 mg,使用试剂盒A043-1-1测定肝糖原含量(按试剂盒使用说明测定)。
1.3 数据处理
各组实验均重复3次以上,所有数据采用SPSS统计软件进行处理,以(`x±s)表示,以<0.05 为差异有统计学意义。
2 结果与分析
2.1 超微粉碎处理对鹿血酶解效果的影响
如表2所示,经超微粉碎处理后,鹿血酶解液干燥失重比对照组高62.2%,氨基酸态氮含量比对照组多2.1倍,差异均达到极显著(<0.01)。

表2 超微粉碎处理对鹿血氨基酸态氮、干燥失重的影响
注: **为0.01水平上的显著性差异。
2.2 鹿血酶解条件的优化
如表3所示,极差分析结果表明在3个因素中,对鹿血酶解效果影响最大因素是酶添加量,其次是酶解时间,45~50 ℃时酶解温度影响较小。氨基酸态氮含量、干燥失重2个指标测定结果均表明较佳的酶解组合是A2B2C3,即动物蛋白酶的添加量为4 g·L-1,酶解时间为6 h,酶解温度为55 ℃,此时氨基酸态氮含量为0.63 g·100 mL-1,干燥失重为60.04%。

表3 鹿血酶解工艺正交试验设计与结果
2.3 鹿血及酶解液HPLC成分分析
鹿血及鹿血酶解液HPLC色谱图如图1所示。鹿血粉在该色谱条件下色谱峰较少,仅出现2个较明显的色谱峰,而鹿血酶解液色谱峰明显。鹿血酶解液化学成分复杂,在220 nm条件下,可较好地分布在2.979~23.981 min的保留时间范围内,可清晰辨识2个部分的色谱峰,第1部分保留时间为2.979~3.661 min;第2部分保留时间为12.701~23.981 min。

图1 鹿血(a)及鹿血酶解液(b)的HPLC色谱图
Figure 1 HPLC chromatogram of dried deer blood () (a) and its hydrolysate (b)
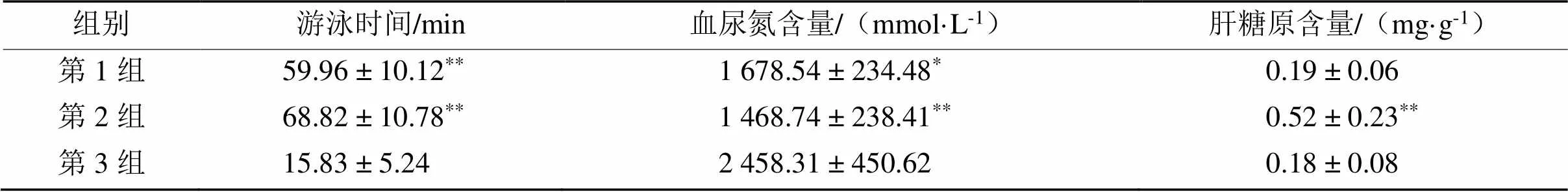
表4 鹿血及酶解液给药对小鼠游泳时间、血尿氮和肝糖原含量的影响
注: *和**分别为0.05及0.01水平上的显著性差异。
2.4 鹿血及酶解液抗运动疲劳活性研究
由表4可知,以优化后的鹿血酶解液连续给药10 d后,小鼠负重游泳时间为(68.82 ± 10.78) min,比对照组的(15.83 ± 5.24) min多3.35倍,差异极显著(<0.01);血清中尿素氮含量为(1 468.74 ± 238.41) mmol·L-1,比对照组少40.2%,差异极显著(<0.01);肝糖原含量为(0.52 ± 0.23) mg·g-1,比对照组多1.9倍,差异极显著(<0.01)。对比第1和第2组时发现,以鹿血粉、鹿血酶解液连续给药10 d后,均可极显著(<0.01)提高小鼠负重游泳时间,但两组之间差异不显著(≥ 0.05);在降低小鼠血尿氮含量方面,鹿血酶解液给药组的效果显著(<0.05)优于鹿血粉给药组;在提高小鼠肝糖原含量方面,鹿血酶解液给药组的效果极显著(<0.01)优于鹿血粉给药组。
3 讨论与结论
研究表明,鹿血具有抗疲劳的生理活性,且大多与鹿血多肽的分子量、含量及水解氨基酸含量、构成有关,市场上可见压片糖果、饮料等鹿血功能性食品,但是对鹿血分子量分布与抗疲劳活性相关性的研究较少,导致产品功能与成分相关性模糊不清,难以制定具有科学依据的产品质量标准,因此有必要对此进行研究。中药超微粉是指中药材经超微粉碎设备处理后制得的超细粉末,其粒径一般以达到微米级为主,部分可达到亚微米级和纳米级[13]。对于大多数中药材,其药用成分主要分布于细胞内,物料经超微粉碎后,由于粒度更细,比表面积显著增大,细胞破壁率明显提高,有效成分可以穿过细胞壁直接与外部接触,从而提高药物的生物利用度,这在白术[14]、山银花[15]等中药材上已见相关报道,但对鹿血进行超微粉碎处理还鲜见报道。
前人研究发现,鹿血的抗疲劳效果随着水解程度的增加而增加[8],因此本实验在酶解之前对鹿血粉进行超微粉碎处理,结果表明超微粉碎处理可极显著(<0.05)提高鹿血酶解液中的氨基酸态氮含量及鹿血的干燥失重;HPLC色谱图显示鹿血酶解液出现较多明显色谱峰,而鹿血粉在该色谱条件下色谱峰较少。由此说明鹿血经超微粉碎、酶解后产生较多氨基酸(支链氨基酸)和肽类物质。支链氨基酸一方面可促进运动的能量储备和利用,另一方面能通过竞争性抑制而减少5-羟色胺的合成, 延缓疲劳的出现[16],这可能是鹿血酶解液给药组小鼠肝糖原含量极显著(<0.01)高于鹿血粉给药组及对照组的原因。
血尿氮是蛋白质的代谢产物,是评价机体运动疲劳的一个重要指标,机体对运动应激的适应能力越差,血尿氮增加越明显,疲劳发生得越快[17]。实验发现,与鹿血粉给药相比,鹿血酶解液给药组可显著(<0.05)降低小鼠血尿氮含量,但在提高负重游泳时间上,差异不显著(≥ 0.05),说明鹿血酶解液给药可延缓小鼠疲劳的发生,但抗疲劳效果可能不会随着酶解程度的增加而增强,这与尹晓平等[8]在酶解马鹿茸血上的结果不一致,这可能与酶解程度不同有关,后期可对不同酶解程度鹿血抗疲劳效果进行研究。
本实验优化了鹿血的酶解条件,并对酶解物进行液相色谱分析及抗运动疲劳活性评价,结果发现鹿血具有较强的抗运动疲劳活性,鹿血酶解液的抗运动疲劳活性优于原鹿血粉。
[1] 徐馨, 韩欢胜. 鹿血总蛋白分离工艺参数研究[J]. 现代化农业, 2017(4): 55-57.
[2] 何慧楠, 赵大庆, 卢姝言, 等. 柱前衍生HPLC法测定梅花鹿鹿茸和马鹿鹿茸中氨基酸的含量[J]. 中医药导报, 2018, 24(24): 80-84.
[3] 靳艳. 鹿血活性肽在制备降血压药物及保健品中的应用[C]//第八届(2017)中国鹿业发展大会论文集. 海宁, 2017: 10-12.
[4] 张昕, 刘宗文, 秦名扬, 等. 鹿血晶辅助放疗对荷S180肉瘤小鼠免疫功能的影响[J]. 郑州大学学报(医学版), 2018, 53(4): 469-473.
[5] 代朋乙, 黄昌林. 运动性疲劳研究进展[J]. 解放军医学杂志, 2016, 41(11): 955-964.
[6] 罗翔丹, 潘风光, 张铁华, 等. 鹿茸多肽对小鼠耐缺氧和抗疲劳能力的影响[J]. 食品科学, 2008, 29(4): 386-388.
[7] 胡太超, 刘玉敏, 陶荣珊, 等. 鹿茸多肽的抗疲劳作用机制研究[J]. 吉林农业大学学报, 2015, 37(4): 469-476.
[8] 尹晓平, 姜红, 高晓黎, 等. 酶解天山马鹿血分离制备抗疲劳肽的研究[J]. 天然产物研究与开发, 2009, 21(3): 391-394.
[9] 赵丽华, 高冷. 鹿血肽的制备方法及其抗疲劳作用: CN107164446A[P]. 2017-09-15.
[10] 尹晓平. 马鹿茸血酶解制备抗疲劳活性肽的研究[D]. 无锡: 江南大学, 2008.
[11] 刘诚. 姬松茸支链氨基酸的抗运动疲劳作用[J].中国食用菌, 2020, 39(2): 61-63.
[12] LIU J Q, DU C X, WANG Y F, et al. Anti-fatigue activities of polysaccharides extracted from Hericium erinaceus[J]. Exp Ther Med, 2015, 9(2):483-487.
[13] 李婧琳, 王媚, 史亚军, 等. 超微粉碎技术在中药制剂中的应用分析[J]. 现代中医药, 2018, 38(5): 121-123, 130.
[14] 李婧琳, 王媚, 史亚军,等. 超微粉碎对白术饮片粉体学性质和溶出度的影响[J]. 华西药学杂志, 2019, 34(1): 22-26.
[15] 吴振, 詹永, 李红, 等. 超微粉碎对山银花微粒结构、有效成分及其抗氧化能力的影响[J]. 食品与机械, 2018, 34(11): 40-44.
[16] GLEESON M. Interrelationship between physical activity and branched-chain amino acids[J]. J Nutr, 2005, 135(6 suppl):1591S-1595S.
[17] XU C, LV J L, YOU S P, et al. Supplementation with oat protein ameliorates exercise-induced fatigue in mice[J]. Food Funct, 2013, 4(2): 303-308.
Optimization of enzymatic hydrolysisprocess of dried deer blood() and evaluation of its anti-exercise fatigue activity
DU Xiaoqin1, XIA Yan1, ZHANG Xiaoqin1, ZHANG Wanchao1, LIANG Zhengjie1, LYU Junjiang2, WU Zhongbao1
(1. Bio-resource Research and Utilization Joint Key Laboratory of Sichuan and Chongqing, Chongqing Institute of Medical Planting Material, Nanchuan 408435; 2. Chongqing Medical and Pharmaceutical College, Chongqing 401331)
To optimize the enzymatic hydrolysis process of dried deer blood (), the components were analyzed by HPLC (High performance liquid chromatography) and its anti-exercise fatigue activity was further evaluated. An orthogonal experiment was carried out to optimize the parameters (the amount of enzyme, enzymolysis time and temperature) using amino acid nitrogen content and loss on drying as indexes. The anti-exercise fatigue activity was analyzed using swimming time under load, hematuria nitrogen content and muscle glycogen content of mice as indexes. Results indicated that the optimal parameters for enzymatic hydrolysis of dried deer blood were 4 g·L-1of enzyme content, 55 ℃hydrolysis for 6.0 h with 0.63 g·100 mL-1of amino acid nitrogen and 60.0% of loss on drying. HPLC analysis showed that the peak of dried deer blood () was basically few, while the peak of the hydrolysate was obvious. Compared with the control group, the hydrolysate of dried deer blood () could significantly<0.01) increase the swimming time and the liver glycogen content, decrease the blood urea nitrogen content in the mice; dried deer blood () could increase the swimming time significantly (<0.01), decrease the blood urea nitrogen content significantly (<0.05) in the mice, but it had little influence on the liver glycogen content. In conclusion, the anti-exercise fatigue effects of dried deer blood () enhanced notably after being hydrolyzed.
dried deer blood () ; enzymolysis; HPLC; exercise fatigue
S825; TS251.93
A
1672-352X (2021)03-0518-05
10.13610/j.cnki.1672-352x.20210706.015
2021-7-7 10:15:14
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210706.1648.030.html
2020-08-18
重庆市科技局项目(19KF10-2012)和重庆市企业技术创新专利导航项目(CQIPOS2020)共同资助。
杜小琴,助理研究员。E-mail:duxiaoqin1814@sina.com
吴中宝,副主任中药师。E-mail:wuzhognbao7788@sina.com
