miR-127-3p对气道瘢痕成纤维细胞的增殖和Ⅰ、Ⅲ型胶原蛋白、α-平滑肌肌动蛋白分泌的影响
2021-08-13叶乃郗何杰李小燕王国栋余觅张维肖秋红任召强孙建李万成
叶乃郗 何杰 李小燕 王国栋 余觅 张维 肖秋红 任召强 孙建李万成
1成都医学院临床医学院、第一附属医院呼吸与危重症医学科 610500;2烟台市牟平区中医医院病理科 264100
良性气道瘢痕狭窄是由多种病因引起的一种气道肉芽组织增生、挛缩或软骨塌陷导致的气道阻塞性疾病,重度的气道狭窄可引起患者迅速出现呼吸衰竭甚至窒息死亡[1-2]。在欧美国家,良性气道瘢痕狭窄的主要病因是气管插管或气管切开等机械性损伤导致的瘢痕增生[3]。在我国,随着呼吸机辅助呼吸技术的广泛开展,由机械通气损伤引起的良性气道狭窄也在逐年增多[4]。据统计,大约20%的良性中央气道狭窄是由气管插管或气管切开所引起的[5]。研究表明,多种分子机制可导致气道瘢痕狭窄,如气道上皮细胞间质转化,生长因子、炎症因子刺激成纤维细胞向肌成纤维细胞分化,过多的胶原蛋白分泌,Wnt/β-catenin信号通路激活加速气道软骨的破坏等[6-8]。由于多种分子机制相互作用,进而导致了气道狭窄的形成。
微小RNA (mircroRNA,miRNA)是细胞中重要的调控因子,多种组织器官的细胞分化、病理性纤维化、上皮间质转化等重要的生理病理过程都有它的参与[9]。Zhang等[10]通过miRNA 微阵列芯片研究指出人皮肤瘢痕组织中存在着差异表达的miRNA,且这些miRNA 与瘢痕发生发展密切相关。Wang 等[11]研究表明miR-21 可以通过调控PTEN/PI3K/Akt通路抑制皮肤瘢痕成纤维细胞的增殖。气道瘢痕和皮肤瘢痕的形成机制有相似之处,然而,对于miRNA 对靶基因的定位及其在气道瘢痕中的调控机制尚未见研究。因此,本课题组通过提取气道狭窄后瘢痕组织样本中的RNA 进行芯片分析,筛查出有表达差异的miRNA,并研究表达差异显著的miRNA 对气道瘢痕成纤维细胞的作用,希望对气道狭窄的治疗提供一定的理论基础。
1 对象与方法
1.1 研究对象 组织样本均来源于2018年1月至2020年1月成都医学院第一附属医院呼吸与危重症医学科就诊的良性气道瘢痕狭窄的患者8例。其中男4例,女4例。年龄范围为34~64岁,平均年龄(50.50±11.52)岁。纳入标准:(1)因气管插管或气管切开或外伤导致中央气道狭窄;(2)经气管镜取气道新生肉芽组织后病理检查均证实为增生性瘢痕组织。排除标准:(1)由于肺部肿瘤导致的气管狭窄;(2)合并有严重肝肾功能不全、凝血障碍或心肺功能不全;(3)合并其他部位肿瘤。瘢痕组织标本取自最典型气道瘢痕中央区域,正常气道黏膜组织取自非瘢痕狭窄区域。本研究经过成都医学院第一附属医院伦理委员会批准,所有的组织样本采集均获得患者本人及家属同意并签署知情同意书。
1.2 主要材料与仪器 0.25% Ⅰ型胶原酶购自广州锐博生物有限公司;DMEM 培养液、MTT 试剂、胎牛血清购自美国Gibco公司;磷酸盐缓冲液、细胞裂解液、二甲基亚砜、0.25%胰蛋白酶、Trizol购自上海善然生物科技有限公司;反转录和RT-PCR试剂盒购自日本TaKaRa公司;miR-127-3p模拟物、NC 模拟物、miR-127-3p抑制物、NC 抑制物及各种引物购自杭州海润生物科技有限公司;丝裂原活化蛋白激酶4 (mitogen-activated protein kinase 4,MAPK4)、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白及α-平滑肌肌动蛋白 (smooth muscle actin-α,α-SMA)、GAPDH 抗体及二抗购自万类生物科技有限公司;SYBR Green购自美国Promega公司,Lipofectamine2000转染试剂购自上海懿贝瑞生物科技有限公司,双荧光素酶报告基因检测试剂盒及pmirGLO 载体购自杭州海润生物科技有限公司。
1.3 实验方法
1.3.1 组织RNA 提取 从液氮中拿出部分组织标本,将其粉碎后添加1 ml Trizol并使其充分混合,200μl三氯甲烷滴入混合液中。将混合液离心,加入500μl异丙醇,并再次离心后留取沉淀。滴注DEPC 处理水溶解沉淀,孵育10 min,-80 ℃保存。
1.3.2 基因芯片分析 将最终得到的miRNA 片段送至广州辉俊生物科技有限公司进行芯片分析。本研究检测miRNA 的差异表达,由送检的8对气道瘢痕组织和正常气道黏膜组织的RNA 提供。芯片(Agilent Human 2.0 microRNAs表达谱芯片)由广州辉俊生物科技有限公司提供,其数据源于Sanger miR Base数据库 (http://www.mirbase.org),用R 软件 (版本号3.6.1)绘制热图。选择表达差异基因最明显的miR-127-3p作为研究对象,采用公共数据库网站TargetScan Human (http://www.targetscan.org)预测miR-127-3p的下游靶基因,选择预测分值最高的靶基因进行研究。
1.3.3 气道瘢痕成纤维细胞的分裂和培养 将用于成纤维细胞分离的组织,用PBS 冲洗液冲洗3遍,进而剪碎,添加0.25%Ⅰ型胶原酶溶解,在37 ℃下振荡 (120 r/min)消化3 h。用等体积的含10%胎牛血清的DMEM 培养液终止上述混合液的消化,进而用200目筛网过滤,收集到离心管后弃去上清液,用培养液重悬细胞,按照4×104cells/cm2的密度接种于100 mm 培养皿中,继续培养,置于37 ℃,5% CO2条件下。后面的实验细胞使用第2代和第3代细胞。
1.3.4 miR-127-3p模拟物与抑制物转染实验 将瘢痕成纤维细胞接种于6 孔板中,根据Lipofectamine2000说明书将100 nmol/L的NC 模拟物、miR-127-3p模拟物、miR-127-3p 抑制物分别转染进入瘢痕成纤维细胞中;安静放置20 min后,先加入培养基,再倒入平板内混合均匀;后续实验在转染24 h后进行。
1.3.5 RT-PCR 反应 根据Ta KaRa反转录试剂盒说明书,使RNA 反转录成cDNA,继而用SYBR试剂盒进行RT-PCR 反应,使其进行反应40 个循环,以U6 为内参检测miR-127-3p,以GAPDH 为内参检测其他指标。采用ABI Prism 7500 SDS软件对实验结果进行分析。引物见表1。

表1 RT-PCR 引物序列
1.3.6 蛋白质印迹 (Western-blot)检测 使用裂解缓冲液后在细胞和组织中提取出蛋白,进而对其蛋白检测。取30μg蛋白进行SDS-PAGE 电泳(80~130 V),100 V 转印1 h,用脱脂奶粉封闭2 h,一抗4℃孵育过夜,二抗室温孵育1 h,ECL发光。通过Western-blot成像系统采集图像,并分析条带结果。
1.3.7 双荧光素酶报告实验 利用PCR 技术扩增MAPK4片段,并克隆到新建报告载体pmir GLO上,突变pmir GLO-MAPK4-WT 上miR-127-3p结合位点利用Stragene点突变试剂盒,新建报告载体pmir GLO-MAPK4-Mut。使用miR-127-3p模拟物或NC 模拟物转染至成纤维细胞,用Dual Luciferanse®Reporter Assay system 试 剂 盒 和Promega GLOMAX 发光仪在48 h 后检测各组细胞海肾荧光素酶活力。
1.3.8 MTT 实验 在96孔培养板中接种细胞,按照1×104的数量;放在37 ℃二氧化碳细胞培养箱内培养24 h,分别转染miR-127-3p模拟物/阴性对照/空白对照在瘢痕成纤维细胞中;在转染后0、24、48、72 h 4个时间点,用MTT 法检测各组成纤维细胞的增殖情况。MTT 检测法为:培养结束后在每个孔中加入5 mg/L 的MTT 试剂20 ml,在37℃条件下孵育4 h,然后添加培养液,在各孔中加入150 ml二甲基亚砜,置于振荡器内振荡10 min,最后放置在酶标仪中进行上机检测,在570 nm 波长处测定其吸光度值。
1.4 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料符合正态分布,以±s表示,使用非配对t检验对各组进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 气道瘢痕狭窄气管镜检查及病理情况 病例详细资料见表2,部分病理及气管镜图像见图1~3,所有患者均经气管镜下介入治疗并钳夹狭窄处瘢痕组织,狭窄程度有所缓解。

图1 病例1病理报告显示气管黏膜中出现大量呈结节状或漩涡状分布形成胶原小结节的纤维组织增生,诊断增生性瘢痕组织 HE×100 图2 病例1气管镜见气管上段瘢痕样新生物 图3 病例2气管镜见气管中段黏膜挛缩及瘢痕样新生物
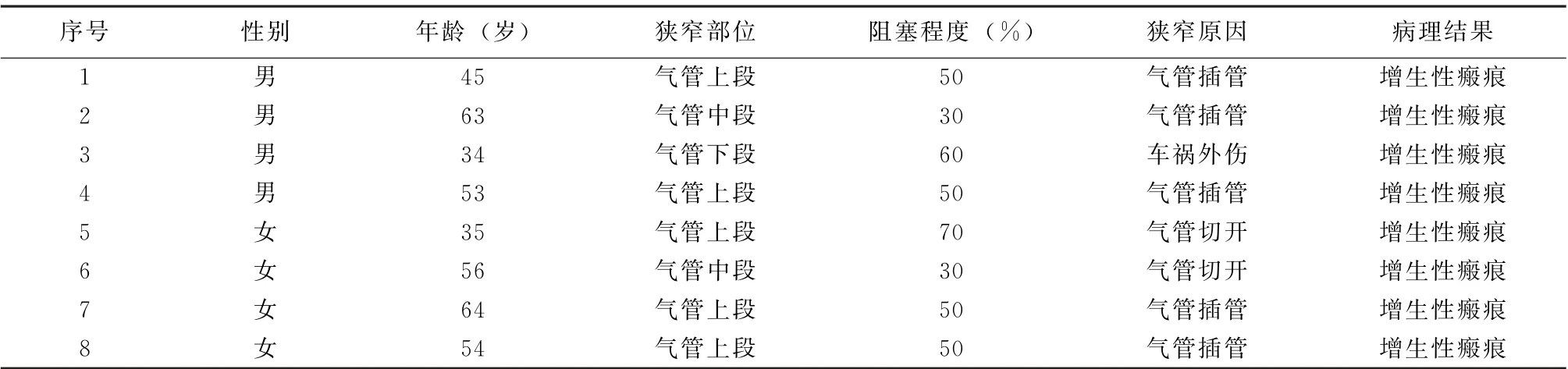
表2 8例气道瘢痕狭窄患者的基本资料
2.2 高通量miRNA 芯片筛选出差异表达的miRNA 芯片检测结果提示:气道瘢痕与正常气道黏膜组织中存在多种不同表达的miRNA。其中miR-409-3p、 miR-382、 miR-203、 miR-493-5p、miR-154表达上调,miR-127-3p、miR-92 表达下调。见图4。
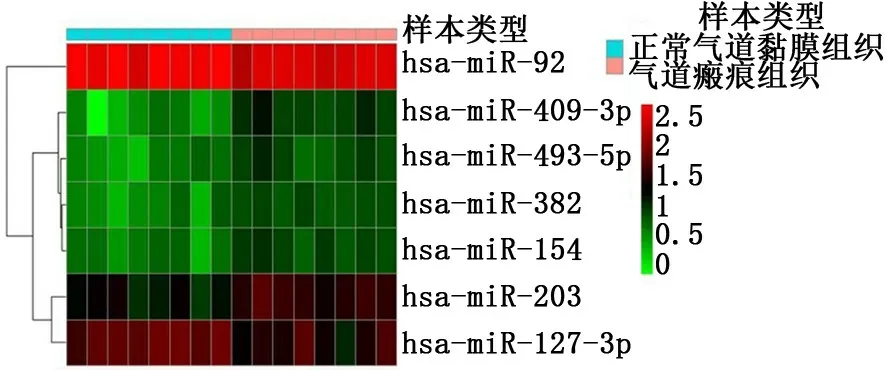
图4 芯片分析发现在气道瘢痕组织和正常气道黏膜组织中多种miRNA 存在差异 (n=8)
2.3 miR-127-3p在气道瘢痕组织中的表达 为了进一步验证芯片的分析结果,对气道瘢痕组织和正常气道黏膜组织进行miR-127-3p 的RT-PCR检测。结果显示,与正常气道黏膜组织 (0.946±0.012) 相 比, miR-127-3p 在 气 道 瘢 痕 组织(0.512±0.014)中表达明显降低 (t=66.572,P<0.05)。见图5。
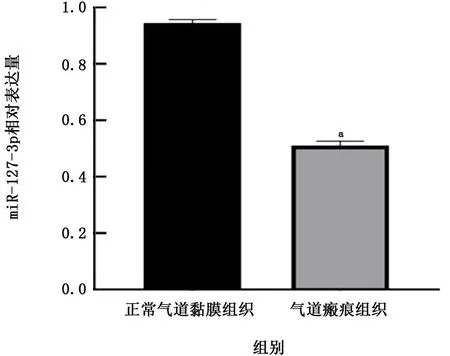
图5 正常气道黏膜组织和气道瘢痕组织中miR-127-3p的表达
2.4 miR-127-3p与MAPK4可靶向结合 芯片分析结果表明miR-127-3p在气道瘢痕组织中表达明显下调。通过公共数据库网站TargetScan Human预测miR-127-3p的下游靶基因,发现miR-127-3p可与多个下游靶基因结合,根据预测分数的最高值,选择MAPK4为研究的下游靶基因。MAPK4的3'UTR 可与miR-127-3p相结合,见图6。

图6 TargetScan Human预测miR-127-3p与MAPK4间具有靶向结合位点
本研究通过双荧光素酶报告基因实验验证靶向关系,并根据预测结合区域序列构建了MAPK4-WT-3'UTR 和MAPK4-Mut-3'UTR。结果显示:miR-127-3p高表达会明显导致含有野生型MAPK4质粒的荧光素酶活性被抑制 (P<0.05),但对于突变型MAPK4质粒的荧光素酶活性并无明显抑制作用。见图7。
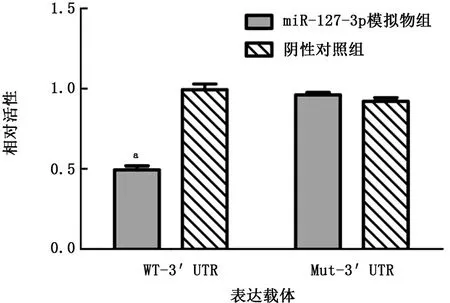
图7 双荧光素酶报告实验结果
2.5 miR-127-3p对MAPK4 的作用 通过miR-127-3p模拟物和抑制物的转染,发现miR-127-3p可以在蛋白和mRNA 水平上抑制MAPK4 的表达,同时miR-127-3p可减少α-SMA 的分泌,抑制Ⅰ、Ⅲ型胶原蛋白生成。见图8、9。

图8 各组MAPK4、Ⅰ型胶原蛋白、Ⅲ胶原蛋白及α-SMA的m RNA 表达
2.6 miR-127-3模拟物转染对瘢痕成纤维细胞增殖能力的影响 瘢痕成纤维细胞经转染miR-127-3p模拟物后,在48 h及72 h,成纤维细胞吸光度值明显少于阴性对照组和空白对照组 (P值均<0.05)。见图10。
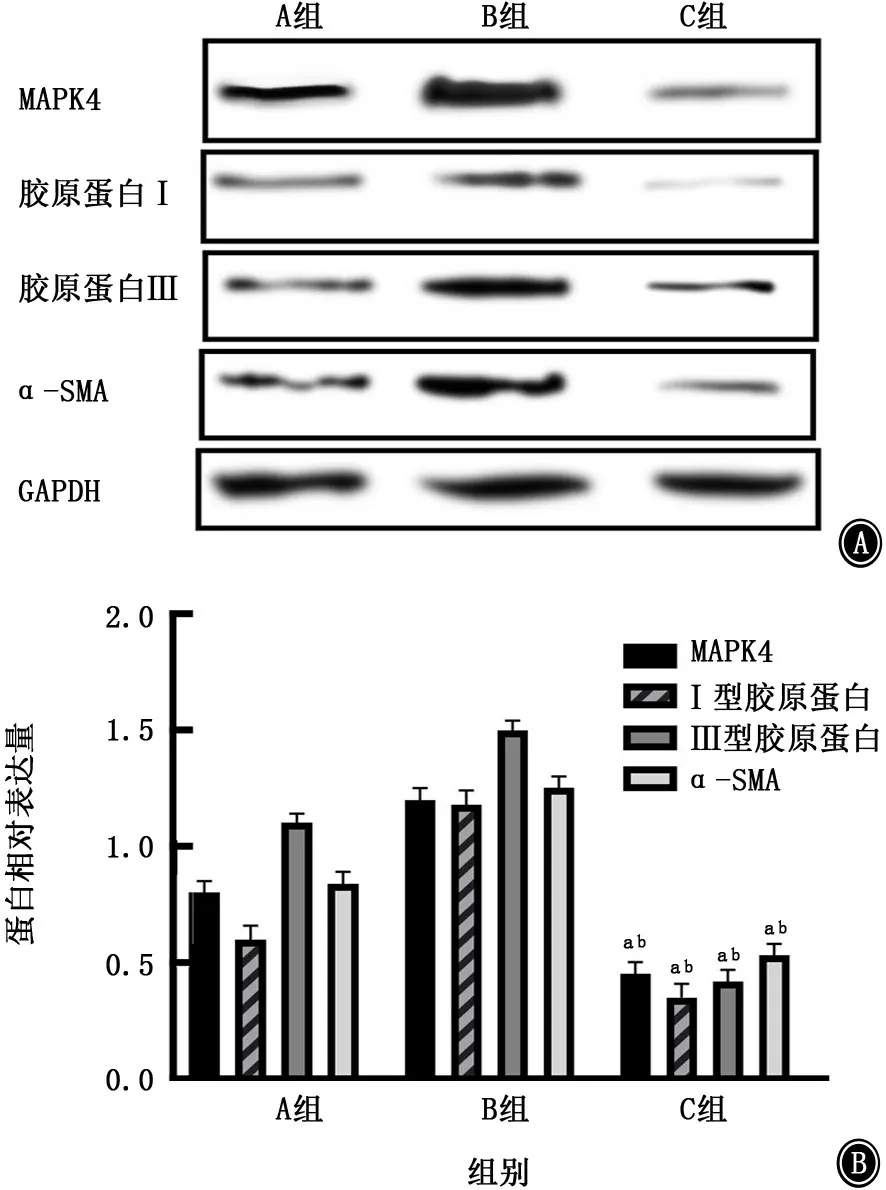
图9 各组MAPK4、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白及α-SMA的蛋白表达 A:电泳图;B:柱状图
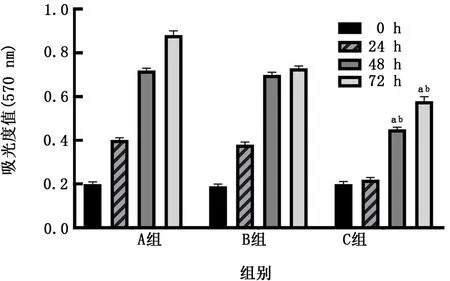
图10 过表达miR-127-3p对瘢痕成纤维细胞增殖能力的影响
3 讨论
气道瘢痕引起的狭窄在轻者会出现喘息、气促等表现,重者可引发严重的呼吸衰竭,此外气道狭窄还会导致慢性咳嗽、排痰困难、继发性肺炎等相关疾病,给患者身心造成严重的危害[12-13]。气道狭窄的产生机制和病理学特点其本质也是增生性瘢痕,与皮肤增生性瘢痕非常相似,都是在机体组织受到过度损伤的情况下发生了异常修复,导致了纤维组织过度增生,并且成纤维细胞大量向肌成纤维细胞转化[14-15]。研究表明,成纤维细胞的过度增殖伴随着大量的细胞外基质中Ⅰ型胶原蛋白、Ⅲ型胶原蛋白以及糖蛋白的沉积,而成纤维细胞向肌成纤维细胞转化过程中会导致α-SMA 增高,使胶原蛋白分泌增加,胶原纤维排列的结构发生严重紊乱[16]。虽然现在国内外对气道瘢痕开展了一系列的研究并取得了一定成功,但气道瘢痕狭窄的机制仍然不清。近年来,随着高通量测序技术的普及,在肿瘤领域已报道miRNA 参加了多种生理病理过程,如细胞分化、组织发育、组织修复和纤维化等[17],在皮肤研究领域里,miRNA 也被报道参与了皮肤瘢痕的进展[18],但对于miRNA 在气道瘢痕中的表达和功能却少有研究。
本研究通过芯片分析技术筛查了气道瘢痕组织中差异性表达的miRNA,发现miR-127-3p在瘢痕组织中呈现出低表达趋势,通过RT-PCR 检测瘢痕组织中miR-127-3p的表达,也验证了芯片测序的结果。接着通过公共数据库预测miR-127-3p的靶基因,发现MAPK4基因不仅是miR-127-3p靶基因中预测分数最高的,而且可能在气道瘢痕形成中也发挥着作用。哺乳动物体内广泛存在着的一种丝氨酸-苏氨酸蛋白酶,称为MAPK。MAPK 相关通路参与了细胞生长、分化、迁移、免疫反应等过程,可以受到细胞因子、神经递质、激素、缺氧等激活[19]。MAPK 信号通路中以p38MAPK 信号通路与病理性瘢痕关系密切。Yang等[20]通过全基因组重测序研究发现,p38MAPK 信号通路的相关基因MAPK4在瘢痕疙瘩中过度表达,其与瘢痕疙瘩的类肿瘤生长特性密切相关。研究[21-22]指出MAPK4具有调节免疫应答反应的作用,MAPK4敲除后可减轻急性肺损伤小鼠模型的肺部炎症反应,MAPK4可能促进了转化生长因子β的升高。而在气道瘢痕形成的过程中,局部损伤的气管的炎症细胞因子 (如转化生长因子β、IL-6、IL-8 等)表达量也显著升高,推测MAPK4可能通过激活炎症因子的方式促进Ⅰ型胶原蛋白、Ⅲ型胶原蛋白及α-SMA 的表达,从而促进气道瘢痕的发生。本研究通过双荧光素酶报告基因实验以及m RNA 和蛋白表达水平的结果,均证实miR-127-3p可以直接与MAPK4 结合而抑制MAPK4 的表达,提示miR-127-3p可能通过MAPK4 减轻气道瘢痕的形成。
为了进一步探究miR-127-3p在气道瘢痕中的生物学作用,本研究采用miR-127-3p模拟物上调瘢痕成纤维细胞的miR-127-3p的表达水平,结果显示上调miR-127-3p后,会抑制瘢痕成纤维细胞的增殖,且MAPK4、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白及α-SMA的表达水平均下降;当抑制miR-127-3p时,MAPK4、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白及α-SMA表达水平有所上升。许多研究指出降解减少和合成过多的Ⅰ型和Ⅲ型胶原蛋白可以导致增生性瘢痕的形成[23]。本实验结果证明,过表达miR-127-3p可以抑制Ⅰ型和Ⅲ型胶原蛋白的分泌,从而抑制瘢痕的形成。同时,α-SMA 作为细胞骨架蛋白,是成纤维细胞收缩表型的典型标志,是肌成纤维细胞所分泌的特性蛋白,成纤维细胞表达α-SMA后,激活转化成肌成纤维细胞,是组织纤维化的早期表现[22]。本研究中上调miR-127-3p后α-SMA 降低,表明miR-127-3p可能通过阻止成纤维细胞向肌成纤维细胞转化导致α-SMA 分泌水平下降,从而减轻气道瘢痕的形成。但本研究仅进行了细胞实验,对于miR-127-3p对气道瘢痕的作用,在动物体内实验验证有待深入研究;同时,本研究只对预测分数最高的靶基因MAPK4进行了验证,miR-127-3p对瘢痕机制的影响可能通过多个靶基因共同作用,需进一步进行确认。
综上所述,miR-127-3p 在人气道瘢痕组织中呈低表达,对成纤维细胞的增殖有抑制作用,并且可靶向下调MAPK4的表达,同时miR-127-3p还具有抑制成纤维细胞分泌胶原蛋白和α-平滑肌肌动蛋白的作用。通过miR-127-3p的研究有助于对气道狭窄的治疗提供一定的理论基础。
利益冲突所有作者均声明不存在利益冲突
