注射用艾普拉唑钠联合生长抑素对重症急性胰腺炎患者氧化应激指标及急性呼吸窘迫综合征发生率的影响
2021-08-12束颖
束 颖
(河南省周口市中心医院急诊科,周口 466000)
重症急性胰腺炎(severe acute pancreatitis,SAP)病情进展快,随着病情进展患者机体可持续产生大量氧自由基。当氧自由基产生量超过抗氧化系统清除能力时,会出现氧化应激[1]。氧化应激可损伤毛细血管内皮细胞,增加血管通透性,加重胰腺微循环障碍程度,导致病情难以控制,使预后风险升高[2]。此外,SAP还可诱发多种并发症,其中急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是常见并发症之一,以呼吸困难、进行性低氧血症为主要特征,具有较高病死风险,并可进一步增加患者预后风险[3]。针对氧化应激及ARDS的负性影响,临床对患者实施积极治疗尤为必要。目前可用于治疗SAP的方法包括手术及药物治疗,其中药物疗法是SAP治疗的重要手段,注射用艾普拉唑钠、生长抑素(SS)是2种常用药物。注射用艾普拉唑钠可通过抑制胃酸分泌,保护黏膜屏障功能[4]。SS可减轻患者全身炎症状态、抑制胰酶分泌、缓解肠道黏膜功能损伤[5]。结合2种药物在SAP中的应用效果,推测联合使用可以提高SAP患者的整体疗效获益,对减轻氧化应激、预防ARDS有一定效果,且有助于降低SAP患者预后风险。基于此,本研究进一步观察注射用艾普拉唑钠联合SS治疗SAP的可行性,分析联合治疗方案对患者氧化应激、ARDS发生的影响,以期为指导此类药物合理使用提供参考。现报道如下。
1 资料与方法
1.1 一般资料
选取本院2017年2月~2020年2月收治的80例SAP患者作为研究对象,采用随机数字表法分为对照组和观察组,每组40例。对照组:男性28例,女性12例;年龄53~72岁,平均年龄(59.28±4.21)岁;发病至入院时间3~19 h,平均时间(11.42±2.68) h;改良Marshall评分[6]3~6分,平均评分(4.95±0.38)分。观察组:男性30例,女性10例;年龄52~73岁,平均年龄(58.91±4.54)岁;发病至入院时间3~18 h,平均时间(11.61±2.58) h;改良Marshall评分3~6分,平均评分(4.63±0.45)分。两组一般资料比较无统计学差异(P>0.05),具有可对比性。本研究经本院医学伦理委员会批准。患者及家属知情且签署知情同意书。
纳入标准:① 符合《中国急性胰腺炎诊治指南(2019年,沈阳)》[7]中有关SAP诊断标准者。② 血清淀粉酶或脂肪酶活性>3倍正常值上限者。③ 合并急性上腹部疼痛者,部分患者疼痛向背部放射。④ 合并>48 h的单器官或多器官功能障碍者。
排除标准:① 合并恶性肿瘤者。② 合并心肺基础性疾病者。③ 合并慢性炎症疾病者。④ 处于昏迷状态者。⑤ 入组前1周接受过相关治疗者。⑥ 对本研究药物有过敏反应者。
1.2 治疗方法
两组均接受液体复苏、抗感染等常规治疗。在此基础上,对照组采用SS治疗,将注射用生长抑素[海南中和药业股份有限公司,国药准字H20043481,批号20161205、20181121,规格0.25 mg(按SS计)] 3 mg 与5% 100 ml葡萄糖注射液充分混合,静脉滴注,滴注速度为0.25 mg/h,qd,连续治疗6天。观察组在上述基础上,将注射用艾普拉唑钠[丽珠集团丽珠制药厂,国药准字H20170019,批号20161124、20180906,规格10 mg(按C19H18N4O2S计)]20 mg(初始剂量)与200 ml 0.9%氯化钠注射液充分混合,静脉滴注,30 min内滴注完,随后剂量改为10 mg/次,将10 mg注射用艾普拉唑钠与100 ml 0.9%氯化钠注射液充分混合,静脉滴注,qd,连续治疗6天。
1.3 评价指标
两组均连续治疗6天,比较治疗后患者情况。① 记录两组治疗期间ARDS发生率及病死情况:ARDS诊断需符合柏林标准[8],通过X线造影结合血氧指标确诊。② 氧化应激指标:分别于治疗前、治疗6天时,于清晨抽取患者空腹外周血3 ml,3000 r/min离心10 min,取血清。采用氧化应激检测试剂盒(英国沃特曼公司)检测血清丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平,检测方法选用酶联免疫吸附试验。③ 记录两组治疗期间不良反应发生情况,包括脸红、腹泻、恶心、眩晕、胸闷、嗜睡,通过患者主诉症状评估。
1.4 统计学方法

2 结果
2.1 两组ARDS发生率及病死率
观察组ARDS发生率低于对照组,具有统计学差异(P<0.05);两组病死率比较无统计学差异(P>0.05)。见表1。

表1 两组ARDS发生率及病死率比较n=40,n(%)
2.2 两组氧化应激指标比较
治疗前,两组MDA、SOD及GSH-Px水平比较无统计学差异(P>0.05);治疗6天后,两组MDA水平均较治疗前降低,且观察组低于对照组;两组SOD及GSH-Px水平均较治疗前升高,且观察组均高于对照组,具有统计学差异(P<0.05)。见表2。

表2 两组氧化应激指标比较
与同组同指标治疗前比较,a:P<0.05
2.3 两组不良反应发生率比较
两组各项不良反应(脸红、腹泻、恶心、眩晕、胸闷、嗜睡)发生率比较,无统计学差异(P>0.05)。见表3。
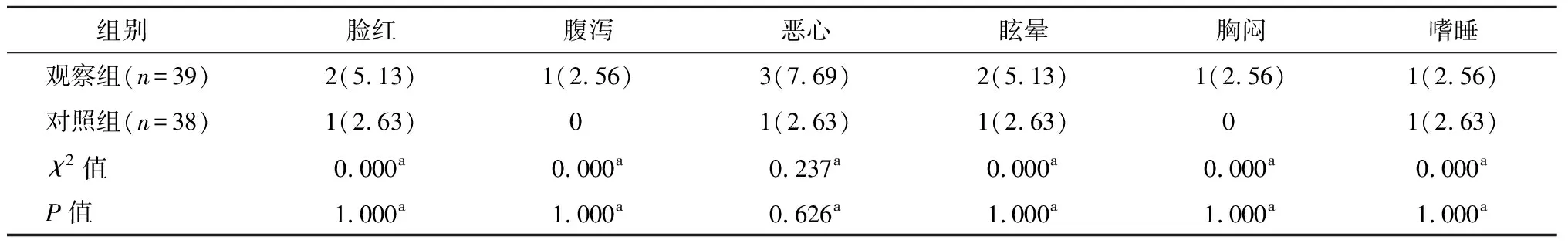
表3 两组不良反应发生率比较 n(%)
3 讨论
SAP作为危重症,对患者实施积极有效的治疗是降低病死率、改善患者预后的重要条件。目前临床用于治疗SAP的方法较多,但尚无特效疗法。主要疗法为手术、液体复苏、药物治疗等,均以预防并发症的发生、减轻患者预后风险为原则。其中,药物疗法是治疗过程中不可缺少的重要环节,联合用药对改善患者病情相关指标、预防并发症的发生有重要意义。
SS是SAP患者常用的治疗药物。SAP患者机体内分布着大量SS受体,在应用SS治疗后,SS可与受体结合,抑制胰腺外分泌,减少环磷酸腺苷合成[9]。此外,SS还可抑制迷走神经兴奋、减少血流量、抑制胰酶胰腺分泌,继而改善患者全身炎症状态[10]。但仅采用SS治疗,难以有效改善SAP患者氧化应激状态,且对ARDS的预防效果并不理想。本研究观察组在SS治疗的基础上联合注射用艾普拉唑钠治疗,结果显示,观察组ARDS发生率低于对照组,两组病死率比较无统计学差异,提示注射用艾普拉唑钠联合注射用SS虽对SAP患者的短期病死率无明显影响,但可有效预防ARDS的发生。主要原因在于,SAP发生、病情进展与肠道细菌移位、继发细菌感染密切相关,其中肠黏膜屏障功能损伤是关键病理环节,可导致肠道细菌异常[11]。艾普拉唑钠对改善肠道屏障功能有较好的治疗效果,艾普拉唑钠是新一代质子泵抑制剂,可结合多种酶,形成不可逆的酶抑制复合物,从而发挥抑酸效果,抑制胃酸分泌,保护患者肠道黏膜屏障功能,进而控制病情进展[12]。患者病情改善后,炎性细胞间的相互作用减轻,肺损伤程度减轻,ARDS发病风险随之降低。
本研究结果还提示,治疗6天后,观察组MDA水平低于对照组,SOD及GSH-Px水平高于对照组。MDA是反馈氧自由基脂质过氧化损害程度的主要指标之一,水平越高提示机体氧化应激反应越剧烈;SOD是抗氧化酶,GSH-Px是过氧化氢分解催化酶,两者可反馈机体清除氧自由基和活性氧的能力[13-14]。研究结果提示,经注射用艾普拉唑钠联合注射用SS治疗后,SAP患者的机体氧化应激状态得到有效改善。主要原因在于,自身消化功能异常形成的过氧化损伤是导致SAP患者氧化应激的主要因素,因消化异常产生的活性氧、氧自由基相对减少,而采用注射用艾普拉唑钠治疗SAP后,患者肠道黏膜屏障功能改善、SAP病情进展延缓、腹内压逐渐恢复、胰腺功能损伤减轻,因此氧化应激状态减弱[15]。两组各项不良反应比较无统计学差异,提示注射用艾普拉唑钠联合注射用SS治疗SAP具有一定安全性,可在临床推广应用。两组中均有死亡病例,究其原因,主要是患者年龄较大且病程较长,导致患者病情加重,临床疗效较差,最终死亡。
综上所述,SAP患者采用注射用艾普拉唑钠联合注射用SS治疗疗效较好,患者氧化应激程度减轻,ARDS发生率降低,且联合用药不良反应未明显增加,用药安全可靠。但因本研究选取例数较少,治疗及随访时间较短,且未对患者炎症因子水平、器官衰竭程度进行探讨,结论仍有局限。今后还应扩大样本量、延长治疗及随访时间、增加研究指标,以进一步证实注射用艾普拉唑钠联合注射用SS治疗SAP的价值,指导临床合理治疗SAP。
