14-3-3蛋白在水稻籽粒灌浆过程中的互作靶蛋白鉴定及其对外源激素的响应
2021-08-12张志兴敏秀梅宋果陈花许海龙林文雄
张志兴 ,敏秀梅 ,宋果 ,陈花 ,许海龙 ,林文雄 ✉
1福建农林大学生命科学学院,福州 350002;2福建农林大学/福建省农业生态过程与安全监控重点实验室,福州 350002
0 引言
【研究意义】14-3-3蛋白是植物中普遍存在的一类对生长发育及环境响应起重要作用的调节蛋白[1],探明14-3-3蛋白在水稻籽粒灌浆过程中的时空表达模式及功能,对揭示14-3-3蛋白调控水稻产量与品质的形成具有重要意义。【前人研究进展】14-3-3蛋白主要以同源或异源二聚体形式存在,可以同时与2个靶蛋白或者与1个靶蛋白的2个结构域相互作用,通过与靶蛋白上一小段共有序列的磷酸化丝氨/苏氨酸残基结合来发挥其调控功能,其主要结合模式有RSXpSXP(I型),RXXXpSXP(II型)和 pS/TX-COOH(III型),其中pS和pT分别代表Ser和Thr[2]。14-3-3蛋白通过上述3种磷酸化结合模式与其靶蛋白互作,保证了14-3-3蛋白在生物体中的重要调节功能。在植物中,借助亲和层析和酵母双杂交等方法,已鉴定到300多种与14-3-3蛋白互作的靶蛋白,涉及植物体内多种激素信号转导途径和代谢过程[3-4]。例如,14-3-3蛋白作为一个接头因子能够将 ABA效应因子 VP1(viviparous 1)与受ABA诱导的顺式作用元件ABRE(ABA-responsive element)联系起来,共同调控下游ABA应答基因的表达[5]。14-3-3蛋白通过与转录因子BZR(BRASSINAZOLE-RESISTANT)的相互作用,在植物体内 BR信号通路中起到负调控作用[6]。酵母双杂交系统证实水稻14-3-3蛋白能够和参与乙烯合成的 ACC合成酶(1-aminocyclopropane-1-carboxylate synthase)互作[7]。在模式植物拟南芥中的研究表明,超表达14-3-3蛋白,会显著抑制TCA循环及糖酵解途径中关键酶的活性,从而导致植株糖及含氮化合物含量下降[8]。在鉴定到的 14-3-3靶蛋白中,有很大一部分是与植物淀粉合成代谢相关的,例如蔗糖合成酶(SuS),淀粉合成酶I(SSI)、淀粉合成酶II (SSII),淀粉分支酶同工酶(SBEIIa、SBEIIb)及 ADP焦磷酸化酶大亚基(AGPL)等[9-11]。由此可见,14-3-3蛋白在植物激素信号转导及碳代谢中发挥着重要的作用。众所周知,淀粉合成是籽粒灌浆过程中最重要的代谢途径之一,在这过程中腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)、淀粉合成酶(StS),SuS和淀粉分支酶(SBE)及淀粉去分支酶(DBE)等基因的表达变化及酶活性的高低对淀粉合成具有重要的影响[12-13]。此外,植物内源激素在籽粒的库容及千粒重的形成过程中起到了重要的调节作用。已有研究表明,籽粒中ABA/IAA、ABA/GA1+3和ABA/(IAA+GA1+3+ ZRS+ABA)的比值与籽粒的灌浆充实密切相关[14]。ZHANG[15]及YANG等[16]研究表明灌浆期适度干旱胁迫能改变籽粒中 ABA的含量,进而提高SuS、AGPase、StS及SBE的活性。一些学者认为籽粒中较高浓度的 GA会降低 StS和SuS的活性,进而导致结实率和产量显著下降[17]。已如上述,植物14-3-3蛋白会通过与其互作靶蛋白结合,进而参与多种激素信号转导及淀粉合成过程。例如,水稻籽粒14-3-3蛋白会响应外源ABA处理而出现显著的蛋白表达及磷酸化修饰的变化,暗示着14-3-3蛋白参与了 ABA调控籽粒灌浆的过程[18]。此外,笔者还发现14-3-3蛋白成员GF14f在弱势籽粒灌浆过程中蛋白表达量相对强势籽粒较大,是导致弱势籽粒灌浆结实差的一个重要的原因[19]。YOU等[20]发现移除穗顶端的强势籽粒后,底端的弱势籽粒中淀粉合成关键酶活性、千粒重及结实率显著得到提高,并进一步通过差异蛋白组学分析,发现弱势籽粒中 14-3-3蛋白的表达量显著下降。可见,水稻 14-3-3蛋白家族在籽粒灌浆过程中发挥着重要的作用。【本研究切入点】水稻籽粒灌浆完成情况对产量及品质的形成至关重要。目前为止,在水稻中共鉴定到8个14-3-3蛋白家族成员(命名为 GF14a-h)[21-23],但对其在籽粒灌浆过程中的表达变化模式及其调控机制仍缺乏系统的分析。【拟解决的关键问题】本研究拟运用实时荧光定量PCR(qRT-PCR)分析14-3-3基因家族在水稻籽粒灌浆不同时期的表达变化模式,并采用亲和层析技术鉴定籽粒中与 14-3-3蛋白互作的靶蛋白,在此基础上,通过籽粒灌浆期外源激素的处理,探明14-3-3及其互作靶基因在籽粒灌浆过程中对激素调控的响应,以期揭示14-3-3蛋白在水稻籽粒灌浆过程中的调控机制。
1 材料与方法
1.1 试验材料
选用大穗型常规水稻“金恢 809”为试验材料,于2014年在福建农林大学(福建省福州市)的校内农场进行,采用桶栽土培的方法进行水稻的种植。水稻种子通过多菌灵灭菌清洗后,置于30℃恒温培养箱,保持其湿润状态。3月20日播种,采用旱育方式育秧,4月20日移栽至塑料桶(40 cm×40 cm)中,每桶移栽3株,单本插。桶栽所用的土壤取自大田水稻土,移栽水稻后的塑料桶放置于顶部覆盖有塑料薄膜的网室内。在水稻全生育期每桶施尿素3.9 g,磷酸钙6.56 g,氯化钾2.1 g,其中60%尿素,50%氯化钾和100%磷酸钙作为基肥,40%尿素和50%氯化钾作为穗肥施用,其他栽培措施与常规的水稻栽培一致。在水稻抽穗开花期,选取长势一致、同一天开花抽穗的主穗进行挂牌标记,在花后5—30 d,每隔5 d收集籽粒样品,液氮速冻后保存于-80℃冰箱中。在水稻花后15 d,分别对籽粒进行外源激素喷施处理,激素浓度的设置参照 YAO[22],YANG[24],ZHANG[25]及李赞堂[26]等的研究报道,分别为 25×10-6mol·L-1ABA,10×10-6mol·L-1IAA,100×10-6mol·L-1GA,50×10-6mol·L-1ZR 和 2×10-4mol·L-1BR,在喷施激素3 h后,收集籽粒样品用于qRT-PCR分析。
1.2 主要试剂
大肠杆菌BL21和原核表达载体PGEX-6P-1,由笔者实验室保存提供。Trans1-T1 Phage Resistant Chemically Competent Cell感受态细胞购自北京全式金生物技术有限公司,基因克隆载体pMD18-T Vector购自TaKaRa公司。植物激素脱落酸(ABA)、赤霉素(GA)、油菜素内酯(BR)和吲哚乙酸(IAA)购自Sigma公司;玉米素(ZT)购自Aladdin公司。总RNA提取试剂Trizol购自TaKaRa公司;cDNA合成试剂盒TIANscript RT Kit、qRT-PCR试剂SuperReal PreMix Plus(SYBR Green)和质粒提取试剂盒购自TIANGEN公司;蛋白亲和吸附基质 Glutathione SepharoseTM 4B及 Ni-Sepharose 6 Fast flow购自GE公司。
1.3 实时荧光定量PCR(qRT-PCR)分析
选取灌浆不同时期的水稻籽粒,去壳后,采用Trizol法提取总 RNA,cDNA第一条链合成按照TIANGEN公司TIANscript RT Kit试剂盒提供的操作步骤进行。依据 NCBI数据库检索得到的 8个水稻14-3-3基因的编码序列,利用Primer Premier 5.0设计相应的qRT-PCR引物,如表1所示。qRT-PCR采用TIANGEN公司SuperReal PreMix Plus(SYBR Green)试剂盒进行。β-actin作为内参,基因的相对表达量采用 2-ΔΔCt的方法进行计算。

表1 试验中用到的qRT-PCR和PCR的引物Table 1 qRT-PCR and PCR primers used in this study
1.4 亲和层析分析
以水稻籽粒cDNA为模板,按表1中的引物序列,扩增GF14b、GF14e的开放阅读框(ORF),并克隆到表达载体 PGEX-6P-1中,构建 GST-GF14b及GST-GF14e融合蛋白表达载体。之后,将重组质粒转化大肠杆菌BL21,IPTG诱导蛋白表达,菌体超声破碎后,离心,将上清液转入Glutathione SepharoseTM 4B吸附柱中,加入15倍柱床体积的PBS缓冲液洗涤柱子,还原型谷胱甘肽洗脱液洗脱后,采用SDS-PAGE检测融合蛋白纯化结果。将灌浆不同时期的水稻籽粒样品去壳混合,液氮研磨,每1 g籽粒加入1 mL含有 50 mmol·L-1Tris-HCl(pH 7.5)、150 mmol·L-1NaCl、4 mmol·L-1MgCl2、0.5 mmol·L-1EDTA、0.5%NP-40、2 mmol·L-1DTT、1 mmol·L-1PMSF 提取缓冲液中,充分混匀,冰上30 min后,4°C 11 000 r/min离心20 min,取上清液,0.22 µm滤膜过滤除杂,获得籽粒非变性全蛋白粗提液。之后,将提取液分别加入GST-GF14b及GST-GF14e融合蛋白的亲和吸附柱中,4℃孵育过夜,加入15倍柱床体积的PBS洗涤5次,还原型谷胱甘肽洗脱后,进行冷冻浓缩处理,再采用SDS-PAGE检测结果。
1.5 靶蛋白质谱鉴定
切取 SDS-PAGE胶上蛋白条带,装于 1.5 mL离心管中,胰蛋白酶酶解后,用于LC-MS/MS质谱鉴定。液相采用高速液相色谱系统 Ultimate 3000(ThermoFisher Scientific),利用色谱柱BioBasic C18 Column(100×0.18 mm,particle size:5 um)对肽段进行分离。LTQ-XL(Thermo Scientific)质谱的具体参数为:喷雾电压条件设为3.5 kV;母离子扫描的范围为400—2 000 m/z;Isolation width为2 Da。二级质谱条件:AGC Target 1e4,1 microscans;碰撞能量:35% CID,CID扫描后选择前10个最高丰度的离子进行PQD扫描。质谱分析所获得的原始数据用Proteome Discoverer1.2软件进行相对定量分析,并利用RGAP7.0蛋白数据库(http://rice.plantbiology.msu.edu)进行蛋白检索,选择至少有2个独立肽段匹配的蛋白作为可信蛋白,FDR阈值设为<5%。
1.6 体外GST-pull down验证
依据质谱鉴定结果,随机选择2个靶蛋白Sucrose synthase 3(SUS3)和Puromycin-sensitive aminopeptidase(PSA),以籽粒的cDNA为模板,按照表1中的引物序列,将扩增的SUS3和PSA的序列克隆到表达载体pet32a中,构建His-SUS3及His-PSA融合表达载体。采用Ni-Sepharose 6 Fast flow对融合蛋白进行纯化,咪唑洗脱液洗脱,进行SDS-PAGE检测。将纯化好的His-SUS3及His-PSA融合表达蛋白,分别加入吸附有GST-GF14b及GST-GF14e融合蛋白的亲和吸附柱中,4℃孵育过夜,还原型谷胱甘肽洗脱后,采用商业化的His抗体(Abmart,中国上海),进行Western blot分析。
1.7 生物信息学及数据分析
蛋白功能 motif位点借助 KEGG(http://www.genome.jp/kegg/kegg2.html)数据库分析。利用检索得到的所有互作蛋白的氨基酸序列,以 Fasta的形式通过Kinasephos(http://kinasephos.mbc.nctu.edu.tw/index.php)在线程序对靶蛋白的Ser和Thr磷酸化位点进行预测分析。采用MapMan 3.6.0软件对互作蛋白的功能及参与的代谢途径进行分析。通过 Gene Ontology(http://geneontology.org/)数据库对互作蛋白的细胞组分进行分析。
采用Microsoft Excel 2007 整理数据和制作图表,DPS V7.05 软件统计分析,以 LSD(P<0.05)检验平均数间的差异显著性。
2 结果
2.1 14-3-3基因在水稻籽粒灌浆过程中的表达变化分析
采用qRT-PCR动态分析了水稻14-3-3基因家族在花后5—30 d的基因表达变化情况。如图1所示,除了GF14h外,其余的7个14-3-3基因家族成员在籽粒灌浆的不同时期均有表达。在整个籽粒灌浆期,GF14a的表达变化不大,GF14d的表达水平随着灌浆的进行逐渐下降,GF14f在花后20 d和25 d的表达水平较高,其余时期的表达水平较低。GF14c和GF14e的表达变化趋势一致,均是在灌浆前期表达变化不大,而在花后25 d和30 d表达水平迅速上升。GF14b基因表达水平从花后10 d就开始迅速上升。本研究进一步选取GF14b及GF14e作为后续的研究对象。
2.2 GF14b和GF14e蛋白功能motif分析
通过 KEGG数据库对 GF14b和 GF14e的蛋白motif进行比对分析(表2),发现GF14b和 GF14e具有 3个相同的 motif类型,分别为 pf:DUF885、pf:14-3-3和 pf:TPR_12。pf:14-3-3和 pf:TPR_12在GF14b和GF14e的氨基酸序列中所处的位置相同,而pf:DUF885所处的位置不同。此外,GF14b和GF14e也具有不同的motif类型,pf:IFT20为GF14b特有的功能motif,pf:FlaF则为GF14e特有的功能motif。
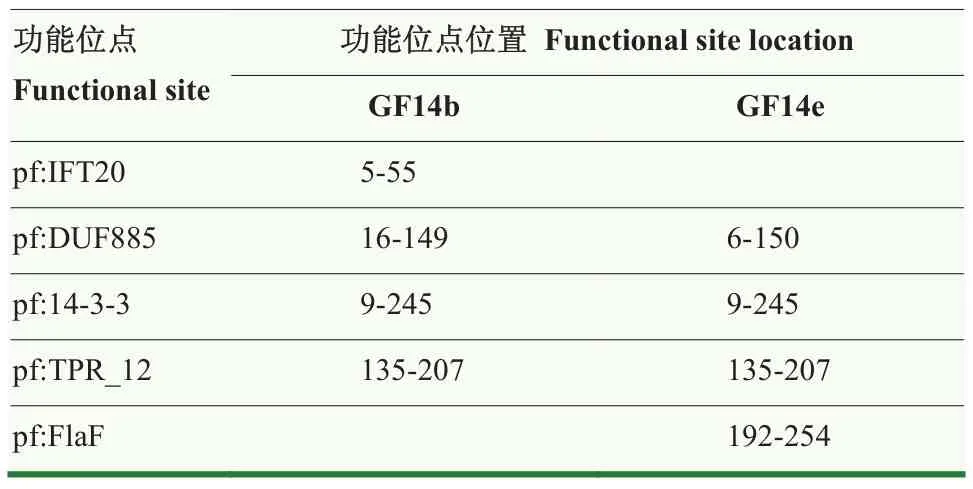
表2 GF14b 和GF14e蛋白功能motif对比Table 2 The functional motif analysis of GF14b and GF14e protein
2.3 GF14b和GF14e互作靶蛋白鉴定
本研究采用亲和层析技术,筛选籽粒中与 G14b及GF14e互作的靶蛋白,并利用SDS-PAGE对亲和层析获得的蛋白样品进行检测(图2),共进行了12次独立的生物学重复。之后,采用 LC-MS/MS对SDS-PAGE胶上的蛋白条带进行鉴定。去除阴性及空白对照,选择至少在3次生物学重复试验中鉴定到的蛋白作为最终结果。依据此标准,本研究共鉴定到59个与GF14b结合的靶蛋白和72个与GF14e结合的靶蛋白,扣除2个家族成员间重复的结果,累计在籽粒中鉴定到88个与14-3-3蛋白结合的靶蛋白(表3)。
为了验证亲和层析的结果,随机选取2个靶蛋白(SUS3和PS)采用体外GST pull-down的方法,分别验证上述2个靶蛋白与GF14b及GF14e间的蛋白互作关系。构建His-SUS3及His-PSA融合表达蛋白,诱导表达纯化后,分别与纯化后的 GST-GF14b及GST-GF14e融合表达蛋白孵育,洗脱后,采用His抗体检测。结果表明,SUS3与GF14b和GF14e有很高的亲和力,PSA仅与GF14e有相互作用条带,证实了亲和层析结果鉴定的准确性(图3)。
细胞定位分析表明,鉴定到的88个靶蛋白主要定位于细胞核(5.7%)、细胞质(50%)、叶绿体(29.5%)、线粒体(13.6%)和内质网(1.1%)(表3)。此外,通过磷酸化位点预测,发现在GF14b的59个互作靶蛋白中,96.7%具有Ser或Thr磷酸化位点;GF14e的72个互作靶蛋白中,97.2%具有Ser或Thr磷酸化位点(表3)。

表3 水稻籽粒中与14-3-3家族成员GF14b和GF14e互作的靶蛋白Table 3 14-3-3 species GF14b and GF14e client proteins in developing rice grains
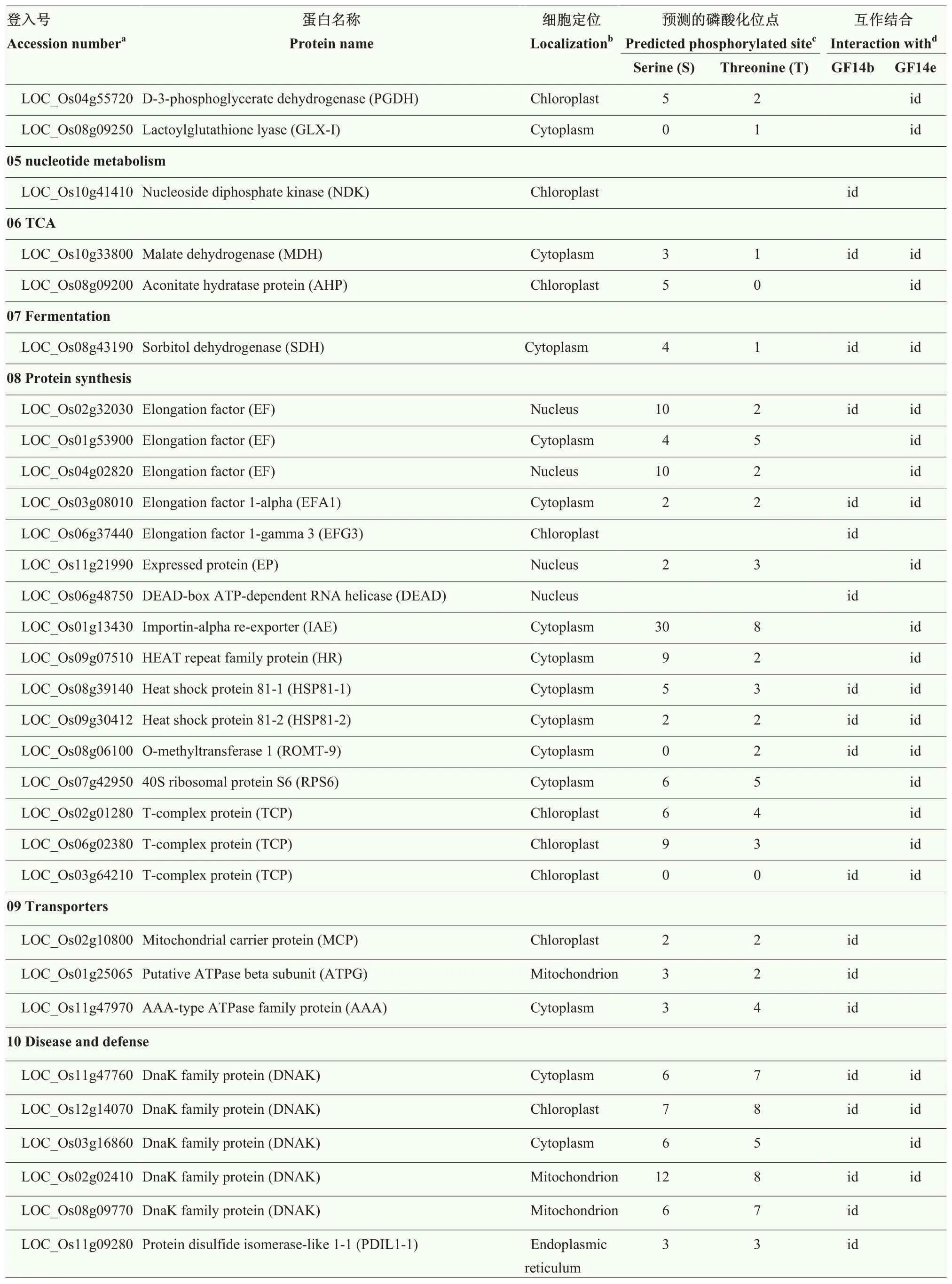
续表3 Continued table 3

续表3 Continued table 3
2.4 GF14b和GF14e互作靶蛋白功能分析
通过对鉴定到的88个靶蛋白的功能分析,发现有11.36%参与糖转化和淀粉合成,6.82%参与光合作用,14.77%参与糖酵解,6.82%参与氨基酸代谢,18.18%参与蛋白质合成,6.82%参与疾病和防御,6.82%参与信号转导,15.91%参与细胞生长和分裂。少部分靶蛋白与核苷酸代谢(1.14%)、TCA(2.27%)、发酵(1.14%)、转运蛋白(3.41%)和C1代谢(2.27%)有关,2.27%功能未知(图4)。此外,本研究还发现14-3-3蛋白不同家族成员间也存在着互作关系,例如GF14b 与 GF14a,GF14c,GF14d,GF14e,GF14f互作,而GF14e与GF14b,GF14c和GF14d存在互作。
2.5 GF14b与GF14e互作靶蛋白差异分析
本研究发现GF14b及GF14e共同互作的靶蛋白有43个,而与 GF14b特异结合的靶蛋白有 16个,与GF14e特异结合的有29个(图5)。GF14b特异性互作蛋白主要分布于 7个功能类别,包括光合作用(2个)、核苷酸代谢(1个)、蛋白质合成(2个)、转运蛋白(3个)、疾病与防御(2个)、细胞生长与分裂(4个)和未知分类(2个),而GF14e特异性互作蛋白涉及9个功能类别,包括光合作用(2个)、糖酵解(2个)、氨基酸代谢(3个)、TCA(1个)、蛋白质合成(8个)、疾病与防御(1个)、信号转导(1个)、细胞生长与分裂(9个)和C1代谢(2个)。
2.6 GF14b和GF14e及其互作靶基因对外源激素的响应
为了明确14-3-3蛋白在籽粒发育过程中对激素的响应机制,运用qRT-PCR,在转录水平分析了GF14b、GF14e及其互作的靶基因对外源激素ABA、IAA、GA、ZT和BR的响应。结果表明,不同外源激素处理下GF14b和GF14e基因均呈上调表达的变化趋势,而蔗糖合成酶基因(SUS2),ADP-葡萄糖焦磷酸化酶基因(AGPS、AGPL),丙酮酸磷酸二激酶基因(PPDK2),淀粉分支酶基因(SBE)这 5个与淀粉合成密切相关的靶基因大部分呈现下调表达的趋势,仅AGPL在外源IAA的处理下呈上调表达趋势(图6)。
3 讨论
14-3-3蛋白是作物籽粒发育过程中的一个重要的信号调节因子,例如在玉米籽粒中鉴定到的zmgf14-4和zmgf14-6[9],在拟南芥种子中鉴定到的14-3-3χ和14-3-3ε[8],在大麦籽粒中鉴定到的14-3-3a[27],均在籽粒发育过程中发挥着重要的作用。本研究发现水稻14-3-3基因的8个家族成员中GF14b、GF14c、GF14e、GF14f和GF14g随着籽粒灌浆的进行均有着不同程度的上调表达趋势,暗示着上述5个14-3-3基因家族成员参与到水稻籽粒灌浆充实的生理过程中。进一步选取在籽粒灌浆期表达变化幅度较大的GF14b和GF14e,通过互作靶蛋白的鉴定,解析14-3-3蛋白在籽粒灌浆过程中的蛋白调控网络。蛋白功能 motif分析表明,GF14b和GF14e具有3个相同类型功能motif,暗示着2个不同成员间具有相同的蛋白功能,亲和层析的结果证实GF14b及GF14e间共有43个相同的互作靶蛋白。蛋白功能分析发现,在蔗糖转化、淀粉合成、糖酵解代谢及TCA循环途径中,GF14b及GF14e互作的靶蛋白大多数是一致的,例如蔗糖转化及淀粉合成的限速酶AGPase和SuS,糖酵解过程的关键酶甘油醛-3-磷酸脱氢酶(GAPDH)、果糖激酶(FRK)、磷酸甘油酸激酶(PGK)和 UDP-葡萄糖焦磷酸化酶(UGPase)以及TCA循环的苹果酸脱氢酶(MDH)。在拟南芥[8]、大麦[27]、小麦[10]及玉米[9]籽粒(种子)中也鉴定到大量与14-3-3蛋白互作的碳代谢相关靶蛋白。据此,笔者认为水稻籽粒灌浆过程中,14-3-3蛋白家族通过与碳代谢相关靶蛋白互作,进而参与了水稻籽粒灌浆过程中碳代谢的调控。
水稻14-3-3蛋白不同家族成员具有各自特异的调控功能,例如,GF14b与抗旱性相关[28],GF14c被认为是开花的负调控因子[29],GF14e负调控细胞死亡及抗病响应[30]。本研究在籽粒中分别鉴定到 16个与GF14b及29个与GF14e特异结合的靶蛋白,这或许是由于2个成员间所具备的不同功能motif所导致的。例如,GF14b蛋白能够特异与核酸代谢相关的Nucleoside diphosphate kinase以及转运相关的mitochondrial carrier protein结合,而GF14e能够与C1代谢中的 Formate dehydrogenase 1和 Formate--tetrahydrofolate ligase相互作用。此外,GF14b和GF14e在籽粒灌浆过程中的同一生理代谢过程也具有特异的调控机制,例如,在蛋白合成中,GF14e特异与40S ribosomal protein S6及Importin-alpha re-exporter结合,而 GF14b特异与 DEAD-box ATP-dependent RNA helicase结合;在细胞生长分裂中,GF14b特异与ADP-ribosylation factor1结合,而 GF14e特异与Puromycin-sensitive aminopeptidase 结合。14-3-3蛋白在玉米的籽粒发育过程中也有类似的结果,玉米14-3-3蛋白ZmGF14-4在胚乳发育过程中能特异地与抗病及抗逆相关蛋白结合,而ZmGF14-6主要与代谢及细胞结构相关蛋白互作[9]。上述结果表明GF14b和GF14e通过调节各自独有的互作靶蛋白,进而在水稻籽粒灌浆过程中发挥着特异的调控功能。此外,本研究还发现GF14b及GF14e不仅能够与对方相互作用,其自身也会自我结合,说明14-3-3蛋白家族的这2个成员间存在着蛋白二聚化(dimerization)。已有的研究也发现14-3-3蛋白能通过形成同质或异质二聚体[31],从而使其能够同时与2个靶蛋白或者1个靶蛋白的2个不同的结构域结合[32]。虽然,14-3-3蛋白主要是通过与靶蛋白互作进而发挥其调控作用的,但GF14b及GF14e的这种自我结合及不同成员间相互结合的方式(inter- and/or intra-species bindings),或许会增强其在水稻籽粒灌浆过程中的调控效果。
已有研究表明,14-3-3蛋白通过参与激素的信号转导,从而在植物发育及逆境胁迫响应的过程中起到了重要的作用[3,33]。本研究发现,籽粒14-3-3基因家族的2个成员GF14b及GF14e均会响应激素ABA、IAA、GA、ZT、BR的处理而出现不同程度的上调表达趋势,说明在籽粒灌浆过程中,14-3-3家族基因在激素信号调控网络中也发挥着重要的作用。ZHU等[34]研究发现在籽粒灌浆期外源喷施 ABA及乙烯能够降低SUS、AGPase和StS基因的表达及相应的酶活性。可见,植物激素会通过调控籽粒灌浆过程中淀粉合成相关酶的基因表达及活性,从而调控籽粒的灌浆充实。本研究从GF14b及GF14e共同互作靶基因中,选取了SUS2,AGPS,AGPL,PPDK2,SBE这5个与淀粉合成密切相关的基因,发现上述5个靶基因在激素的处理下大部分呈下调表达的趋势,这与GF14b及GF14e的表达变化趋势相反,暗示着14-3-3基因与淀粉合成相关基因的表达呈负相关的调控关系。在大麦籽粒中的研究发现,SuS酶的活性受外源14-3-3蛋白的抑制[27]。在拟南芥中的研究也表明,抑制14-3-3蛋白的表达会导致淀粉的积累增加[35]。笔者前期通过RNAi干扰技术也发现特异减少 14-3-3家族成员的GF14f在籽粒中的表达,有利于提高籽粒灌浆过程中淀粉合成相关酶的活性[19]。据此,笔者认为14-3-3蛋白家族在籽粒灌浆过程中会响应激素浓度的改变,进而对淀粉的合成起到负调控作用。
14-3-3蛋白主要是通过磷酸化作用与其互作靶蛋白结合,进而调控靶蛋白的功能,其对互作靶蛋白的结构要求是含有磷酸化的Ser或Thr序列[2],而本研究所鉴定到籽粒靶蛋白,大部分也是具有潜在的Ser或Thr磷酸化结合位点。蛋白的磷酸化修饰是调节植物碳代谢中的许多关键酶活性的一个重要的机制,其具体的调控过程是酶自身发生蛋白磷酸化修饰,之后与14-3-3蛋白结合形成复合体,从而改变其自身的酶活性[35-36]。例如,拟南芥叶片中的StSase III家族具有保守的磷酸化位点(RYGSIP),使其能够与 14-3-3蛋白结合[37]。拟南芥GAPDH磷酸化后与14-3-3蛋白结合后,其酶活性受到抑制[38]。14-3-3蛋白也主要通过磷酸化作用参与激素的信号转导。例如,14-3-3蛋白能够与Ca2+-依赖的CDPK激酶磷酸化转录因子RSG(repression of shoot growth)的Ser114磷酸化位点结合,使得RSG滞留在细胞质中而不能进入细胞核调控编码GA生物合成相关蛋白的基因,从而控制植株体内GA含量[39-40]。此外,本研究也发现水稻14-3-3蛋白自身也具有潜在的Ser或Thr磷酸化结合位点。前人的研究也证实14-3-3蛋白除了会与磷酸化靶蛋白结合进而调控其活性外,其自身磷酸化作用在信号调节的过程中也起到了极为重要的作用,且不同的家族成员间的磷酸化位点具有特异性[41-42]。由此可见,14-3-3蛋白或许会通过自身磷酸化及与磷酸化后的靶蛋白结合,进而在籽粒的碳代谢及激素信号转导的过程中发挥着重要的作用,但其具体的调控机制及磷酸化位点还需进一步研究。
4 结论
14-3-3家族成员中的GF14b和GF14e基因在水稻籽粒灌浆过程中表达变化幅度较大,且会响应外源激素处理而出现表达变化。GF14b蛋白和GF14e蛋白具有相同及各自特异的互作靶蛋白,通过磷酸化的作用方式与其靶蛋白结合,参与籽粒灌浆过程中的碳代谢及激素的信号转导,并作为负调控因子参与淀粉的合成过程。
