茶树中葡萄糖-6-磷酸脱氢酶基因(CsG6PDHs)的克隆与表达分析
2021-08-12王彦丁王缓李娜娜王璐郝心愿王玉春丁长庆杨亚军王新超钱文俊
王彦丁,王缓,李娜娜,王璐,郝心愿,王玉春,丁长庆,杨亚军,王新超*,钱文俊*
茶树中葡萄糖-6-磷酸脱氢酶基因()的克隆与表达分析
王彦丁1,王缓1,李娜娜2,王璐2,郝心愿2,王玉春3,丁长庆2,杨亚军2,王新超2*,钱文俊1*
1. 青岛农业大学,山东 青岛 266109;2. 中国农业科学院茶叶研究所/国家茶树改良中心/农业部茶树生物学与资源利用重点实验室,浙江 杭州 310008;3. 浙江农林大学,浙江 杭州 311300
葡萄糖-6-磷酸脱氢酶(Glucose-6-phosphate dehydrogenase,G6PDH,EC1.1.1.49)是戊糖磷酸途径中的关键限速酶,在植物逆境胁迫响应和生长发育中具有重要作用。然而,目前有关在茶树中的研究尚处空白。在茶树中克隆到3个基因,分别命名为(MW025829)、(MW025830)、(MW025831)。聚合进化树结果显示,CsG6PDH1和CsG6PDH4均为质体型蛋白,而CsG6PDH2为胞质型蛋白。表达分析发现,在不同组织中均有表达;低温或炭疽菌侵染条件下,和均被抑制表达;冷驯化期间,和在不同品种中均上调表达;此外,在茶芽休眠和萌发过程中均不同程度上调表达。以上结果表明,在茶树生长发育和逆境胁迫响应过程中发挥着重要作用,这为后续深入研究在茶树中的功能奠定了理论基础。
葡萄糖-6-磷酸脱氢酶;茶树;表达分析;低温;冷驯化
戊糖磷酸途径(Pentose phosphate pathway,PPP)是植物体内葡萄糖氧化分解代谢的一种重要方式,该途径能产生供细胞生物合成所需的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)和供脂肪酸、氨基酸合成所需的中间产物,以及核酸代谢所需的磷酸戊糖[1-3]。而NADPH是细胞生物合成的必需物质,也是抗氧化系统中过氧化氢酶和谷胱甘肽还原酶等抗氧化酶的关键辅助因子[4]。在PPP途径中,NADPH由葡萄糖-6-磷酸脱氢酶(Glucose-6-phosphate dehydrogenase,G6PDH)催化生成。G6PDH作为该催化反应中的关键限速酶,控制着PPP途径的反应速率,在植物生长发育和逆境胁迫响应过程中发挥重要作用。
近年来,随着生物技术手段的不断发展和完善,植物中基因的鉴定和功能研究已越来越多。目前,已相继在马铃薯[5]、菠菜[6]、玉米[7]、大豆[8]、拟南芥[9]、水稻[10]和小麦[11]等植物中分离鉴定出多个基因。已有研究表明,植物中的G6PDH主要分为质体型和胞质型两类,二者的区别在于胞质型G6PDH的氨基酸序列比质体型G6PDH氨基酸序列缺少一段约60个氨基酸的转运肽,该转运肽序列具有多态性和组织特异性[12]。此外,大量研究发现,G6PDH广泛参与了植物生长发育和逆境胁迫响应过程。病原侵染[13]、盐[14]、干旱[15]、涝害[16]、低温[17]等生物或非生物胁迫均可诱导不同植物中G6PDH蛋白活性或基因表达水平的显著变化。Wang等[18]对芦苇愈伤组织进行H2O2和盐胁迫处理后发现:芦苇愈伤组织中的G6PDH活性被诱导升高;相反,在盐胁迫条件下通过添加质膜NADPH氧化酶抑制剂则能抑制NaCl诱导的H2O2积累,从而降低芦苇愈伤组织中的G6PDH活性。低温处理下杨树中的胞质型G6PDH的活性会被诱导升高,同时抗氧化系统中的超氧化物歧化酶(SOD)、过氧化物酶(POD)活性也同样升高,推测低温条件下,G6PDH可能参与了杨树抗氧化防御响应系统[17]。另外,植物在遭受病菌侵染后,G6PDH活性被诱导增加,同时还伴随着过敏性细胞死亡和活性氧产生[19]。由此可见,基因在植物抵抗逆境胁迫中发挥着重要作用,可能的作用机制是调控G6PDH催化产生NADPH,而后者参与植物的抗氧化系统,能清除多余的活性氧(ROS),进而保护植物免受氧化胁迫伤害。
茶树作为喜温、喜湿常绿叶用植物,其生长对环境要求较高,病菌侵染、不适宜的土壤、光照、水分、温度等环境胁迫限制茶树的自然分布,并造成茶叶产量和品质下降。基于此,通过开展茶树抗逆响应的分子机制研究,能为茶树抗性分子育种奠定坚实的理论基础。G6PDH作为植物PPP途径中的关键调控酶,其在茶树中肯定发挥着重要作用,且课题组前期在对参与茶树抗性响应的蔗糖水解酶(Invertase,INV)功能进行研究时发现,INV和G6PDH之间存在密切联系[20-21]。然而,目前关于G6PDH在茶树生长发育和抗逆响应的研究尚未见报道。为此,本研究结合生物信息学技术手段和现有的茶树转录组、基因组数据,开展了茶树中基因的鉴定和克隆工作,同时,检测了基因在茶树不同组织和不同胁迫处理下的表达,以期筛选出与茶树生长发育和抗逆作用相关的基因,为茶树抗逆作用机制研究提供理论依据。
1 材料与方法
1.1 材料与试剂
2年生盆栽龙井43用于分析的组织表达特异性和对低温胁迫的响应模式;3年生盆栽龙井43进行炭疽菌侵染后,分析对生物胁迫的响应模式;另外,4个15年生的不同抗寒茶树品种(浙农113、龙井43、浙农12和大面白)用于分析在茶树冷驯化期间的响应模式;最后,取15年生龙井43的休眠芽用于分析茶芽中的低温响应模式。上述所有试验材料均种植于中国农业科学院茶叶研究所实验基地内。试验试剂主要有RNA提取试剂CTAB、EDTA、LiCl、-巯基乙醇、无水乙醇等均为国产分析醇;SYBR Premix Ex Taq(Perfect Real-time)试剂盒、Prime Script RT Reagent Kit、大肠杆菌感受态细胞和rTaq酶等购自TaKaRa公司(北京);DNA凝胶回收试剂盒(Invitrogen Carlsbad,USA)购自Axygen公司(Silicon valley,USA)。
1.2 试验处理
选取15年树龄的4个不同抗寒茶树品种(浙农113、龙井43、浙农12和大面白)进行冷驯化分析。取样方法如下:取样时间为2016年10月到2017年3月,每半月取一次样,每次取样时间为当天上午9:30—10:30;取样时,每个品种随机选取10余株长势基本一致的茶树,取顶芽下第三至第五片健康成熟叶混合作为1个生物学重复,液氮速冻后于–80℃保存备用,共3次生物学重复。为检测在茶芽休眠过程中的表达情况,以田间栽培15年树龄的龙井43为试材,于2015年秋末到2016年早春每半个月取1次样,每次取样时间也为当天上午9:30—10:30;取样时,随机选取20余株长势基本一致的茶树,采集顶芽和腋芽作1个生物学重复,液氮速冻后于–80℃保存备用,共3次生物学重复。参照Yue等[22]的方法分析在茶树不同组织中的表达,具体如下:在茶树开花季(10月),以生长于露天茶园的大小和长势基本一致的盆栽2年树龄的龙井43为试材,分别取茶树的顶芽、幼叶、成熟叶、根、茎、果实和花等于液氮速冻后–80℃保存备用,共3次生物学重复。参照Qian等[21]的方法对茶树进行低温处理,具体如下:以自然环境下2年树龄的盆栽龙井43扦插苗为试材,待茶苗春季长出一芽三叶后移至人工温室缓苗7 d,然后温室温度降至4℃低温处理8 d,之后将温室温度再升至25℃恢复生长2 d,分别取低温处理后0~8 d的样品,分析在低温处理下的表达,1个生物学重复包含3盆茶苗,每盆包含3株,取样后液氮速冻后于–80℃保存备用,共3次生物学重复。参照Wang等[23]所述方法进行炭疽菌侵染试验,具体如下:以3年树龄的龙井43茶树为试材,茶树在温室生长1个月后利用喷壶将炭疽菌喷洒在茶树叶片表面,分别在接种后0、12、48 h和96 h取顶芽下第三至第五片健康成熟叶混合作为1个生物学重复,取样后液氮速冻后于–80℃保存备用,共3次生物学重复。常温下,温室中茶树的培养条件为:14 h光照/10 h黑暗,相对湿度为75%,温度为(25±0.5)℃。
1.3 茶树中CsG6PDHs的鉴定和克隆
共采用3种方法查找和鉴定茶树中的基因。首先,以“Glucose-6-phosphate dehydrogenase”或“G6PDH”为关键词,在茶树基因组数据库(TPIA,http://tpia.teaplant.org/index.htmL)检索。然后,用“Glucose-6-phosphatedehydrogenase”或“G6PDH”作关键词,在已公布的转录组数据库中搜索。最后,在Phytozome v12.1数据库(JGI,https://phytozome.jgi.doe.gov/pz/portal.htmL)检索拟南芥、水稻、香蕉、葡萄和烟草中的G6PDH核酸序列和蛋白质序列,将所得核酸序列和蛋白质序列在TPIA数据库进行Blastn和Blastx分析,并用NCBI(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)比对分析,最终确定G6PDH的同源序列。以龙井43为材料,采用RT-PCR对鉴定获得的进行RT-PCR扩增,并将扩增获得的目标条带进行连接、转化和测序,具体的试验方法,参照钱文俊等[24]的方法进行,略有修改,具体如下:利用高保真酶PrimeSTAR HS DNA polymerase(TaKaRa Da Lian,China)进行PCR,50 μL反应体系中包含5×PrimeSTAR Buffer(Mg2+plus)10.0 μL,dNTP Mixture(各2.5 mmol·L-1)4.0 μL,cDNA 2.0 μL,上下游引物各1.0 μL,HS DNA polymerase 0.5 μL,最后用ddH2O补足至50 μL;然后在BIO-RAD型PCR仪上进行98℃预变性2 min;98℃变性10 s,55℃退火30 s,72℃延伸2 min,30个循环,最后12℃保存。PCR反应后,进行1%琼脂糖凝胶电泳,并将目的片段切胶回收,取2 μL回收产物与平末端载体(TransGen Biotech,北京)连接并转化至(TaKaRa,北京)感受态中进行阳性筛选,最后,挑选阳性单克隆进行PCR验证和测序。引物合成和基因测序由上海华津生物有限公司完成。RT-PCR用引物如表1所示。
1.4 茶树中CsG6PDHs的生物信息学分析
使用NCBI ORFfinder网站(https://www.ncbi.nlm.nih.gov/orffinder)查找开放阅读框(ORF)和编码的氨基酸。使用ProtParam工具(https://web.expasy.org/protparam)预测蛋白质分子量和理论等电点。使用SignalP 3.0 Server(http://www.cbs.dtu.dk/services/SignalP-3.0)和TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM)预测信号肽和跨膜结构。Plant-mPLoc(http://www.Csbio.sjtu.edu.cn/bioinf/plant-multi)、WoLF PSORT(https://wolfpsort.hgc.jp)、TargetP 1.1server(http://www.cbs.dtu.dk/services/TargetP-1.1/index.php)3个网站预测CsG6PDHs的亚细胞定位。
1.5 系统进化树构建
将茶树、橡胶树、毛果杨、蓖麻、拟南芥、玉米、水稻和小麦中已鉴定的G6PDH蛋白进行聚合进化树分析。首先,使用ClustX 2.1软件将这些G6PDHs进行聚类,然后利用MEGA 5.0软件中的邻接法进行1 000次引导序列重复以构建进化树。
1.6 CsG6PDHs保守结构域分析
用Clustlx 2.0软件对茶树中的CsG6PDHs氨基酸进行保守结构域比对,比对结果用Genedoc软件导出。
1.7 基因结构和顺式元件分析
通过GSDS 2.0网站(http://gsds.gao-lab.org)可视化基因的外显子-内含子结构。使用PlantCARE软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)预测每个基因2 000 bp上游启动子序列中与胁迫反应有关的顺式元件。
1.8 总RNA提取及cDNA的合成
参照钱文俊等[24]的方法提取样品中的总RNA。RT-PCR扩增用cDNA和表达分析用cDNA的合成分别参照SuperScript Ⅲ试剂盒和Prime Script RT Reagent试剂盒说明书进行。
1.9 qRT-PCR分析
2 结果与分析
2.1 理化性质分析
基于1.3章节中的鉴定方法和测序结果,共克隆获得3个,分别命名为:、和;GenBank登录号分别为:MW025829、MW025830和MW025831。生物信息学分析发现,这3个基因的ORF长度为1 782~2 127 bp,编码593~708个氨基酸,蛋白质分子量为59.16~79.13 kDa,理论等电点为6.17~8.51,预测均为不稳定蛋白(表2)。将这3个基因编码的氨基酸与已完成测序的舒茶早品种茶树基因组中对应的同源基因氨基酸序列进行比对发现,CsG6PDH1与同源蛋白XP_028115810.1的氨基酸序列仅有1个氨基酸不同,一致性达99%;CsG6PDH2与同源蛋白XP_028056677.1的氨基酸序列完全相同,一致性为100%;CsG6PDH4与同源蛋白XP_028064051.1的氨基酸序列也仅有1个氨基酸不同,一致性为99%。由此可见,这3个基因在不同茶树品种中的氨基酸序列都具有高度保守性。
2.2 信号肽和跨膜结构预测
SignalP 3.0 Server预测发现CsG6PDH1/2/4均不含信号肽,且TMHMM Server v.2.0预测发现CsG6PDH1/2/4均不包含跨膜结构域,不属于跨膜蛋白。

表1 RT-PCR和qRT-PCR用引物表
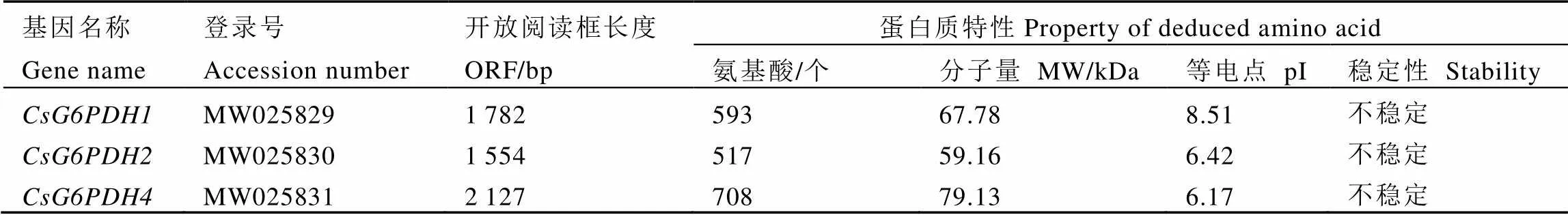
表2 CsG6PDHs理化性质分析
2.3 亚细胞定位
TargetP1.1预测显示CsG6PDH1蛋白可能定位于线粒体,而CsG6PDH2蛋白预测可能定位于细胞质中,CsG6PDH4蛋白可能定位在叶绿体上。
2.4 茶树CsG6PDHs进化树构建
聚合进化树构建结果显示,CsG6PDH1与AtG6PDH1亲缘关系最近,CsG6PDH4与PtG6PDH亲缘关系最近,而CsG6PDH2与HbG6PDH3亲缘关系最近。另外,我们发现,CsG6PDH1和CsG6PDH4属于质体型蛋白,其分别被聚类到B类质体型和C类质体型中,而CsG6PDH2属于胞质型蛋白(图1)。该结果与亚细胞定位结果基本一致。
2.5 CsG6PDHs保守结构域分析
保守结构域分析发现3个CsG6PDHs蛋白序列具有较高的相似性,均包含保守的罗斯曼折叠结构(Rossman fold,GXXGXXG/A),还分别包含1个潜在的底物结合位点(IDHYLG)和潜在的NADP结合位点(NEFVIRLQP)(图2)。
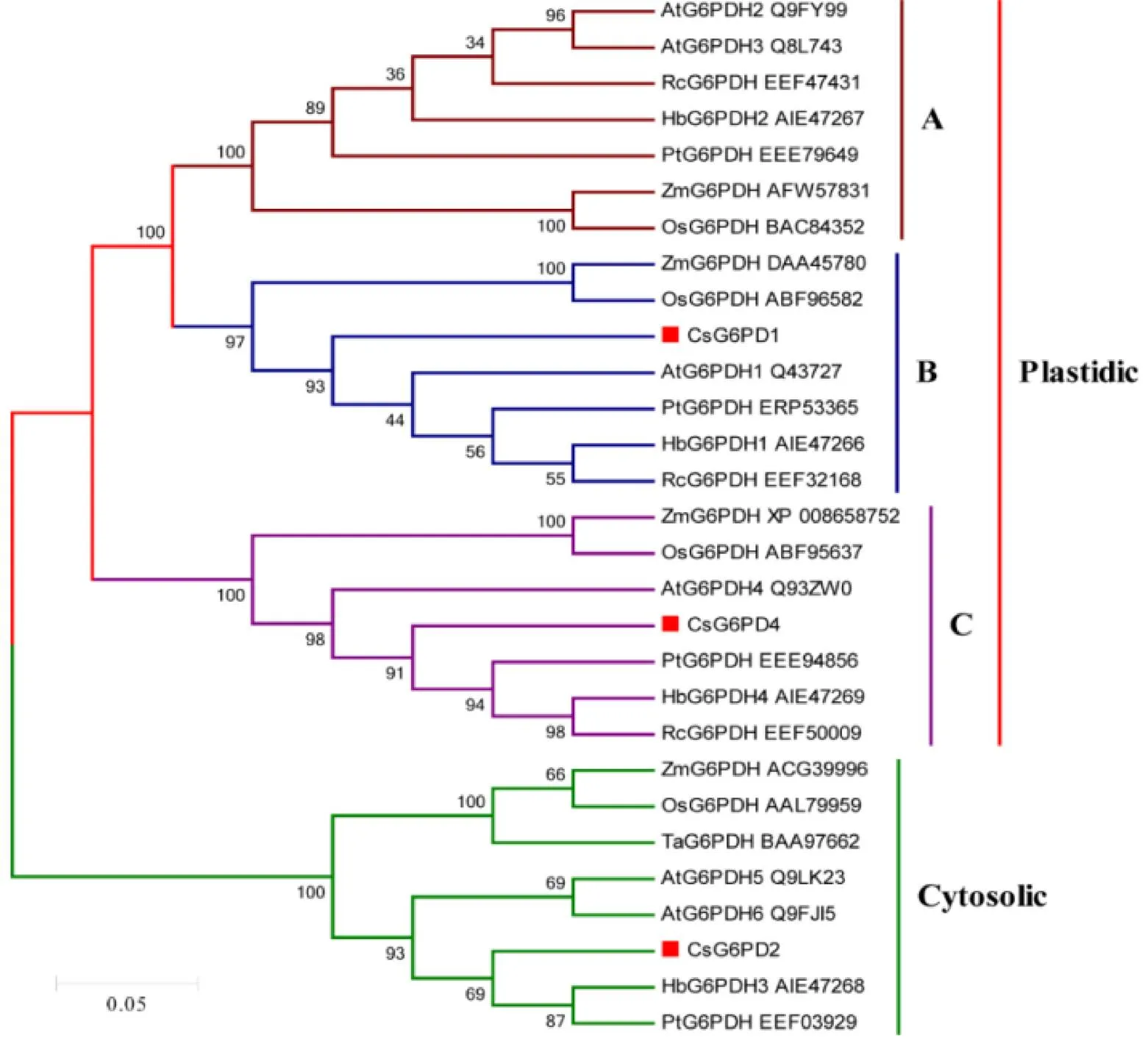
注:构建系统进化树的G6PDH蛋白质序列分别为:茶树CsG6PDH1~2(XP_028115810.1、XP_028056677.1)和CsG6PDH4(XP_028064051.1);拟南芥AtG6PDH1~6(Q43727、Q9FY99、Q8L743、Q93ZW0、Q9LK23、Q9FJI5);橡胶树HbG6PDH1~4(AIE47266、AIE47267、AIE47268、AIE47269);水稻OsG6PDH(BAC84352、ABF96582、ABF95637、AAL79959);毛果杨PtG6PDH(EEE79649、ERP53365、EEE94856、EEF03929);小麦TaG6PDH(BAA97662);蓖麻RcG6PDH(EEF47431、EEF32168、EEF50009));玉米ZmG6PDH(AFW57831、DAA45780、XP_008658752、ACG39996)
2.6 CsG6PDHs基因结构和顺式作用元件分析
在线软件GSDS 2.0分析发现基因有10个外显子、9个内含子;基因含15个外显子、14个内含子;基因包含12个外显子、11个内含子(图3)。
如图4所示,对起始密码子上游2 000 bp启动子序列进行分析发现,中包含5个与环境胁迫响应相关的顺式作用元件(3个ARE、1个MBS和1个TC-rich repeats),中有3个与环境胁迫响应相关的顺式作用元件(2个WUN-motif、

注:红色矩形框中的氨基酸残基为保守的罗斯曼折叠(Rossman fold,GXXGXXG/A),绿色框为潜在的底物结合位点(IDHYLG),黄色框为潜在的NADP结合位点(NEFVIRLQP)
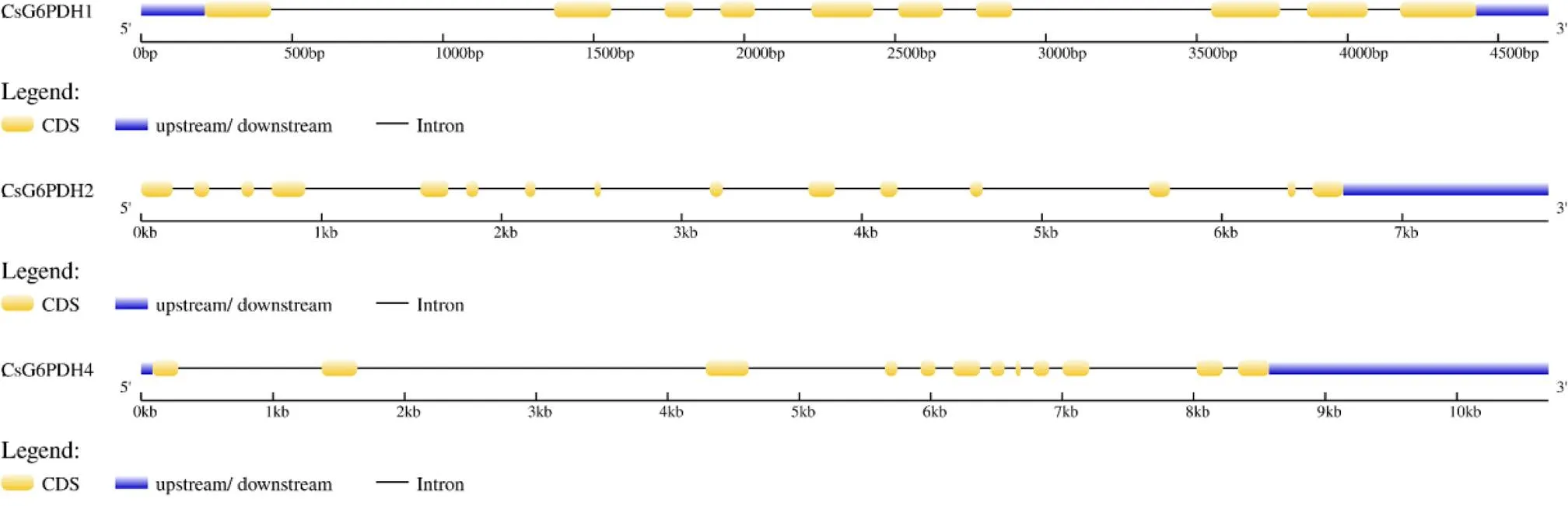
图3 CsG6PDHs基因结构
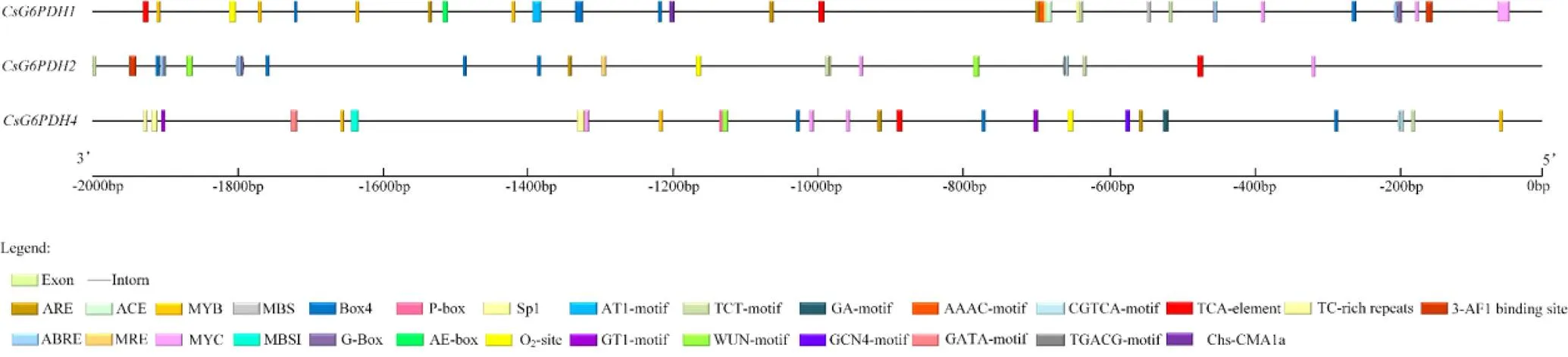
图4 CsG6PDHs启动子分析
2.7 茶树中CsG6PDHs的组织特异性分析
为了解在茶树不同组织的表达情况,分别检测了在茶树顶芽、幼叶、成熟叶、根、茎、果和花中的表达情况。结果如图5所示,基因在所检测的不同组织中均有表达。其中,在成熟果实中的表达最低,在第二、三叶和幼果具有较高的表达;在嫩茎中表达量最高,在第一叶中表达量最低,在第二、三叶中也有较低表达量;在成熟果中表达量最低,在嫩茎中表达量最高(图5)。
2.8 茶树CsG6PDHs基因的表达分析
低温处理下,和表达受抑制,二者在低温处理8 d后表达量最低,其中,受低温抑制最为明显。然而,基因的表达基本不受低温处理影响。此外,随着温度恢复到正常温度后,所有的的表达又恢复到了正常水平(图6)。
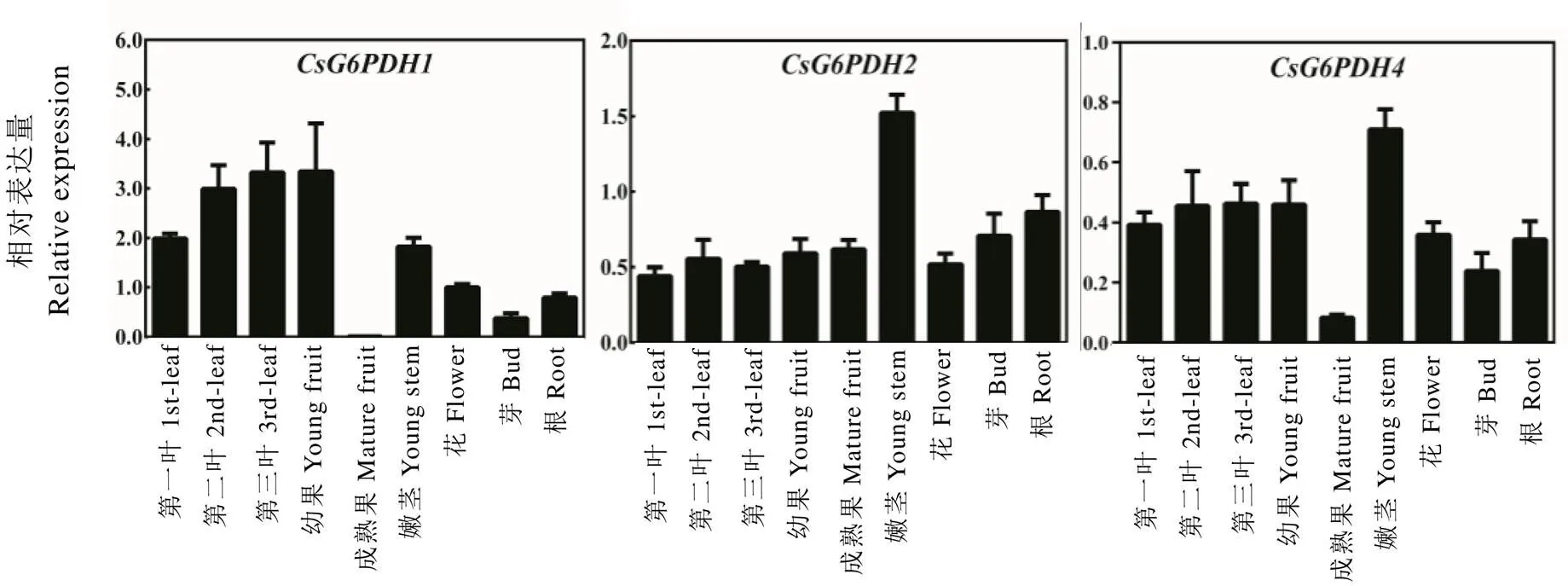
图5 CsG6PDHs组织表达特异性
2.9 茶树CsG6PDHs在冷驯化条件下的表达分析
在冷驯化过程中,在4种不同茶树品种中的表达趋势基本一致,从10月14日气温降低开始,表达逐渐降低,在12月16日—翌年1月3日,其表达量又逐渐升高。
基因冷驯化期间在抗寒性强的浙农113和龙井43中的表达均低于其他2个品种,其表达在4个品种中均呈升高趋势,直到脱驯化之后,其表达又逐渐降低。冷驯化期间,在浙农113、浙农12和大面白中的表达逐渐升高,直到1月3日之后表达逐渐降低。不同的是,在龙井43中的表达与其他3个品种表现出相反的趋势(图7)。
2.10 茶树CsG6PDHs在休眠芽中的表达分析
在冬季茶芽休眠过程中,随着温度降低在茶芽中的表达逐渐增加,直到翌年1月16日以后,其表达又逐渐降低。

注:Re-1/2d:茶树常温25℃恢复生长1天或2天
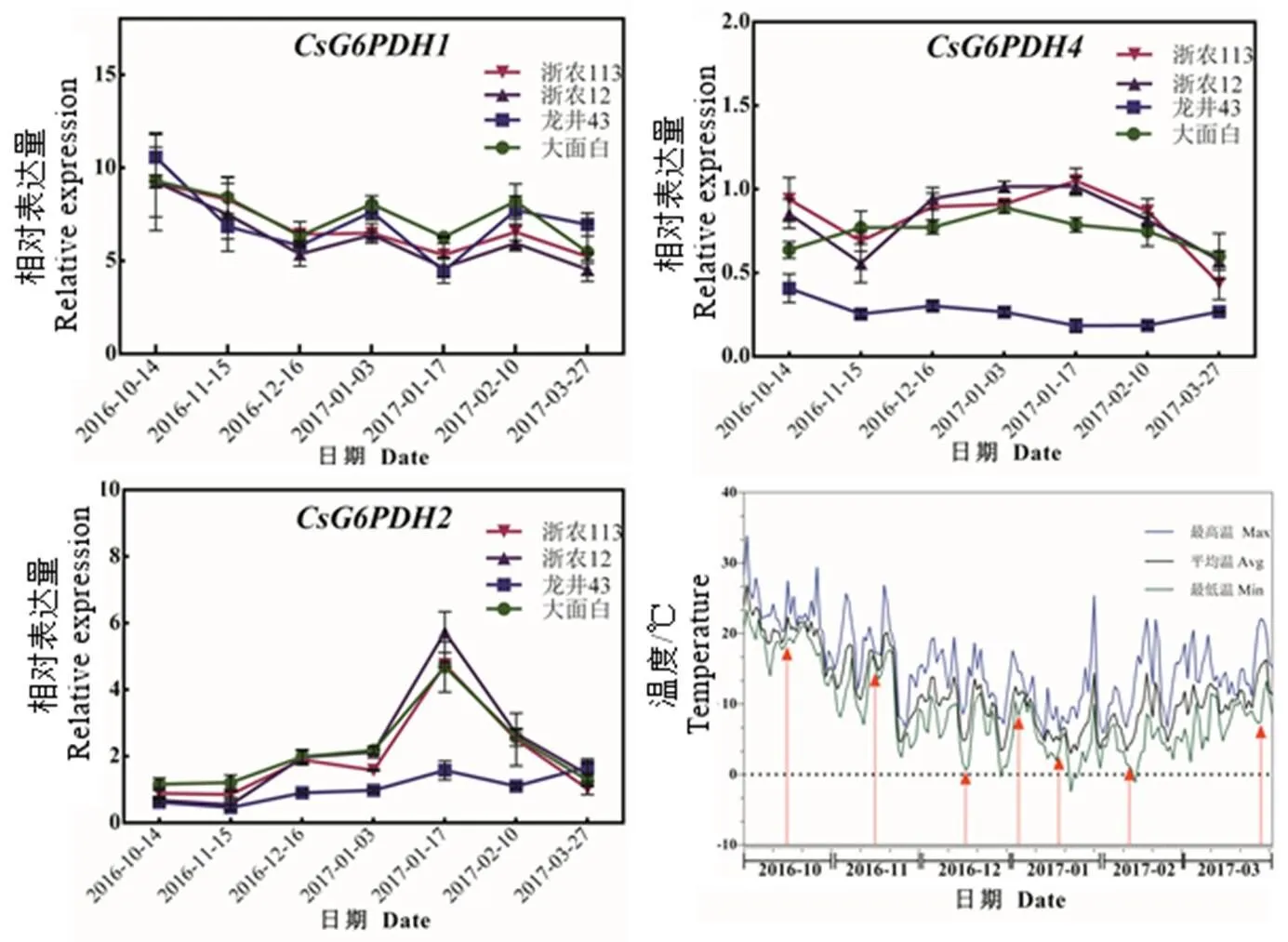
图7 CsG6PDHs基因在冷驯化下的表达分析
在冬季茶芽休眠过程中表达规律不明显,但我们发现,除了少数几个取样时间点外,其他取样点的表达均高于9月30日时的表达。在9月30—11月17日(类休眠阶段)表达逐渐升高,随后表达逐渐降低,直到3月14日以后其表达又逐渐升高。此外,所有的表达随着气温升高(3月1日后,茶芽膨大期),三者的表达呈先急剧降低又逐渐升高的趋势(图8)。
2.11 茶树在炭疽菌侵染条件下的表达分析
为探究对生物胁迫的响应情况,本研究检测了炭疽菌侵染条件下茶树的表达情况。结果发现,随着炭疽菌侵染时间的增加,的表达逐渐降低且在病菌侵染4 d后表达为最低(图9),说明茶树炭疽菌侵染会抑制的表达。
3 讨论
基因广泛存在于各类高等植物的细胞质和质体中,在植物应对各种环境胁迫和调节生长发育方面具有重要作用。目前,已在多种植物中鉴定获得多个基因。例如,拟南芥中共有6个基因[9],桉树中存在6个基因[26],而大豆中则有9个基因[8]等。本研究从茶树中共克隆获得3个基因。保守结构域分析发现,CsG6PDHs氨基酸序列中均存在保守的罗斯曼折叠(Rossman fold,GXXGXXG/A),潜在的底物结合位点(IDHYLG)和NADP结合位点(NEFVIRLQP),这一结果与拟南芥[9]和橡胶树[27]中报道的G6PDHs研究结果一致,表明它们是典型的G6PDH蛋白。另外,系统进化树分析结果显示,这3个CsG6PDHs被聚类到3个不同的亚群中,其中CsG6PDH2与已报道的胞质型异构体聚为一类,而CsG6PDH1和CsG6PDH4则分别与已报到的B类和C类质体型异构体聚为一类,且这一聚类结果和亚细胞定位预测结果相似。有研究表明,胞质型G6PDH比质体型G6PDH更稳定,氧化胁迫、磷酸化和光照等会影响质体型G6PDH的活性,而这些胁迫对胞质型G6PDH的活性影响不大[28]。基于此,我们推测茶树中质体型CsG6PDH1和CsG6PDH4蛋白活性可能受逆境胁迫影响较大。
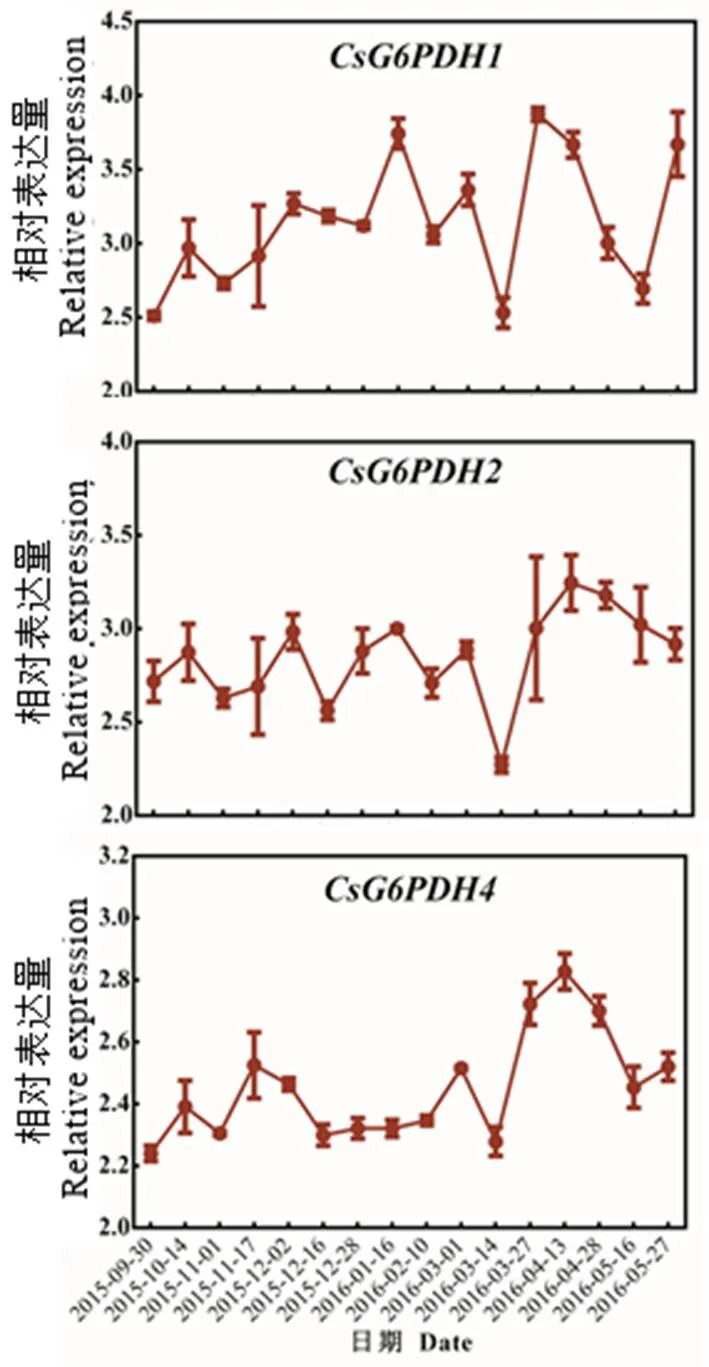
图8 茶芽休眠过程中CsG6PDHs的表达情况
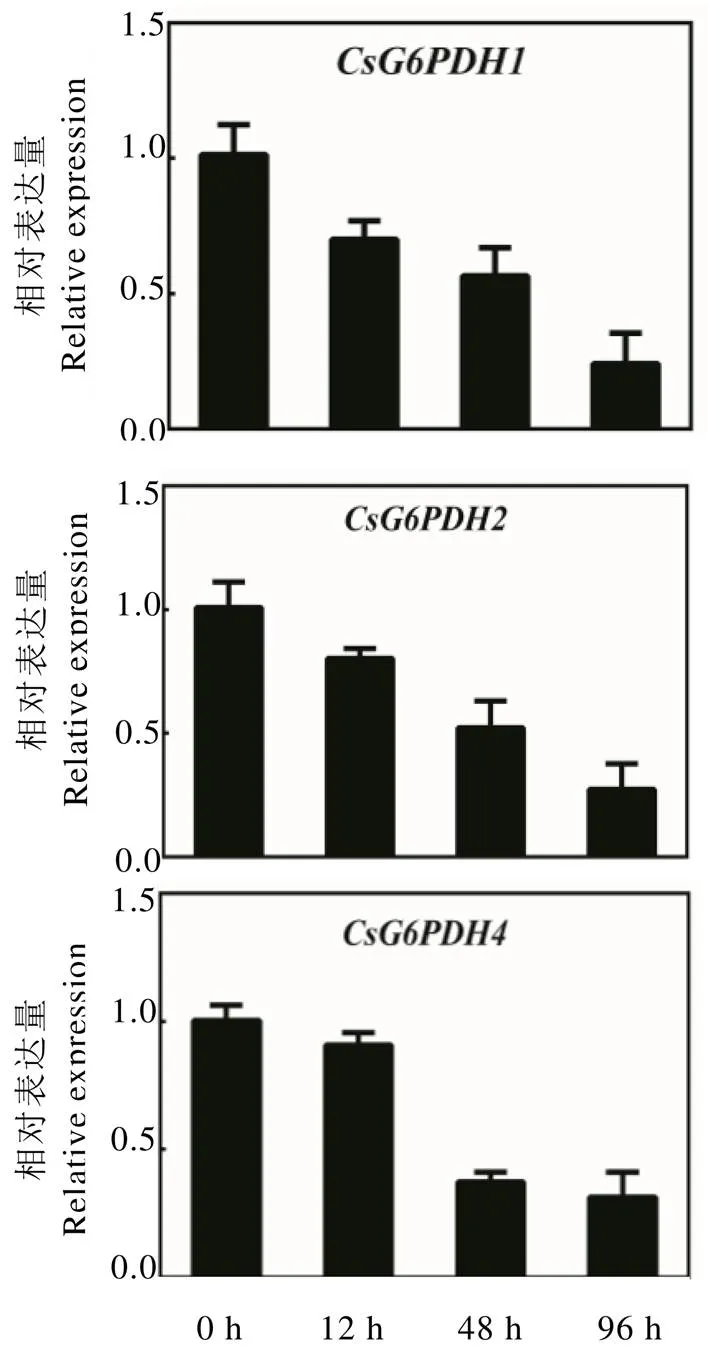
图9 炭疽菌侵染条件下CsG6PDHs的表达分析
目前研究表明,不同类型的G6PDHs异构体在植物的不同组织中发挥作用。其中,胞质型G6PDHs广泛存在于所有植物组织中,尤其是在库组织中具有较高的表达丰度,而质体型G6PDHs主要在源组织中表达丰度较高,而在库组织中表达丰度较低[29]。例如,腊梅中胞质型基因在茎和叶中表达量较少,而在花和根中的表达较高[30];苎麻中质体型基因在叶中表达量最高,在根中表达量最低[31]。相似的,本研究发现茶树中2个质体型基因在库组织(成熟果)中的表达均为最低,而在源组织(叶、茎)中的表达均较高;另外,胞质型基因在源组织(叶)中的表达为最低,而在库组织(幼茎、芽、根)中的表达较高,表明不同类型的基因在茶树源库代谢过程中各自发挥着重要作用。
植物体中G6PDH的活性受生物和非生物胁迫影响。例如,在病原菌侵染后,烟草叶片中的G6PDH活性显著增加[13];相似的,甜杨在低温胁迫下,G6PDH活性同样被诱导增加[32]。然而,本研究通过对茶树进行短时低温和炭疽菌侵染处理后发现,//均随处理时间延长表达逐渐降低,这一结果与上述研究结果相反。出现这一结果的原因可能是多方面的。现有研究表明,G6PDH参与植物逆境胁迫的核心机制主要是其通过控制PPP途径第一步不可逆氧化反应生成的NADPH产物来发挥作用[4]。然而,有研究发现NADPH的合成除了来源于PPP途径外,还可通过糖酵解途径合成[33]。此外,虽然G6PDH在提供NADPH过程中起重要作用,但胞质型G6PDH没有变构调节的性质,其会受氧化产物NADPH的抑制,所以NADPH/NADP+的比率是决定胞质中G6PDH活性的关键;另外,质体型G6PDH除了受到自身产生的NADPH的反馈抑制之外,光合作用中NADP+还原生成的NADPH也会抑制质体型G6PDH的催化过程;再者,G6PDH的活性还受到硫氧还原蛋白/铁氧还原蛋白系统的调节[34]。因此,我们认为短时逆境胁迫下,茶树中NADPH可能主要是由糖酵解途径产生,产生的NADPH可能会反馈抑制茶树PPP途径中基因的表达,从而降低了G6PDH的活性以促进茶树体内NADPH的平衡。
冷驯化期间(12月16日—翌年1月3日),茶树中胞质型基因和质体型基因被诱导上调表达,说明这两个基因在茶树冷驯化诱导抗寒中发挥着重要作用。目前研究表明,NADPH含量的提高一方面可以使以NADPH作为还原剂的抗氧化酶如SOD、POD等活性增强,从而调节植物细胞膜透性并防止细胞膜的损伤,增强细胞膜的稳定性[35];另一方面,产生的NADPH可以参与合成大量ATP,从而提高植物中ATP酶的活性,使植物保持高能状态以及时利用ATP合成与植物发育有关的RNA、蛋白质和脂类等物质[36]。因此,我们推测,低温冷驯化条件下,基因的上调表达能促进茶树中G6PDH活性升高,以催化葡萄糖-6-磷酸酯化生成更多的NADPH,NADPH含量的提高又会进一步促进茶树中抗氧化酶、ATP酶等的活性,最终提高茶树抗寒能力。
开展茶树芽的休眠机制研究对茶树抗寒品种选育和茶叶品质形成机理研究具有重要的理论意义。近几年,茶芽休眠的调节机制研究已取得了一定的进展。例如,Hao等[37]利用RNA-Seq技术全面解析了茶树芽在类休眠、内休眠、生态休眠和茶芽膨大期的表达谱。结果发现,共有16 125个基因在这几个阶段中差异表达,这些基因主要涉及到表观遗传调控、植物激素调控和胼胝质相关细胞级联调控三大通路;同时,还富集到很多、-、-、-、-、-、-、-、-、-、-、-、-、-和-相关基因。相似的,本研究检测了//在茶芽不同阶段的表达情况,结果发现,质体型基因在茶芽休眠过程中表达逐渐上调,而质体型基因在类休眠阶段(9月30日—12月2日)表达上调。这些结果表明,质体型基因和在茶芽休眠阶段参与了茶芽的休眠调控,但具体的调控机制还有待深入研究。另外,我们发现在茶芽膨大期(3月14日—4月13日),//均表现出急剧上调的表达趋势。现有研究发现,G6PDH酶活性的升高可打破种子休眠,促进种子萌发[38]。因此,我们推测,茶芽膨大期//上调表达提高了G6PDH的活性,从而有助于茶芽打破休眠,并加快新梢的萌发。
[1] Pickl A, Schönheit P. The oxidative pentose phosphate pathway in the haloarchaeoninvolves a novel type of glucose-6-phosphate dehydrogenase: the archaeal Zwischenferment [J]. FEBS Letters, 2015, 589(10): 1105-1111.
[2] Stanton R C. Glucose-6-phosphate dehydrogenase, NADPH, and cell survival [J].Iubmb Life, 2012, 64(5): 362-369.
[3] 于定群, 汤浩茹, 张勇, 等. 高等植物葡萄糖-6-磷酸脱氢酶的研究进展[J]. 生物工程学报, 2012, 28(7): 800-812.
Yu D Q, Tang H R, Zhang Y, et al. Research progress in glucose-6-phosphate dehydrogenase in higher plants [J]. Chinese Journal of Biotechnology, 2012, 28(7): 800-802.
[4] Dangthu Q, Jang S H, Lee C W. Biochemical comparison of two glucose 6-phosphate dehydrogenase isozymes from a cold-adapted[J]. Extremophiles, 2020, 24(49): 501-509.
[5] Graeve K, von Schaewen A, Scheibe R, et al. Purification, characterization, and cDNA sequence of glucose-6-phosphate dehydrogenase from potato (L.) [J]. The Plant Journal, 1994, 5(3): 353-361.
[6] Krepinsky K, Karsten M, Martin W, et al. Purification and cloning of chloroplast 6-phosphogluconate dehydrogenase from spinach[J]. European Journal of Biochemistry, 2001, 268(9): 2678-2686.
[7] Bailey-Serres J, Nguyen M T. Purification and characterization of cytosolic 6-phosphogluconate dehydrogenase isozymes from maize [J]. Plant Physiology, 1992, 100(3): 1580-1583.
[8] Zhao Y, Cui Y F, Huang S Y. Genome-wide analysis of the glucose-6-phosphate dehydrogenase family in soybean and functional identification ofinvolvement in salt stress [J]. Frontiers in Plant Science, 2011, 11: 214. doi: 10.3389/fpls.2020.00214.
[9] Wakao S, Benning C. Genome-wide analysis of glucose-6-phosphate dehydrogenases in[J]. The Plant Journal, 2005, 41(2): 243-256.
[10] 丁林云. 水稻胞质6-磷酸葡萄糖酸脱氢酶基因的功能分析[D]. 南京: 南京农业大学, 2007.
Ding L Y. Functional analysis of cytoplast 6-phosphogluconate dehydrogenase in pentose phosphate pathway from rice (L.) [D]. Nanjing: Nanjing Agricultural University, 2007.
[11] 田宇, 彭瞰看, 宋春华, 等. 小麦基因的生物信息学分析及其低温胁迫下苗期的表达特征[J]. 麦类作物学报, 2019, 39(6): 631-638.
Tian Y, Peng K K, Song C H, et al. Bioinformatics analysis of wheatgenes and their expression patterns in tillering node and leaf under cold stress [J]. Journal of Triticeae Crops, 2019, 39(6): 631-638.
[12] 张心菲. 赤桉葡萄糖-6-磷酸脱氢酶()基因家族的表达与功能分析[D].广州: 华南农业大学, 2016.
Zhang X F. Expression and function analysis of glucose-6-phosphate dehydrogenase gene familyin[D]. Guangzhou: South China Agricultural University, 2016.
[13] Sindelár L, Sindelárová M. Correlation of viral RNA biosynthesis with glucose-6-phosphate dehydrogenase activity and host resistance [J]. Planta, 2002, 215(5): 862-869.
[14] Wang X M, Ma Y Y, Huang C H, et al. Involvement of glucose-6-phosphate dehydrogenase in reduced glutathione maintenance and hydrogen peroxide signal under salt stress [J]. Plant Signaling and Behavior, 2008, 3(6): 394-395.
[15] Landi S, Nurcato R, De Lillo A, et al. Glucose-6-phosphate dehydrogenase plays a central role in the response of tomato () plants to short and long-term drought [J]. Plant Physiology and Biochemistry, 2016, 105: 79-89.
[16] 王友须. 荷花葡萄糖-6-磷酸脱氢酶基因克隆及其在响应水淹胁迫中的功能分析[D]. 南京: 南京农业大学, 2016.
Wang Y X. Glucose-6-phosphate dehydrogrnase gene cloning and it is role in lotus response to submerge [D]. Nanjing: Nanjing Agricultural University, 2016.
[17] Lin Y Z, Lin S Z, Zhang W. Cloning and sequence analysis of a glucose-6-phosphate dehydrogenase genefrom freezing-tolerant[J]. Forestry Studies in China, 2015, 7(1): 1-6.
[18] Wang X M, Ma Y Y, Huang C H, et al. Glucose-6-phosphate dehydrogenase plays a central role in modulating reduced glutathione levels in reed callus under salt stress [J]. Planta, 2008, 227(3): 611-623.
[19] Scharte J, Schön H, Tjaden Z, et al. Isoenzyme replacement of glucose-6-phosphate dehydrogenase in the cytosol improves stress tolerance in plants [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(19): 8061-8066.
[20] Qian W J, Yue C, Wang Y C, et al. Identification of the invertase gene family () in tea plant and their expression analysis under abiotic stress [J]. Plant Cell Reports, 2016, 35 (11): 2269-2283.
[21] Qian W J, Xiao B, Wang L, et al., a tea vacuolar invertase gene enhances cold tolerance in transgenic[J]. BMC Plant Biology, 2018, 18(1): 228-248.
[22] Yue C, Cao H L, Wang L, et al. Effects of cold acclimation on sugar metabolism and sugar-related gene expression in tea plant during the winter season [J]. Plant Molecular Biology, 2015, 86(6): 591-608.
[23] Wang Y C, Qian W J, Li N N, et al. Metabolic changes of caffeine in tea plant ((L.) O. Kuntze) as defense response to[J]. Journal of Agricultural and Food Chemistry, 2016, 64(35): 6685-6693.
[24] 钱文俊, 岳川, 曹红利, 等. 茶树中性/碱性转化酶基因的克隆与表达分析[J]. 作物学报, 2016, 42(3): 376-388.
Qian W J, Yue C, Cao H L, et al. Cloning and expression analysis of a neutral/alkaline invertase gene () in tea plant (L. O. Kuntze) [J]. Acta Agronomica Sinica, 2016, 42(3): 376-388.
[25] Hao X Y, Horvath D P, Chao W S, et al. Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant ((L.) O. Kuntze) [J]. International Journal of Molecular Sciences, 2014, 15(12): 22155-22172.
[26] 林元震, 张志毅, 林善枝, 等, 桉树葡萄糖-6-磷酸脱氢酶(G6PDH)的全基因组分析与进化研究[J]. 安徽农业科学, 2011, 39(29): 17804-17805, 17906.
Lin Y Z, Zhang Z Y, Lin S Z, et al. Genome-wide analysis of glucose-6-phosphate dehydrogenase (G6PDH) and its evolution in[J]. Journal of Anhui Agricultural Sciences, 2011, 39(29): 17804-17805, 17906.
[27] Long X Y, He B, Fang Y J, et al, Identification and characterization of the glucose-6-phosphate dehydrogenase gene family in the para rubber tree,[J]. Frontiers in Plant Science, 2016, 7: 215. doi: 10.3389/fpls.2016.00215.
[28] 王晓敏. 葡萄糖-6-磷酸脱氢酶在芦苇愈伤组织盐适应性中调节作用的机理研究[D]. 兰州: 兰州大学, 2008.
Wang X M. Studies on the mechanism of regulations of glucose-6-phosphate dehydrogenase in the adaptation of reed callus to salt stress [D]. Lanzhou: Lanzhou University, 2008.
[29] Cappellini M D, Montemuros di F M, Dotti C, et al. Molecular characterisation of the glucose-6-phosphate dehydrogenase (G6PD) Ferrara II variant [J]. Human Genetics, 1995, 95(4): 440-442.
[30] 王晓晖, 刘晓, 高博闻, 等. 腊梅葡萄糖-6-磷酸脱氢酶()基因的克隆及表达分析[J]. 中国中药杂志, 2015, 40(21): 4160-4164.
Wang X H, Liu X, Gao B W, et ai. Cloning and expression analysis of glucose-6-phosphate dehydrogenase 1 () gene from[J]. China Journal of Chinese Materia Medica, 2015, 40(21): 4160-4164.
[31] 朱守晶, 史文娟. 苎麻镉响应基因的克隆和表达分析[J]. 江苏农业学报, 2019, 35(2): 262-270.
Zhu S J, Shi W J. Cloning and expression analysis of cadmium-responsive genefrom ramie (L.) [J]. Jiangsu Journal of Agricultural Sciences, 2019, 35(2): 262-270.
[32] 林元震. 甜杨葡萄糖6-磷酸脱氢酶基因克隆及结构分析与功能鉴定[D]. 北京: 北京林业大学, 2006.
Lin Y Z. Gene cloning, structure analysis and function identification of glucose-6-phosphate dehydrogenase from[D]. Beijing: Beijing Forestry University, 2006.
[33] Tupy J. The level and distribution pattern of fatex sucrose along the trunk ofMull. arg. as affected by the sink region induced by latex tapping [J]. Physiology, 1973, 11: 1-11.
[34] Wakao S, Andre C, Benning C. Functional analyses of cytosolic glucose-6-phosphate dehydrogenases and their contribution to seed oil accumulation in[J]. Plant Physiology, 2008, 146(1): 277-288.
[35] Lin S Z, Zhang Z Y, Liu W F, et al. Role of glucose-6-phosphate dehydrogenase in freezing-induced freezing resistance of[J]. Acta Photophysiologica Sinica, 2005, 31(1): 34-40.
[36] 曹玉芳. 青檀抗寒性的初步研究[D]. 北京: 北京林业大学, 2005.
Cao Y F. Preliminary studies on freezing resistance of[D]. Beijing: Beijing Forestry University, 2005.
[37] Hao X, Yang Y, Yue C, et al. Comprehensive transcriptome analyses reveal differential gene expression profiles ofaxillary buds at para-, endo-, ecodormancy, and bud flush stages [J]. Frontiers in Plant Science, 2017, 8:553.doi: 10.3389/fpls.2017.00553.
[38] 浦心春, 韩建国. 结缕草种子打破休眠过程中的代谢调控[J]. 中国草地学报, 1994(3): 20-24.
Pu X C, Han J G. Metabolic control of zoysiagrass seed when breaking dormancy [J]. Chinese Journal of Grassland, 1994(3): 20-24.
Identification and Expression Analysis of Glucose-6-hosphate Dehydrogenase Gene () in
WANG Yanding1, WANG Huan1, LI Nana2, WANG Lu2, HAO Xinyuan2, WANG Yuchun3, DING Changqing2, YANG Yajun2, WANG Xinchao2*, QIAN Wenjun1*
1. College of Horticulture, Qingdao Agricultural University, Qingdao 266109, China; 2. Tea Research Institute of the Chinese Academy of Agricultural Sciences/National Center for Tea Improvement/Key Laboratory of Tea Biology and Resources Utilization, Ministry of Agriculture and Rural Affairs, Hangzhou 310008, China; 3. College of Agriculture and Food Science, Zhejiang A&F University, Hangzhou 311300, China
As a key rate-limiting enzyme in pentose phosphate pathway, glucose-6-phosphate dehydrogenase (G6PDH, EC1.1.1.49) plays an important role in plant growth and development, and also in responding to environmentalstresses. However, the function of G6PDH in tea plants has not yet been reported. In our study, 3genes were cloned from tea plant, named as(MW025829),(MW025830) and(MW025831), respectively. Phylogenetic analysis shows that CsG6PDH1 and CsG6PDH4 belong to plastid protein, while CsG6PDH2 belongs to cytoplasmic protein. Quantitative analysis shows that the expressions ofvaried in different tissues. Under cold orinfection treatments, the time course expressions of bothandwere gradually reduced. Besides, bothandwere induced by cold acclimation in different tea cultivars. In addition, the expressions ofwere up-regulated during bud dormancy and flush periods. Consequently, our results implicate thatare widely participated in tea plant growth and development, and also involved in responding to abiotic and biotic stresses. This study provided a theoretical basis for in-depth study of the function of Csin tea plants.
glucose-6-phosphate dehydrogenase,, expression analysis, cold, cold acclimation
S571.1;Q946.84+1;Q939.1
A
1000-369X(2021)04-497-14
2020-08-10
2020-09-23
国家自然科学基金(31800588)、青岛农业大学科研启动基金(1118025)、青岛农业大学大学生创新创业训练项目
王彦丁,女,本科,主要从事茶树遗传育种研究。*通信作者:xcw575@tricaas.com;qau-WenjunQian@qau.edu.cn
(责任编辑:赵锋)
