对紫茎泽兰具有除草活性的特基拉芽胞杆菌ZLSY5的鉴定及发酵条件筛选
2021-08-11兰明先白云梅王志江谢永辉朱法亮詹莜国曾舒泉吴国星
兰明先,白云梅,王志江,谢永辉,朱法亮,詹莜国,曾舒泉,吴国星*
(1.云南农业大学植物保护学院,昆明 650201;2.云南省烟草公司昆明市公司,昆明 650051)
在农业领域,杂草比其他任何农业害虫都能造成更大的作物产量和质量的下降[1]。在现代农业中,农作物保护很大程度上依赖于使用合成除草剂来控制杂草[1]。除草剂是作物保护类产品的重要组成部分,广泛应用于水稻、玉米和小麦等主要作物,对提高作物质量和产量起着至关重要的作用[2]。在提倡生态文明的当下,微生物除草剂越来越多的应用于农林牧业。紫茎泽兰EupatoriumadenophorumSpreng,属菊科泽兰属,是一种入侵性极强的多年生恶性杂草,是我国外来入侵物种中危害最为严重的植物之一[3]。目前利用泽兰实蝇控制紫茎泽兰是生物防治的一个重要措施,但紫茎泽兰分蘖能力和繁殖能力较强,导致泽兰实蝇的寄生速度赶不上紫茎泽兰的扩散速度,控制效果有限[4,5]。在之前的研究中发现,从泽兰实蝇幼虫中分离纯化得到的22株共生菌中,有6株菌(分别属于芽胞杆菌属、泛菌属等)对紫茎泽兰叶片有侵害作用[6],其中菌株ZLSY5具有一定的除草活性,但该菌株的进化关系及发酵条件尚未研究清楚。因此,通过对细菌的形态特征观察以及系统进化树的建立,鉴定了菌株的种属关系;采用两因素有重复试验,对菌株ZLSY5的基础发酵培养基和发酵条件进行了优化,明确其最佳发酵条件,为利用该菌株防治紫茎泽兰奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌种 保存于本实验室,菌株编号为ZLSY5。
1.1.2 供试培养基 营养琼脂培养基(NA):牛肉膏 0.6 g,蛋白胨 2 g,NaCl 1 g,琼脂 3 g,蒸馏水200 mL,121 ℃ 灭菌20 min;蛋白胨酵母培养基(LB):蛋白胨 2 g,酵母浸粉 1 g,氯化钠 2 g,琼脂 3 g,蒸馏水200 mL,121 ℃灭菌20 min;细菌基础培养基(CM):葡萄糖 1 g,(NH4)2SO40.4 g,柠檬酸钠0.2 g,MgSO4·7H2O 0.04 g,K2HPO40.8 g,KH2PO41.2 g,琼脂 3 g,蒸馏水 200 mL,121 ℃灭菌 20 min;牛肉膏酵母葡萄糖培养基(NYBD):牛肉浸膏1.6 g,酵母浸粉1 g,葡萄糖 2 g,琼脂 3 g,蒸馏水200 mL,115 ℃灭菌30 min;蛋白胨酵母蔗糖培养基(YSP):蛋白胨 2 g,酵母浸粉 1 g,蔗糖 4 g,琼脂 3 g,蒸馏水200 mL,115 ℃灭菌30 min。
1.2 内共生菌的鉴定
1.2.1 内共生菌的分离 对采回的虫瘿整体消毒后在超净工作台内解剖出幼虫,将幼虫体表消毒后解剖,获得体内各组织[7]。分别收集所获得的各组织于离心管内,研磨后梯度稀释制备菌悬液。取 10-5、10-6、10-7稀释度的菌悬液0.1 mL,分别接种在NA培养基上,每个梯度做3个重复[8]。将接菌后的培养皿倒置,28 ℃培养2 d[9]。待长出单菌落后,进行纯化培养。纯化3~4次可得纯化后的单菌落[10]。
1.2.2 菌落菌体特征观察 挑取纯化后的单菌落接种于LB培养基,28 ℃培养2 d,获得单菌落。待长出单菌落后观察其形态[11]。挑取单菌落涂布于载玻片上,做单染色,革兰氏染色[12]。在显微镜下观察菌体形态,测定菌体大小,记录革兰氏染色结果。
1.2.3 16S rDNA的扩增和测序 将所纯化分离的菌做16S rDNA基因序列鉴定。根据形态特征归类的微生物类群,选用试剂盒提取代表单菌落DNA,方法根据试剂盒说明书。将提取的DNA用于细菌高变动区段V4区的体外扩增,引物为16S V4区通用引物[13]。PCR产物回收纯化使用pJET载体链接,通过BJIⅡ 酶切鉴定并送生物公司测序(昆明擎科生物公司),测序结果在GenBank(http://www.ncbi.nih.gov)中进行BLAST 比对分析。
1.2.4 系统发育树的构建 测序结果通过 DNAstar和chromas 软件校对,并在NCBI中blast比对下载已发表的最高相似序列,相关序列用MEGA 6.0软件经CLUSTALW比对,采用 Jukes-cantor模型构建N-J树[7]。
1.3 内共生菌发酵条件筛选
1.3.1 培养基对细菌菌液浓度的影响 挑取纯化后的ZLSY5单菌落接种于LB液体培养基,28 ℃摇床180 r/min培养16 h,OD值为0.8~1.2,获得菌悬液。取50 μL ZLSY5的菌悬液分别接种于100 mL的YSP、NA、NYBD、CM和 LB培养基中。在25 ℃,220 r/min的摇床里振荡培养24、48和72 h,采用分光光度法测定菌液在600 nm处的OD值,从而测定菌液浓度[14]。
1.3.2 氮源对细菌菌液浓度的影响 以上述试验筛选出的培养基为基础培养基,用基础培养基为对照,试验组分别加入酵母膏(JMG)、甘氨酸(Gly)、蛋白胨(DBD)、硝酸铵(XSA)、丙氨酸(Ala)和谷氨酸(Glu)作氮源,发酵培养24、48和72 h后分别测定不同氮源培养基的OD值,以此明确氮源对细菌菌液浓度的影响[14]。
1.3.3 碳源对细菌菌液浓度的影响 将1.3.1中筛选出的适合ZLSY5生长的培养基作为基础培养基,以碳源为蔗糖时作为对照,葡萄糖(PPT)、蔗糖(ZT)、麦芽糖(MYT)、乳糖(RT)、淀粉(DF)作碳源,发酵培养24 h后测定第1次OD值,48 h后测第2次,72 h后测第3次,与对照比较不同碳源对细菌菌液浓度的影响[14]。
1.3.4 pH 对细菌菌液浓度的影响 制备优化的培养基,调节pH分别为 4、5、6、7、8、9、10,将50 μL菌株ZLSY5菌悬液接种于不同pH的培养基中,放于摇床培养24、48、72 h后测定菌株在不同pH条件下的OD值,以此来判断pH对细菌菌液浓度的影响[15]。
1.3.5 温度对细菌菌液浓度的影响 在优化培养基中接种50 μL的菌株ZLSY5菌悬液,在温度16 ℃、20 ℃、24 ℃、28 ℃、32 ℃、36 ℃和40 ℃,转速为220 r/min的摇床中培养24、48、72 h后,测定各温度下的OD值,从而判断温度对细菌菌液浓度的影响[15]。
1.3.6 转速对细菌菌液浓度的影响 将菌株接种到优化培养基中,培养条件采用上述优化条件,设定摇床转速分别为140、160、180、200、220、240 r/min,测定不同转速下菌液的OD值[15]。
1.3.7 光照对细菌菌液浓度的影响 采用优化培养基配方,培养条件采用上述优化条件,设定光照为0 h/d、4 h/d、8 h/d、12 h/d、16 h/d、20 h/d、24 h/d,测定不同光照对细菌菌液浓度的影响。
1.3.8 通气量对细菌菌液浓度的影响 在250 mL的三角瓶中分别加入优化发酵培养基20、40、80、120和160 mL,在220 r/min的摇床培养,测定不同通气量下细菌的OD值[15]。
1.3.9 初始接菌量对细菌菌液浓度的影响 将菌株ZLSY5菌悬液按100 mL装液量的0.5%、1%、5%、10%、20%、25%和30%分别接入到优化培养基中,测定在不同接菌量条件下细菌OD值,从而判断初始接菌量对细菌的菌液浓度有何影响[16]。
1.3.10 发酵时间对细菌菌液浓度的影响 采用优化培养基,培养条件采用上述优化的温度、pH、初始接菌量、通气量,分别发酵12、24、36、48、60、72、96、108、120、132和144 h,测定不同发酵时间对ZLSY5菌液浓度的影响[14]。
1.4 除草活性比较
菌株ZLSY5对紫茎泽兰叶片影响作用的测定采用叶圆片法。选取紫茎泽兰植株固定部位大小一致的叶片,在清水里冲洗一段时间,取出叶片晾干,用30%过氧化氢对叶表面灭菌。将灭菌后的滤纸平铺于无菌培养皿内,试验组加入5 mL于摇床培养24 h的菌悬液,对照组加入5 mL的无菌水。设13个对照和12个处理。对照分别为无菌水对照、LB液体培养基的原液、2倍、4倍、8倍、16倍和32倍稀释液,NYBD液体培养基的原液、2倍、4倍、8倍、16倍和32倍稀释液,处理分别为LB培养基细菌发酵液原液、2倍、4倍、8倍、16倍和32倍稀释液,NYBD培养基细菌发酵液原液、2倍、4倍、8倍、16倍和32倍稀释液。用直径为6 mm的打孔器打取紫茎泽兰叶圆片,叶背面向上平放于放有滤纸的5 mL菌悬液的培养皿内,用保鲜膜封口后置于(25±2)℃,光周期 12L∶12D的培养箱条件下培养,3次重复,每隔24 h统计一次结果。采用分级统计方法记录紫茎泽兰叶圆片的受害情况。评价菌悬液对叶圆片侵害程度的标准如表 1[6]。侵害指数=Σ(该级别值×出现该级别的圆片数)/(5×所有观察的圆片数)×100%。

表1 评价菌株ZLSY5菌悬液对紫茎泽兰叶圆片侵害程度的标准Table 1 The standard of the violation severity of E.adenophorum leaf discs caused by the bacteria suspension of strain ZLSY5
1.5 数据统计与分析
用SPSS 16.0软件进行数据处理与分析;Duncan氏新复极差法检验。
2 结果与分析
2.1 内共生菌鉴定结果
菌落直径3~4 mm,表面粗糙,不透明,褶皱,卡其色,拱起状,边缘整齐。菌体杆状,1.5~2.53 μm。芽胞椭圆形,(0.7~1.06)μm×(1.25~1.9)μm,革兰氏阳性菌。由进化树可得菌株ZLSY5为特基拉芽胞杆菌Bacillustequilensis10b(图1)。
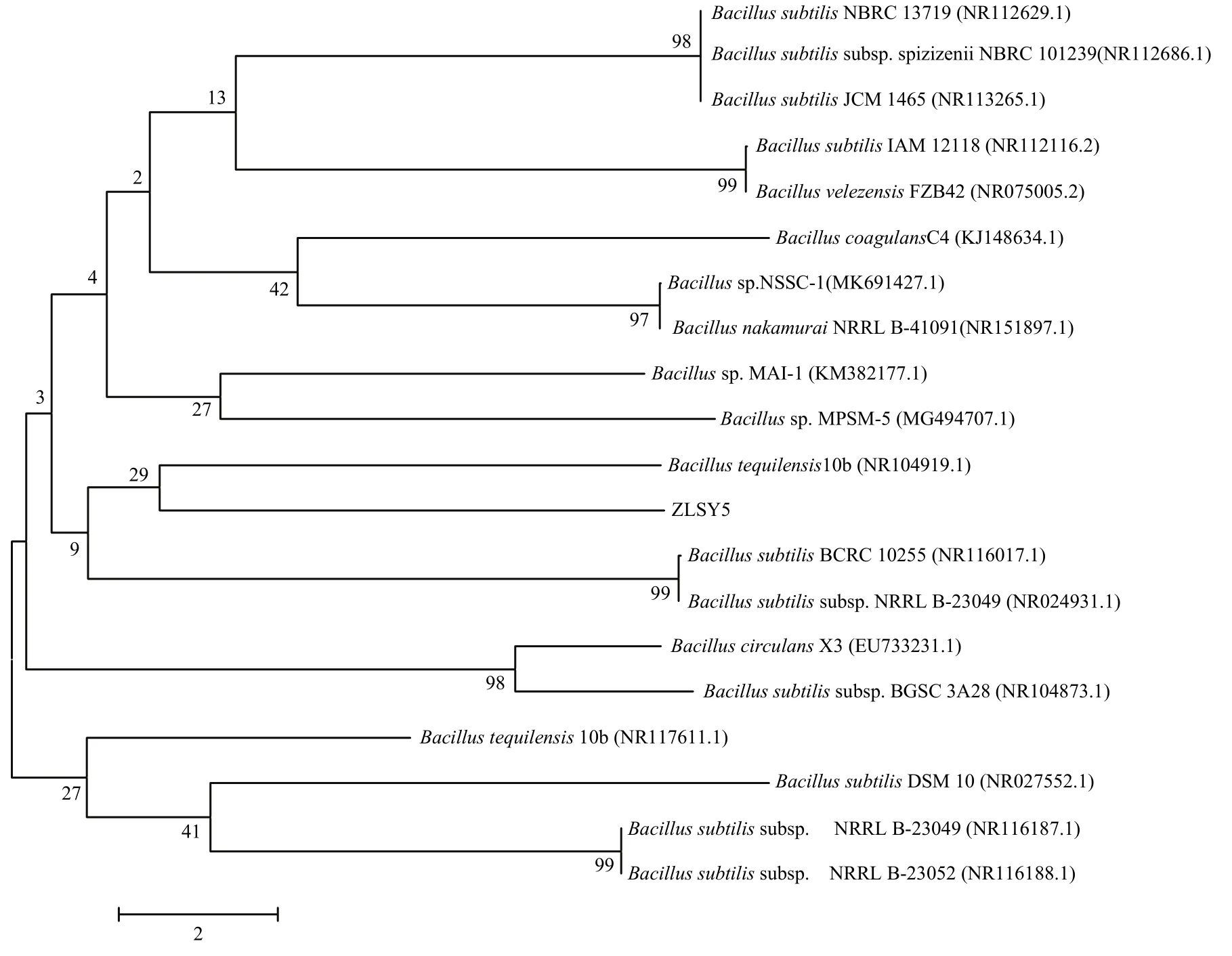
图1 菌株ZLSY5 N-J进化树Fig.1 N-J evolutionary tree of strain ZLSY5
2.2 发酵条件筛选
2.2.1 培养基优化结果 菌株ZLSY5在不同培养基上的菌液浓度在各个时间段内均有显著差异(F=77307.835,df=8,P=0.0001)。在24~72 h,菌株ZLSY5在NYBD培养基上菌液浓度呈稳定趋势上升,72 h后菌液浓度高达2.236。从整体上看,细菌在NYBD培养基上生长最快,YSP培养基在48 h后菌液浓度增长趋势减缓(图2)。
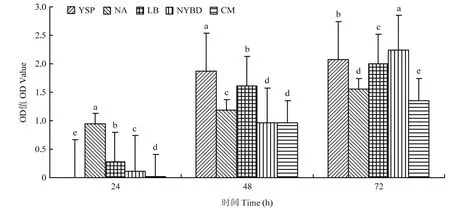
图2 培养基对菌株ZLSY5生长速度的影响Fig.2 Effect of medium on the growth rate of strain ZLSY5
2.2.2 氮源筛选结果 菌株ZLSY5在各个时间段内不同氮源对ZLSY5菌液浓度的影响有显著差异(F=1085.185,df=10,P=0.0001)。酵母膏作氮源时最适合菌株ZLSY5生长,其次为蛋白胨,而甘氨酸、谷氨酸、丙氨酸和硝酸铵不适合作菌株ZLSY5的氮源(图3)。

图3 氮源对菌株ZLSY5生长速度的影响Fig.3 Effect of nitrogen source on the growth rate of strain ZLSY5
2.2.3 碳源筛选结果 菌株ZLSY5在葡萄糖(PPT)、蔗糖(ZT)、麦芽糖(MYT)和乳糖(RT)、淀粉(DF)等碳源上均能生长。而且在各个时间段内,5种碳源对菌株 ZLSY5的生长均有显著影响(F=70269.76,df=8,P=0.0001)。这5种碳源均可作为菌株ZLSY5的碳源来利用,相较而言,葡萄糖、麦芽糖和蔗糖作为碳源要优于淀粉和乳糖(图4)。
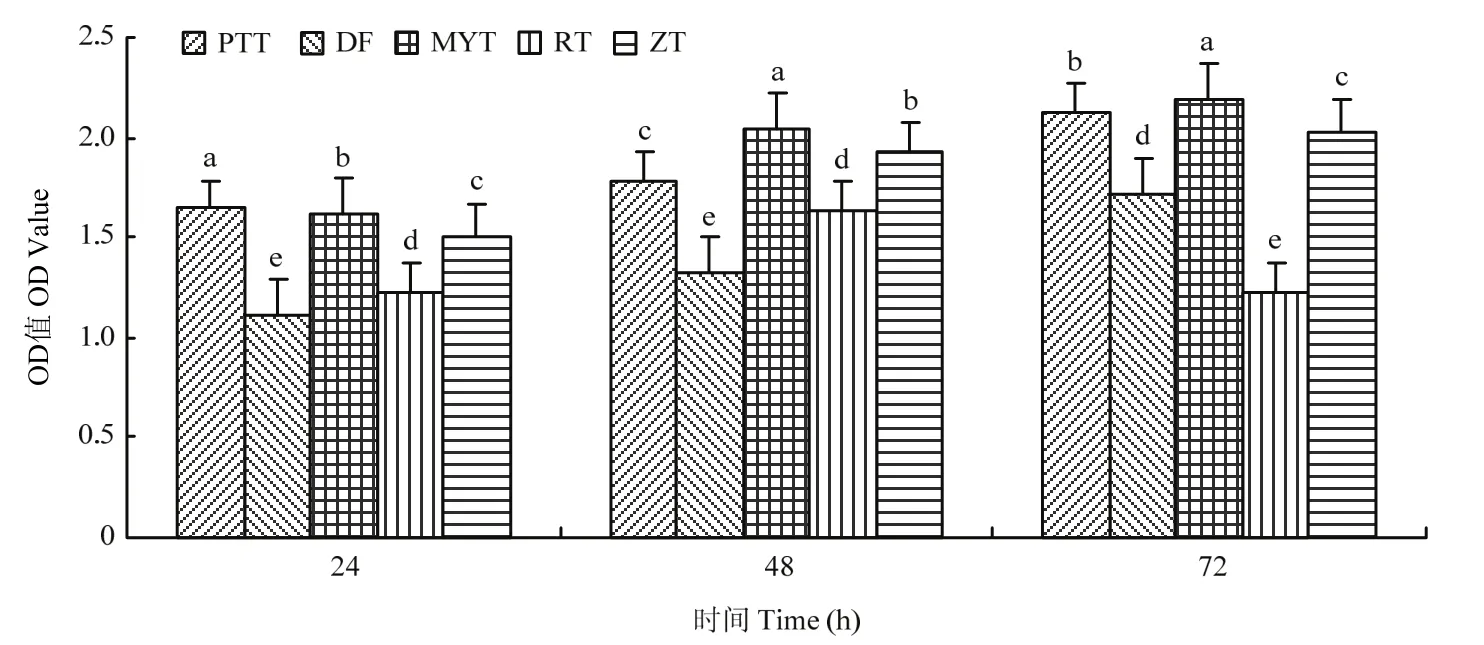
图4 碳源对菌株ZLSY5生长速度的影响Fig.4 Effects of carbon source on the growth rate of strain ZLSY5
2.2.4 pH优化结果 菌株 ZLSY5在各个时间段内不同 pH对 ZLSY5菌液浓度的影响有显著差异(F=164.521,df=12,P=0.0001)。pH 4~10时,菌株ZLSY5的菌液浓度没有随着时间增加而增加,而pH在5~9时,在24~48 h内菌液浓度均随着时间的增加而不断增大,表明在pH 5~9范围内菌株ZLSY5均可生长(图5)。
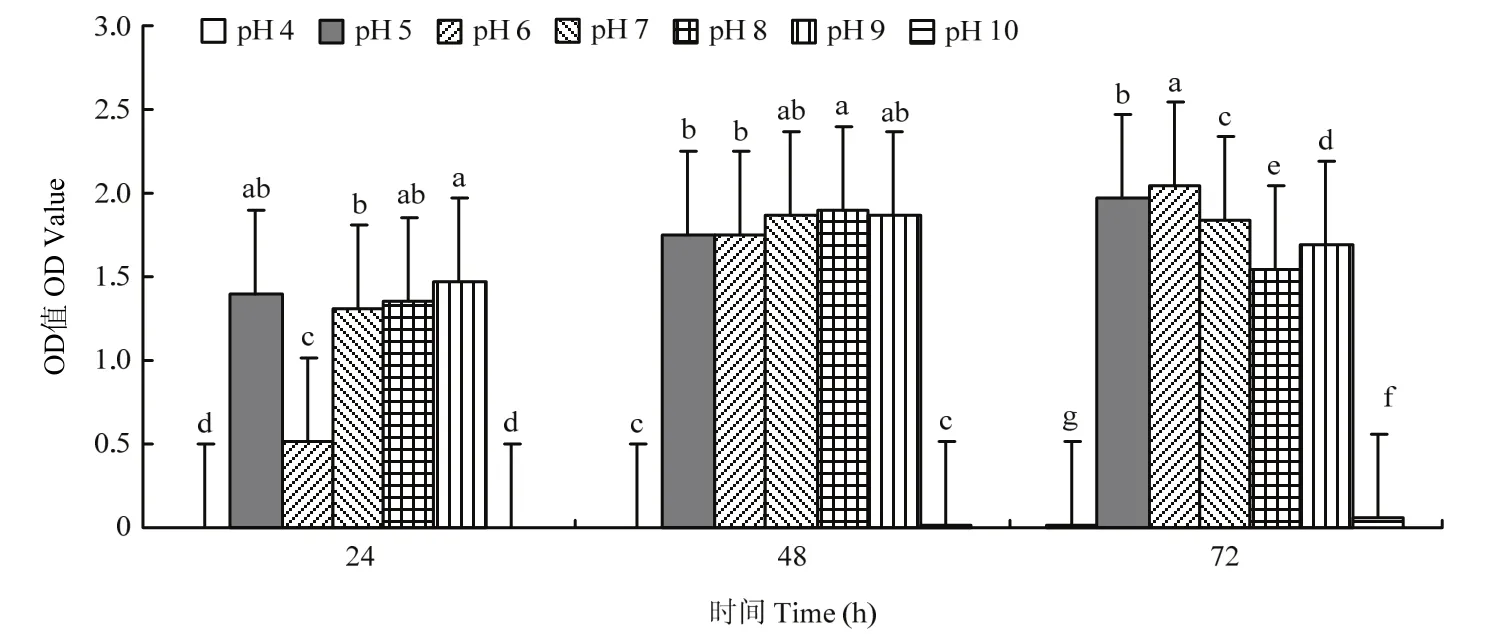
图5 pH对菌株ZLSY5生长速度的影响Fig.5 Effect of pH on the growth rate of strain ZLSY5
2.2.5 温度筛选结果 菌株ZLSY5在各个时间段内不同温度对ZLSY5菌液浓度的影响有显著差异(F=41.305,df=12,P=0.0001)。在72 h时,除40 ℃以外,各温度下菌液浓度有差异,但是差异较小。由此表明,菌株ZLSY5在温度16 ℃~36 ℃均能生长,而最适合其生长的温度是28 ℃(图6)。
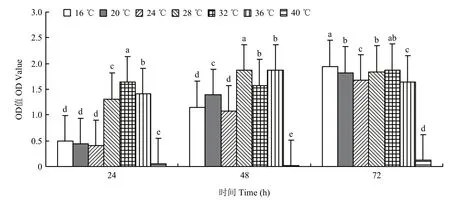
图6 温度对菌株ZLSY5生长速度的影响Fig.6 The influence of temperature on the growth rate of strain ZLSY5
2.2.6 转速筛选结果 不同的转速下 ZLSY5菌液浓度有显著的差异(F=7.274,df=10,P=0.0001)。不同转速下测得的OD值结果显示,当转速为200、220和240 r/min时,菌株ZLSY5的菌液浓度增长较快。转速为240 r/min时,菌株ZLSY5生长速度最快(图7)。
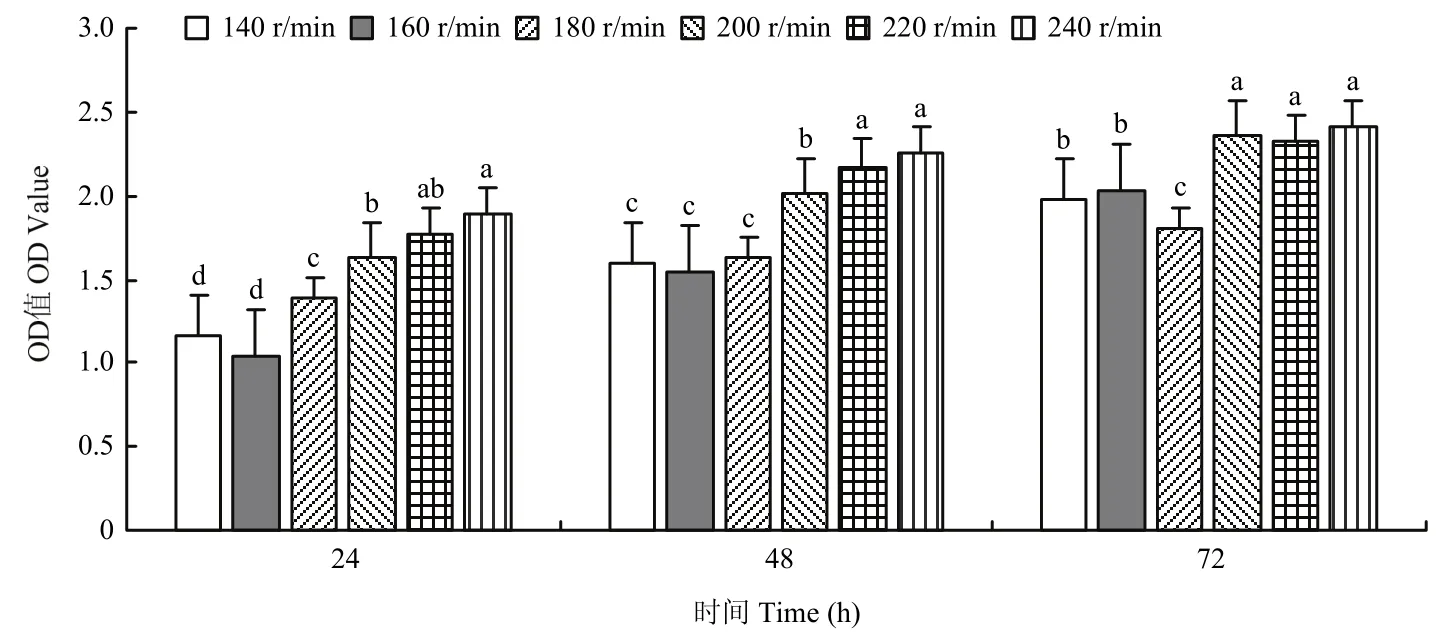
图7 转速对菌株ZLSY5生长的影响Fig.7 The influence of rotating speed on the growth of the strain ZLSY5
2.2.7 光照筛选结果 不同的光照时间下菌株 ZLSY5菌液浓度有显著的差异(F=5.847,df=12,P=0.0001)。当光照时间为20 h/d时,菌株ZLSY5的菌液浓度最大。光照时间为0 h/d时菌液浓度最小,且菌液增长速度最小(图8)。

图8 光照时间对菌株ZLSY5生长的影响Fig.8 The influence of lighting time on the growth of the strain ZLSY5
2.2.8 通气量筛选结果 不同的通气量下ZLSY5菌液浓度有显著的差异(F=12.357,df=8,P=0.0001)。当摇瓶中所装培养液为40 mL时细菌生长最快,培养24 h后基本趋于稳定,其次是20和80 mL。装液量为160 mL时细菌产生量较少(图9)。
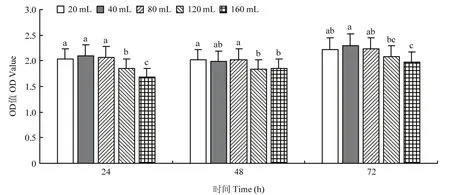
图9 通气量对菌株ZLSY5生长的影响Fig.9 The influence ventilation quantity on the growth of the strain ZLSY5
2.2.9 初始接菌量筛选结果 不同的初始接菌量下菌液浓度有显著的差异(F=16.611,df=12,P=0.0001)。当接菌量为2.00%时菌液浓度增长最快,细菌产生量最多,OD值为1.908,其次是2.50%和0.10%。在24 h时,菌液浓度受到初始接菌量的影响,但是随着培养时间的增加,初始接菌量的影响越来越小(图10)。
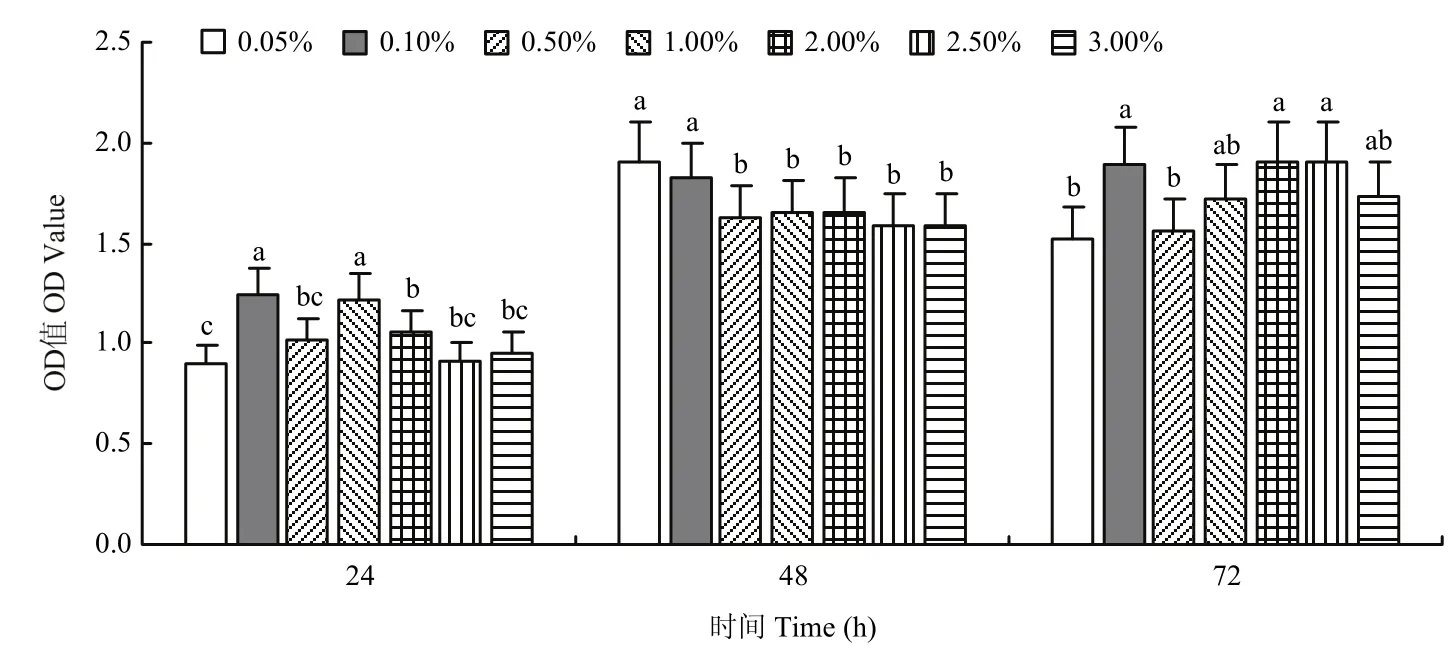
图10 初始接菌量对菌株ZLSY5生长的影响Fig.10 The influence of initial inoculation quantity on the growth of the strain ZLSY5
2.2.10 发酵时间对细菌菌液浓度的影响 在4 h之前,菌液浓度基本没有增长,此时处于细菌生长的迟缓期;在4 h之后,ZLSY5随着培养时间的增加其菌液浓度也随之增加,在36 h时达到最大值,此阶段是菌株的对数生长期;在36~60 h,菌液浓度处于一个较为平稳的OD值内,此时是细菌生长的平稳期;在60 h之后,随着培养时间的增加,菌株的OD值开始缓慢下降,此时处于细菌生长的衰亡期(图11)。

图11 菌株ZLSY5的生长曲线图Fig.11 The growth curve of strain ZLSY5
2.3 优化培养基后菌株ZLSY5除草活性比较
优化后的培养基NYBD培养的菌株ZLSY5对叶片的侵害效果更好。由于所得数据是消除培养基对叶片的影响后的数据,而LB培养基在原浓度和稀释2倍浓度下对叶片有侵害作用,因此在这两个浓度下LB培养基对叶片的侵害作用不明显。而优化后的NYBD培养基培养的菌株ZLSY5对叶片的影响较小,消除后随着浓度的减小,侵害作用也在相应地减小,但作用均好于LB培养基所培养的菌的侵害作用。优化后在原浓度即浓度为1时,侵害作用最大,接近90%(图12)。
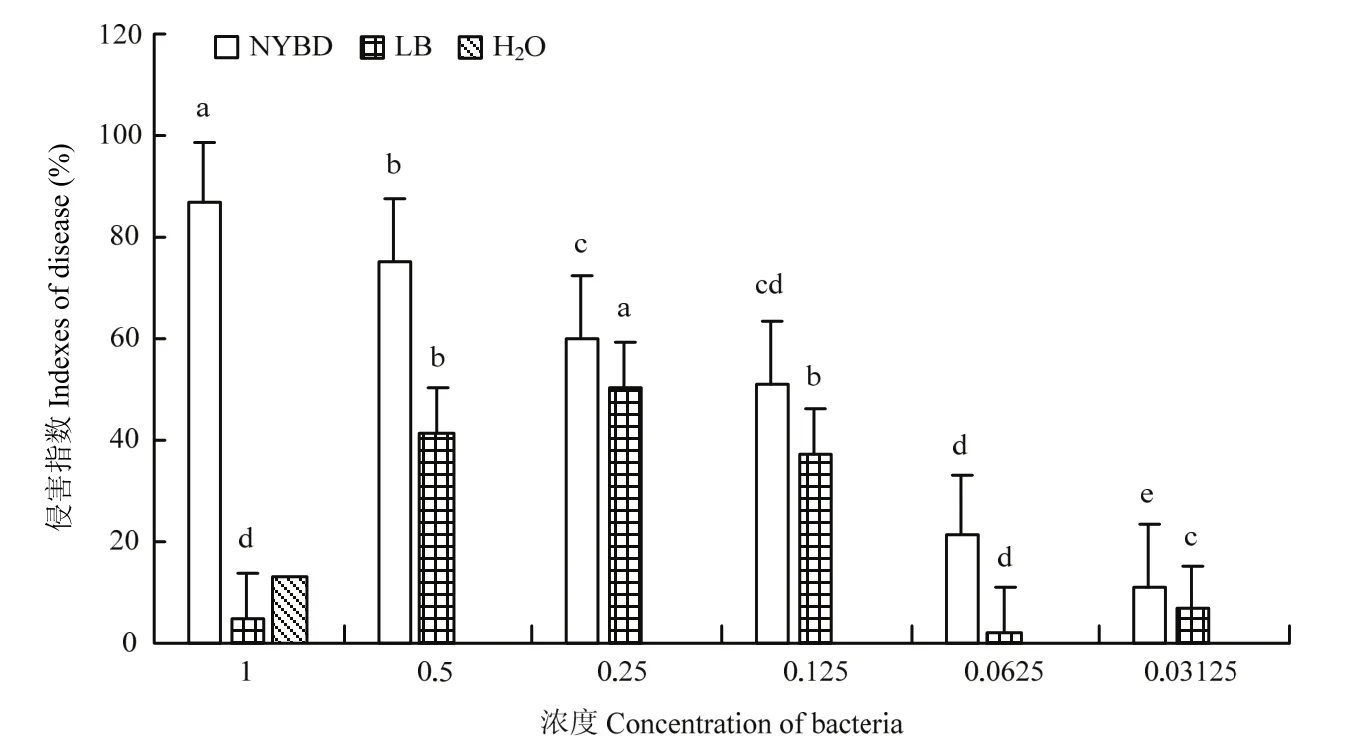
图12 菌株ZLSY5优化后对紫茎泽兰叶片的侵害程度Fig.12 The degree of damage to the leaves of E.adenophorum after strain ZLSY5 optimization
3 讨论
芽胞杆菌属的细菌在分类上存在着不同的分类法。传统的芽胞杆菌分类主要依据其形态学特征,现在则大多采用多相分类法,即将形态、生理生化、化学(脂肪酸分析)、分子(DNA 碱基分析、DNA 同源性分析,16S rRNA 测序)等分类方法相结合,并根据所得数据进行聚类分析,得出的结果相对比较准确。利用分子技术可以根据菌的基因进行鉴定,将芽胞杆菌的分类地位划分的更确切。多相分类是传统的表型分类、数值分类和分子分类等方法的综合应用,因而可以更客观地反映生物间的系统进化关系[17]。
影响微生物发酵的因子有很多,主要包括碳源、氮源、温度、初始pH值等,但不同的微生物对碳源、氮源、温度等条件的选择又有差异[18,19]。从本试验研究结果来看,各个碳源对菌株 ZLSY5生长速度的影响是有差异的,但是均能生长,说明菌株 ZLSY5的发酵培养基对碳源的选择范围较广,其中对麦芽糖、蔗糖和葡萄糖利用效果较好。对于筛选最佳氮源,发现蛋白胨、酵母膏有利于菌体生长;而铵态氮源硝酸铵难以被利用,且铵态氮作氮源时在一定程度上抑制了菌株 ZLSY5的生长;用氨基酸类作为氮源,菌株的菌液浓度较低,说明氨基酸类也不适合作为氮源。
目前,大部分细菌通常用LB培养,因为在LB上生长的细菌类群相对单一,有单一类群优势或抑制其他类群生长的现象[20,21]。但本试验分别采用YSP、NB、NYBD、CM和LB培养基对菌株ZLSY5进行摇床培养,发现该菌在24 h内在NYBD生长最好,其次才是LB。与侯佳佳等[22]研究报道凝结芽胞杆菌高产活菌的最佳培养基和秦艳等[23]优化的枯草芽胞杆菌的培养基不同。可能是不同菌株适合不同的营养物质,这可能与不同菌株的遗传特征和生理特性不同有关,也与所获取菌株的特定生境有关。
在发酵条件筛选方面,培养基的初始pH直接影响菌体细胞膜所带的电荷,影响其对营养物质的吸收,进而影响细菌的生长和繁殖[23]。选择最适合的初始pH有利于菌体的生长繁殖与生物量的提高。菌株ZLSY5最适pH为5~9,说明其适合弱酸性至弱碱性的环境,过酸或者过碱都不适合生长。在一定温度范围内,随着温度的升高,细胞中蛋白质和酶活性增强,使其生长和繁殖速率大大提高;如温度过高,细菌细胞中对温度敏感的组成成分(蛋白质、核酸)会受到不可逆的破坏,抑制菌体生长和繁殖[24]。该菌在温度为16 ℃~36 ℃内均能正常生长,说明其对环境温度的适应能力较强,但在24 ℃以下生长很慢,则表明低温不适合用于该菌的发酵培养。而转速和通气量都与培养液中的氧气溶解量有关,试验结果表明装液量为40 mL/250 mL、转速为240 r/min时菌株ZLSY5的菌液浓度最大;针对接菌量的研究,则与细菌的养分利用和生长空间有关,接种量为2.0%时,细菌生长得最好,菌株ZLSY5能充分利用养分和空间,接菌量过多则因养分和空间有限,细菌生长会受到抑制。光照时长对菌株ZLSY5生长的影响表现为光照20 h/d最适其生长,说明该菌为感光型细菌。
本试验对菌株 ZLSY5的发酵条件进行优化并确定了最佳条件,提高其发酵产量,有望从中分离得到有益的活性物质,这为利用细菌防治紫茎泽兰奠定了一定的基础。但对于发酵液的活性成分尚未清楚,后续会对菌株的除草活性成分进行研究。
