乙型肝炎相关慢加急性肝衰竭患者lncRNA表达谱分析
2021-08-11李小梅李荣华符小玉
李小梅,李荣华,符小玉,李 颖,傅 蕾*
(中南大学湘雅医院a.感染科&湖南病毒性肝炎重点实验室;b.核医学科,中国湖南长沙410008)
乙型肝炎相关慢加急性肝衰竭(hepatitis B virus-related acute-on-chronic liver failure,HBVACLF)是在慢性乙肝病毒感染基础上发生的急性肝功能衰竭,可有出血、感染、肝性脑病和肝肾综合征等严重并发症,4周病死率为39.9%[1]。HBVACLF患者病情进展隐匿,出现临床症状时疾病大多已进入晚期,内科综合治疗效果差,预后不良[2]。因此,寻找能早期诊断HBV-ACLF的新的标志物,在疾病早期及时干预,阻止病情进一步发展,改善患者预后,成为急需解决的问题。Wu等[3]发现,外周血中纤溶酶原的水平随着慢性肝病的进展不断降低,纤溶酶原水平与HBV-ACLF的临床病程密切相关,纤溶酶原可能是HBV-ACLF潜在的早期诊断和预后标志物。但是,这项研究尚处于初步阶段,许多发现还需进一步严谨的实验来反复验证,纤溶酶原指标距离临床应用还有很长的路要走。
长链非编码RNA(long non-coding RNA,lnc-RNA)是转录本长度超过200 nt且不具备编码蛋白质功能的一类RNA。其在表观遗传学、基因转录、转录后修饰和翻译过程中均具有作用,在多个层面调控基因的表达,广泛地参与机体的生理病理过程[4~5]。研究表明,lncRNA MCM3AP-AS1[6]、lnc-RNA-PXN-AS1[7]和 lncRNA CASC9[8]在肝癌组织中表达失调,其表达水平与肝癌细胞的增殖、侵袭及远处转移密切相关,这些lncRNA分子可能是肝癌潜在的早期分子诊断标志物及治疗靶点。lncRNA在肝炎、非酒精性脂肪肝、肝纤维化等肝脏疾病中也发挥着重要的调控作用[9],但目前尚无关于lncRNA在HBV-ACLF患者中表达水平的文献报道。因此,本研究首次通过高通量测序检测HBV-ACLF患者中lncRNA表达谱,并进一步对lncRNA在HBV-ACLF中的功能进行探讨。
1 对象与方法
1.1 研究对象
本实验分为乙肝携带者(asymptomatic carrier,ASC)组和HBV-ACLF患者组,每组各选取5例患者进行研究,样本收集自中南大学湘雅医院感染科门诊和住院部。ASC与HBV-ACLF患者是根据2015年《慢性乙型肝炎防治指南》[10]和2018年《肝衰竭诊治指南》[11]中的标准来确诊的。排除标准:1)其他各型病毒性肝炎;2)酒精性肝炎;3)自身免疫性肝病;4)非酒精性脂肪肝等;5)妊娠患者;6)合并肿瘤等。该研究符合人体伦理学标准,已获得中南大学湘雅医院伦理委员会的许可(伦理委员会批号:2019030199),并得到了参与研究患者的知情同意。
1.2 试剂及材料
Trizol试剂盒(美国Invitrogen公司);2100生物分析仪及其配套使用的RNA 6000 Nano Lab-Chip试剂盒(美国Agilent公司);核糖体RNA去除试剂盒Epicentre Ribo-Zero Gold(美国Illumina公司);逆转录试剂盒(美国Illumina公司);测序仪Il lumina HiSeq 4000(杭州联川生物技术有限公司)。
1.3 全血总RNA提取及纯化
应用Trizol试剂盒提取外周血中总RNA,操作步骤严格按照试剂盒说明书执行。对提取的总RNA采用2100生物分析仪和RNA 6000 Nano LabChip试剂盒进行质检,RNA完整值(RNA integrity number,RIN)在7.0以上为质检合格。选取10 μg通过质检的RNA,使用Epicentre Ribo-Zero Gold试剂盒去除核糖体RNA,操作过程按照试剂盒说明书进行。
1.4 芯片杂交和高通量测序
纯化后的聚(A)-或聚(A)+RNA在高温下被二价阳离子降解为RNA片段。采用逆转录试剂盒将RNA片段逆转录成cDNA,然后进行聚合酶链式反应(polymerase chain reaction,PCR)扩增以构建测序文库,配对末端文库的平均插入片段为300(±50)bp。在 Illumina HiSeq 4000测序仪上对测序文库采用单端测序(single-end sequencing)程序进行高通量测序,测序模式PE150。
1.5 差异表达分析
对高通量测序获得的原始数据进行预处理,以获得有效数据。采用FPKM(fragments per kilobase of exon model per million mapped reads)来度量lncRNA及mRNA在不同样本中的表达水平,即lncRNA/mRNA表达量=FPKM值。应用DESeq软件包对两组样本的转录本表达水平进行差异计算,同一转录本在两组样本间是否差异表达主要根据P值及差异倍数(fold change,FC)来确定。P<0.05表明差异表达具有统计学意义,|log2FC|≥1表明同一个lncRNA或mRNA在两组样本间差异表达。
1.6 GO功能注释、KEGG通路富集分析及cis预测
应用基因本体论(Gene Ontology,GO;http://david.abcc.ncifcrf.gov/)分析描述差异表达lncRNA的功能属性。把所有差异表达lncRNA的基因向GO数据库的各条目映射,计算各个条目上差异表达基因的数目,然后根据基因数目确定差异表达基因显著富集的GO条目,从而探索差异表达基因的生物学功能[12]。应用京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG;www.genome.jp/kegg)分析探讨差异表达基因参与的信号通路。以KEGG通路为单位,找出差异表达基因富集的信号通路,并通过费希尔精确检验(Fisher’s exact test)计算每条通路上差异基因富集的显著性(以P<0.05作为筛选条件,P值越小,差异基因与此信号通路的关系越密切)[13]。lncRNA调控基因表达的方式主要包括顺式调控(cis regulation)和反式调控(trans regulation)两类[14~15]。Cis调控是指lncRNA调节其上游和下游100 kb范围内编码基因的转录激活,从而影响mRNA的表达水平。根据cis调控方式进行lncRNA靶基因预测,主要是基于lncRNA与靶基因之间的位置关系,并以Pearson相关系数≥0.95且P≤0.05为标准进行筛选。文中应用cis调控预测差异表达lncRNA调控的靶mRNA。
2 结果
2.1 两组患者的临床特征
HBV-ACLF组和ASC组的5例患者均为3名男性、2名女性,年龄均在40岁左右。HBV-ACLF组总胆红素(total bilirubin,TBIL)均在171 μmol/L以上,且凝血酶原活动度(prothrombin activity,PTA)均在40%以下。而ASC组的肝酶均在正常范围内,且HBV-DNA值均低于检测下限,提示ASC组为非活动性乙肝携带者(表1)。
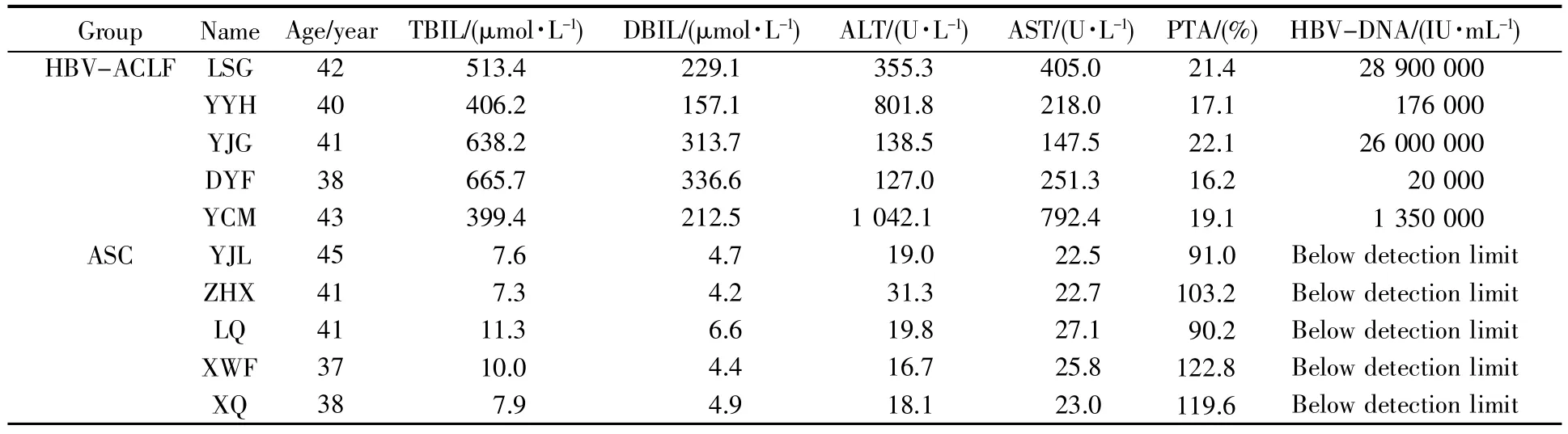
表1 两组患者的临床特征Table 1 Clinical characteristics of two groups of patients
2.2 HBV-ACLF组和ASC组间差异表达的lnc-RNA及mRNA
高通量测序结果表明,与ASC组相比,HBVACLF组的lncRNA表达水平发生了显著变化,共有131个lncRNA在HBV-ACLF组差异表达。其中,114个lncRNA表达上调(log2FC≥1,P<0.05),17个 lncRNA 表达下调(log2FC≤-1,P<0.05)(图1)。上调最显著的前4位lncRNA分别为PIGC(FC=14.60)、CYB5R4(FC=4.71)、SCAF11(FC=4.60)和IRAK3(FC=4.03)(表2),下调最显著的4个lnc-RNA 依次为 THRB(FC=0.25)、ABCC4(FC=0.29)、RP11-25K21.6(FC=0.29)和TNFSF13B(FC=0.30)(表3)。研究表明,lncRNA可通过多种方式作用于mRNA,影响mRNA的表达[16]。因此,本研究同时对两组样本的mRNA表达谱进行了高通量测序分析,共筛选出338个差异表达的mRNA,其中137个mRNA在HBV-ACLF组中表达上调(log2FC≥1,P<0.05),201个mRNA表达下调(log2FC≤-1,P<0.05)(图2)。
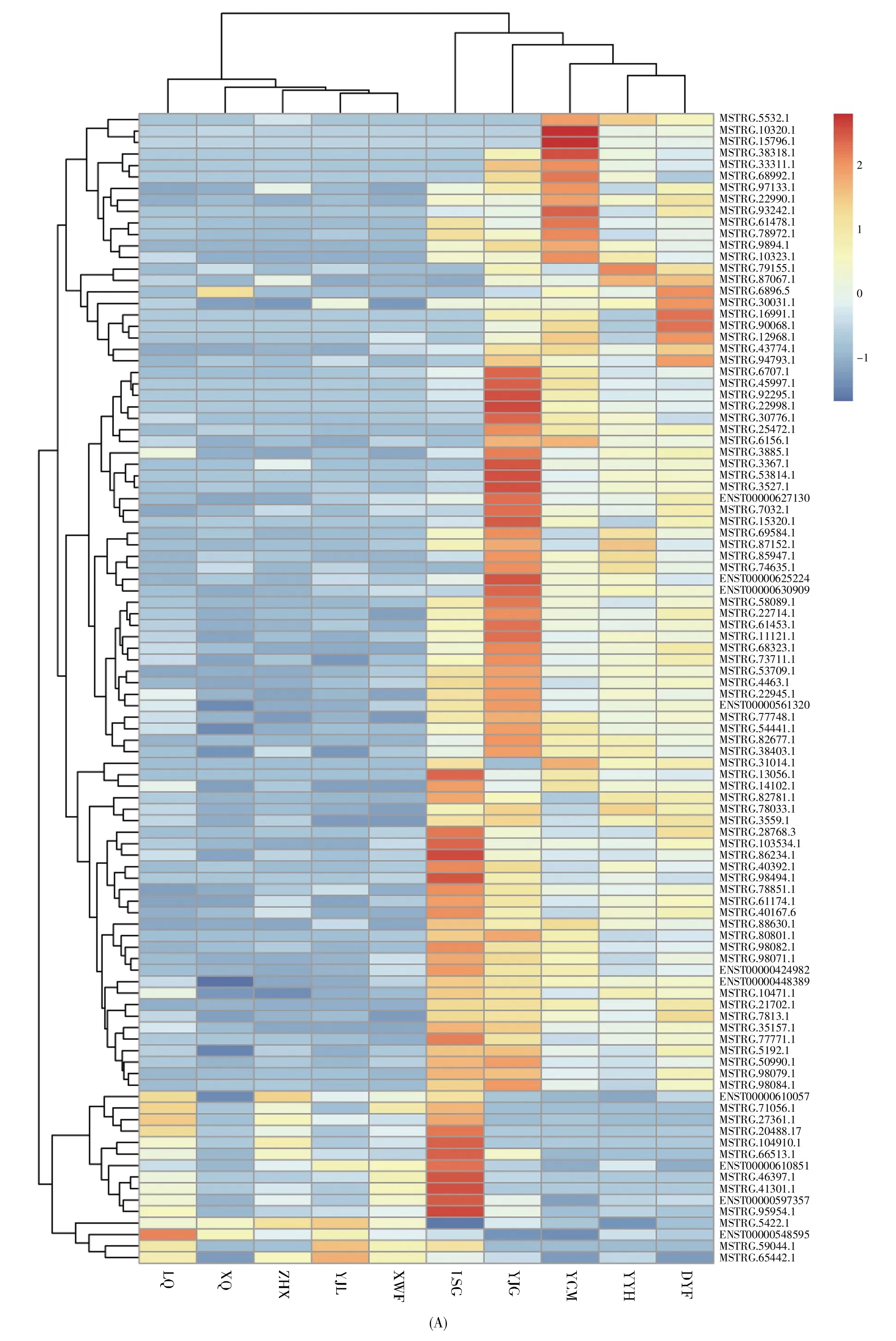

图1 HBV-ACLF组与ASC组的lncRNA差异表达谱(A)聚类热图。纵坐标代表前100个差异表达最显著的lncRNA,横坐标上LQ、XQ、ZHX、YJL和XWF为ASC组样本,LSG、YJG、YCM、YYH和DYF为HBV-ACLF组样本;(B)火山图。Fig.1 Differentially expressed lncRNAs between HBV-ACLF group and ASC group(A)The heat map.The ordinate represents the top 100 lncRNAs with the most significantly differential expression.The abscissa includes samples LQ,XQ,ZHX,YJL and XWF from the ASC group,and LSG,YJG,YCM,YYH and DYF from the HBV-ACLF group;(B)The volcano map.
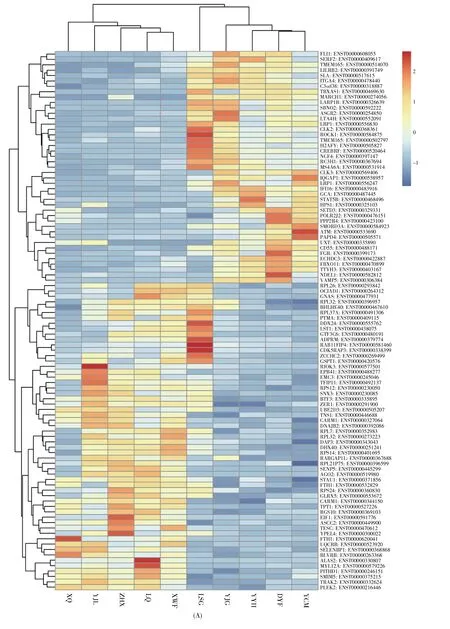
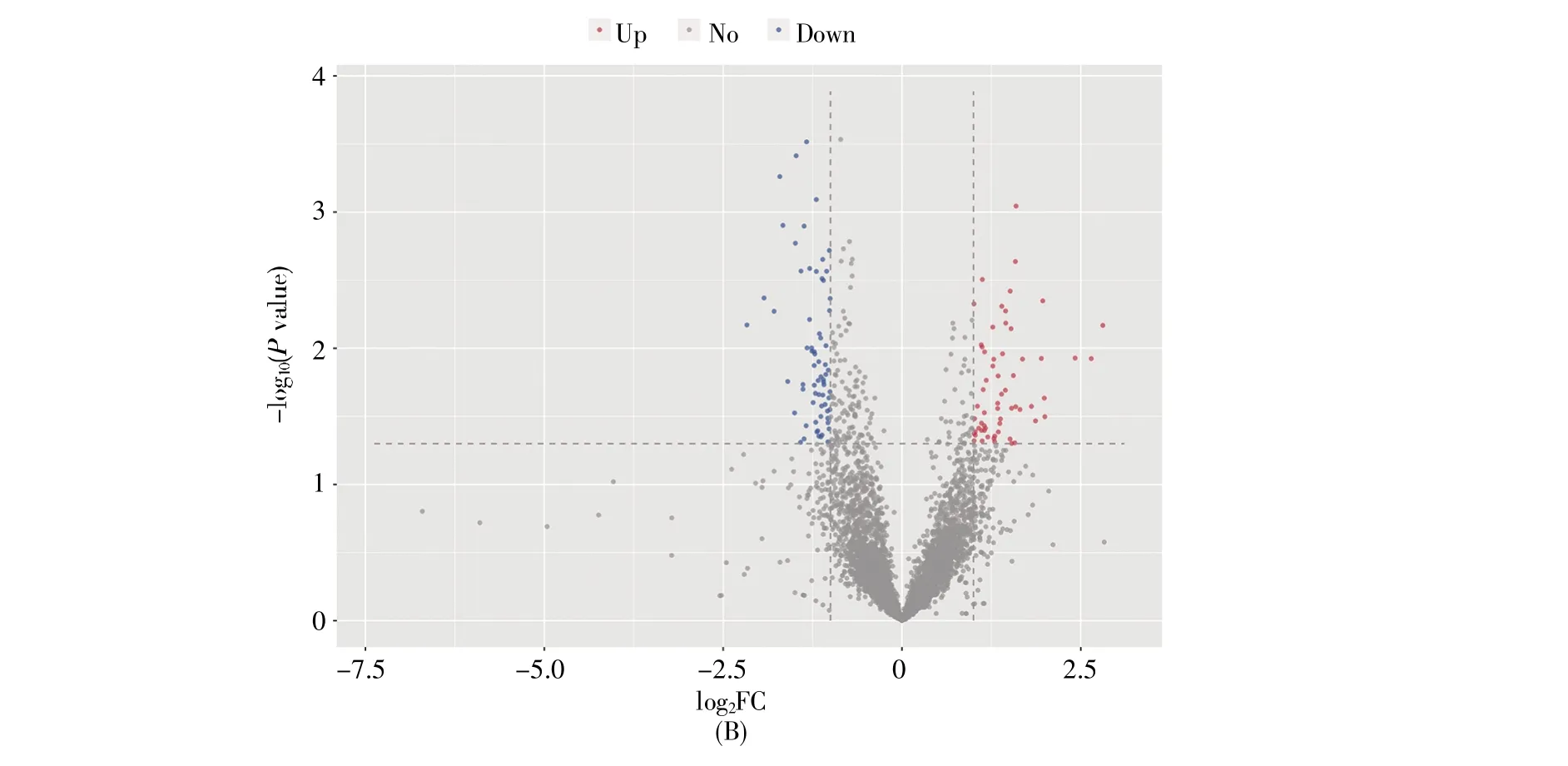
图2 HBV-ACLF组与ASC组的mRNA差异表达谱(A)聚类热图。纵坐标代表前100个差异表达最显著的mRNA,横坐标上LQ、XQ、ZHX、YJL和XWF为ASC组样本,LSG、YJG、YCM、YYH和DYF为HBV-ACLF组样本;(B)火山图。Fig.2 Differentially expressed mRNAs between HBV-ACLF group and ASC group(A)The heat map.The ordinate represents the top 100 mRNAs with the most significantly differential expression.The abscissa includes samples LQ,XQ,ZHX,YJL and XWF from the ASC group,and LSG,YJG,YCM,YYH and DYF from the HBV-ACLF group;(B)The volcano map.

表2 上调表达差异最显著的前10位lncRNATable 2 Top 10 lncRNAs with the most significantly up-regulated expression

表3 下调表达差异最显著的前10位lncRNATable 3 Top 10 lncRNAs with the most significantly down-regulated expression
2.3 GO功能注释和KEGG通路富集分析结果
测序分析已表明lncRNA在HBV-ACLF中表达失调。为进一步探究差异表达lncRNA的生物学功能,本研究对差异表达lncRNA的基因开展了GO功能注释分析,结果显示:差异表达lnc-RNA主要存在于细胞质、细胞核、胞质溶胶等细胞组分;具有蛋白质结合、聚(A)RNA结合和ATP结合等多种分子功能;主要参与小分子物质代谢、病毒复制、病毒过程、固有细胞免疫、细胞信号转导、lncRNA表达、病毒周期和病毒转录等生物过程(图3)。KEGG通路富集分析表明,差异表达lnc-RNA主要与核黄素代谢、类固醇激素生物合成、果糖和甘露糖代谢、卟啉和叶绿素代谢、叶酸生物合成、氨基酸和核苷酸代谢等通路有关(图4)。
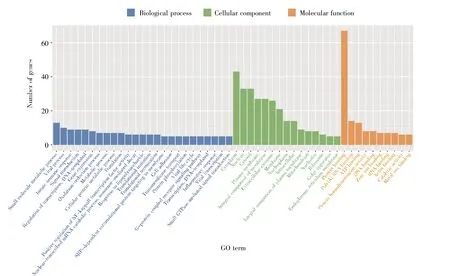
图3 差异表达lncRNA的GO功能注释分析柱状图Fig.3 Histogram of GO function annotation analysis of differentially expressed lncRNAs

图4 差异表达lncRNA的KEGG通路富集分析散点图“Rich factor”表示该KEGG通路上差异lncRNA数与总lncRNA数的比值。Fig.4 Scatter plot of KEGG analysis of differentially expressed lncRNAs“Rich factor”represents the ratio of the number of differential lncRNAs to the total number of lncRNAs on the KEGG.
2.4 lncRNA的cis预测
本研究共筛选出206对lncRNA-mRNA顺式调控子。在这206对调控子中,RP11-603J24.17、PIGC、RP11-504I13.3、MEGF9 为差异表达的 lnc-RNA(|log2FC|≥1,P<0.05),且 lncRNA PIGC 在HBV-ACLF中上调表达最显著(表2)。另外,lnc-RNA PIGC-mRNA ENST00000484368顺式调控对中的lncRNA及mRNA在HBV-ACLF中均显著差异表达(|log2FC|≥1,P<0.05)(表 4)。

表4 lncRNA-mRNA的cis预测Table 4 lncRNA-mRNA cis prediction
3 讨论
中国是乙肝大国,乙型肝炎病毒(hepatitis B virus,HBV)慢性感染是ACLF最主要的病因。ACLF主要表现为高黄疸和凝血功能障碍合并腹水或肝性脑病,28 d病死率高[11]。目前,ACLF的诊断界限尚未统一,欧洲以TBIL>12倍正常上限值作为诊断界限;亚太肝病研究学会(Asian-Pacific Association for the Study of the Liver,APASL)以TBIL>5倍正常值上限且国际标准化比率(international normalized ratio,INR)在1.5以上作为诊断界限;中国则以TBIL>10倍正常值上限且PTA<40%作为诊断界限[17]。根据中国现有的标准,当患者被诊断为HBV-ACLF时肝细胞已大量坏死,并已伴有其他多个器官功能衰竭,失去了治疗良机。
lncRNA因不具备编码蛋白质的功能,在发现的初期被认为不具备生物功能,是转录过程中的“分子噪音”。近年来,随着二代测序技术和生物信息学的发展,研究发现lncRNA在多种疾病中均发挥着重要调控作用。前列腺癌基因3(prostate cancer gene 3,PCA3)是前列腺癌中最具特异性的lncRNA,可以在尿液中被检测出来,与前列腺特异性抗原(prostate-specific antigen,PSA)不同,PCA3的表达水平不受患者年龄、炎症、创伤或活检的影响。PCA3作为检测前列腺癌的标志物已获得美国食品药物监督管理局(Food and Drug Administration,FDA)的批准[18]。lncRNA LINC00319在膀胱癌中发挥致癌作用,其在膀胱癌中的表达上调能促进肿瘤细胞的增殖及侵袭,很可能是膀胱癌潜在的治疗靶点[19]。lncRNA在肝癌中同样具有重要作用。Xie等[20]发现lncRNA PDIA3P1在肝细胞癌(hepatocellular carcinoma,HCC)中的表达水平明显高于其癌旁组织,且PDIA3P1的高表达能加速HCC的复发转移。目前,lncRNA在HBVACLF中的表达情况及功能尚不清楚。
本研究通过高通量测序技术检测HBV-ACLF组和ASC组的lncRNA表达谱,以|log2FC|≥1且P<0.05为标准筛选差异表达lncRNA。结果显示,与ASC组相比,HBV-ACLF患者中lncRNA的表达水平存在明显变化(图1,表2~3),共有131个lncRNA显著差异表达,其中114个上调,17个下调。lncRNA可充当竞争性内源RNA(competing endogenous RNA,ceRNA)分子,与mRNA竞争性结合miRNA,从而调节mRNA的表达。为了更进一步研究lncRNA在HBV-ACLF中的作用,本研究同时检测了mRNA在HBV-ACLF组及ASC组的表达水平(图2),结果发现共有338个mRNA在HBV-ACLF组中显著差异表达,其中201个mRNA下调,137个上调。因此,我们推测lncRNA可能通过作用于mRNA从而在HBV-ACLF的发生及进展过程中发挥作用。
差异表达lncRNA基因的GO分析显示,这些lncRNA主要定位于细胞质,具有与蛋白质结合等功能(图3)。lncRNA的功能主要由其细胞定位决定,胞质lncRNA参与蛋白质的翻译后修饰,调节mRNA的稳定性,或作为ceRNA发挥分子海绵的作用[21],这与上文lncRNA通过作用于mRNA发挥作用的推测是一致的。慢性HBV感染进展为HBV-ACLF的根本原因是HBV的复制,HBV的复制力在乙肝重症化的过程中具有重要意义。GO分析发现,差异表达lncRNA参与病毒周期、病毒转录、病毒DNA复制等生物过程(图3),因此,我们推测lncRNA通过影响肝脏内HBV的复制及细胞周期,使HBV在肝脏内的复制增强,从而在HBV-ACLF进展过程中发挥作用。HBV感染肝细胞后,自身免疫系统识别病毒表面蛋白,引发免疫清除反应,在清除病毒的同时破坏自身肝细胞,导致肝脏炎症反应。其中,T淋巴细胞介导的免疫损伤发挥着至关重要的作用,尤其是CD4+T淋巴细胞[22]。同时,固有免疫也发挥着必不可少的作用,肝脏内的巨噬细胞又称为库普弗细胞(Kupffer cell),当HBV感染肝细胞后,库普弗细胞被激活,其抗原提呈作用增强,并招募白细胞等炎性细胞聚集,参与肝脏的炎症反应[23]。本研究通过GO分析证实,在HBV-ACLF中差异表达的lncRNA参与固有细胞免疫过程(图3),因此,我们推测lnc-RNA从HBV感染本身及机体免疫反应两方面对HBV-ACLF进展发挥作用。KEGG通路富集分析发现,这些差异表达lncRNA主要富集于小分子物质代谢通路,包括核黄素、类固醇激素、果糖和甘露糖、卟啉和叶绿素、叶酸、氨基酸及核苷酸等物质的代谢过程(图4)。肝脏内几乎含有机体所有的酶类,各种代谢活动十分活跃,是机体新陈代谢的中心枢纽,是小分子物质代谢的主要场所。因此,差异表达lncRNA通过影响肝脏营养物质及非营养物质的代谢,在ACLF中发挥作用。
lncRNA可通过cis调控影响基因的表达。文中的cis预测结果显示,lncRNA PIGC能对距离其1 kb的PIGC基因发生顺式调控,影响mRNA ENST00000484368的表达(表4)。结合PIGC在HBV-ACLF中差异表达上调最显著,lncRNA PIGC很可能在HBV-ACLF中起着重要作用。磷脂酰肌醇聚糖C(phosphatidylinositol glycan C,PIGC)是磷脂酰肌醇聚糖(phosphatidylinositol glycan,PIC)家族中的一员,参与糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)的生物合成,GPI能将蛋白质锚定到质膜上,PIGC能影响白细胞上GPI锚定蛋白的表达[24]。有研究报道,PIGC基因的突变与智力障碍及癫痫相关[24~25]。目前,关于PIGC的研究较少,尚未发现PIGC基因在HBV-ACLF中的研究,我们后期拟进一步研究PIGC基因在HBVACLF中的具体作用机制。
综上所述,本研究首次通过高通量测序分析对HBV-ACLF和ASC样本进行研究,揭示了HBVACLF患者中lncRNA及mRNA的表达情况,并通过GO分析及KEGG分析表明lncRNA可能通过影响病毒感染本身、自身免疫反应以及小分子物质代谢在HBV-ACLF中发挥作用。其中,lnc-RNA PIGC在HBV-ACLF组上调表达最显著,且能顺式调控mRNA ENST00000484368的表达,因此lncRNA PIGC很可能在HBV-ACLF中具有重要作用,有望成为HBV-ACLF的潜在分子标志物或治疗靶点,但这需要进一步的实验验证。
