氢水对高脂高糖饲料喂养大鼠主要脏器和肝损伤的调节作用
2021-08-11李卫霞陈剑华郭旭丽王雪玲陈天山刘晓霞
李卫霞,陈剑华,郭旭丽,王雪玲,陈天山,刘晓霞*
(1.河北工程大学医学院,中国河北邯郸056038;2.中国船舶重工集团公司第七一八研究所,中国河北邯郸050038;3.河北工程大学附属医院,中国河北邯郸050038)
氢水(hydrogen water,HW),指在不改变原水理化性状的条件下,通过物理或其他方法加入(溶入)氢气而制得的水[1]。研究表明,当水中氢气质量浓度在1.0 μg/mL以上时,能发挥选择性抗氧化[2]、抵御炎症和细胞凋亡等作用[3~4],从而保护细胞和组织免受氧化损伤,对糖尿病[5]、癌症[6]、心肌损伤[7]以及炎症[8]等具有治疗和预防作用。随着国内外氢水行业的快速发展,氢水的功效研究和医学应用也逐渐深入。虽然目前认为氢水具有多种治疗作用,但作为临床药物使用,其对机体主要脏器的影响及作用机制仍不清楚,需进行系统的研究。
本研究通过灌胃方式给高脂高糖饮食大鼠饮用一定量氢水,观察氢水对高脂高糖饲料喂养组大鼠主要脏器指数、肝脏组织结构、血清转氨酶以及抗氧化指标的影响,分析氢水对大鼠主要脏器的毒副作用以及对肝损伤的调节作用。
1 材料与方法
1.1 材料与仪器
本研究使用的仪器主要有BP-100A全自动大小鼠无创血压测量仪(成都泰盟软件有限公司)、Agilent-7890A气相色谱仪(安捷伦公司,美国)、HITACHI 7170A全自动生化分析仪(日立公司,日本)、UV1102紫外-可见分光光度计(上海天美科学仪器有限公司)以及iMark全自动酶标仪(Bio-Rad公司,美国)。
血清超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)、总抗氧化能力(total antioxidant capacity,T-AOC)、谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)、谷丙转氨酶(glutamicpyruvic transaminase,GPT)等检测试剂盒购自南京建成生物工程有限公司,苏木精-伊红染色试剂盒购自碧云天生物技术有限公司。
氢水(H2质量浓度为1.25 μg/mL)源自中国船舶重工集团公司第七一八研究所,基础饲料购自河北医科大学实验动物中心,高脂高糖饲料购自北京博爱港商贸中心(主要组分为65%基础饲料、10%猪油、20%蔗糖、2.5%胆固醇、1%胆酸钠和1.5%鸡蛋麻油花生混合剂)。
1.2 实验动物
6~8周健康雄性SD大鼠40只,体重(200±20)g,购自河北医科大学实验动物中心(动物批号:1702254)。SD大鼠在室温22~26℃、相对湿度50%~60%的环境下饲养。
1.3 伦理学处理原则
所有动物实验均经过河北工程大学医学伦理委员会同意,实验方法符合动物医学伦理管理规范。
1.4 实验方法
1.4.1 实验动物分组和处理
SD大鼠适应性基础喂养两周后称重,并随机分为4组:高脂高糖饲料+HW组、高脂高糖饲料+ddH2O组、基础饲料+HW组、基础饲料+ddH2O组,每组10只。参考王赞等[7]的方法,各组大鼠分别采用氢水或ddH2O灌胃12周,剂量为1.0 mL/100 g体重,早晚各1次,其余时间自由饮水摄食。每天观察大鼠体重、毛色、饮食、排便及日常活动状况,并根据体重调整灌胃剂量。
1.4.2 脏器指数检测
大鼠灌胃12周后,断颈处死,采集肝脏、心脏、脾脏、肾脏、胸腺组织,并称重,按下述公式计算脏器指数:脏器指数=脏器质量/体重×100%。
1.4.3 肝脏组织病理检测
用生理盐水冲洗采集的肝脏组织,并切割成1 cm×1 cm的组织块。组织块经多聚甲醛固定后,进行常规石蜡切片和苏木精-伊红(HE)染色,最后在显微镜下观察各组大鼠肝组织的病理改变。
1.4.4 血清转氨酶活性检测
大鼠灌胃12周后,断颈处死,摘眼球法采集血液,室温静置2 h,2 500 r/min离心10 min,分离血清。血清中GOT和GPT的检测严格按照试剂盒说明书操作,采用全自动生化分析仪测定活性。
1.4.5 血清抗氧化指标检测
血清中 SOD、GSH-Px、MDA、T-AOC、CAT 的检测严格按照南京建成生物工程有限公司提供的试剂盒说明书操作,采用紫外-可见分光光度计测定样本吸光度,并参照说明书计算SOD、GSHPx、T-AOC、CAT活性和 MDA 含量。
1.4.6 统计学方法
数据采用GraphPad 5.0统计软件进行处理分析,数据结果以平均值±标准差(±s)表示,组间的样本比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 饮用氢水对大鼠日常状况的影响
采用氢水灌胃12周,观察大鼠毛色、饮食、排便及日常活动状况,结果显示:灌胃期间各组大鼠毛色均光滑润泽,精神活泼;高脂高糖饲料喂养组大鼠的饮食量在前3周稍低于基础饲料喂养组,之后各组大鼠的进食量、排便及日常活动状况无明显差异。
2.2 饮用氢水对大鼠体重的影响
大鼠灌胃12周,每天称量体重,统计结果显示:各组大鼠体重均呈稳定增长趋势,且基础饲料+ddH2O与基础饲料+HW喂养组大鼠的体重无显著差异(n=10,P>0.05);喂养6周后,高脂高糖饲料+ddH2O喂养组大鼠的体重增幅明显上升,且第8~12周的体重显著高于基础饲料组及高脂高糖饲料+HW喂养组(n=10,P<0.05)(图1)。
2.3 饮用氢水对大鼠主要脏器的影响
灌胃12周后,观察各组大鼠脾脏及胸腺指数的变化,结果显示:与基础饲料+ddH2O组大鼠相比,基础饲料+HW喂养组大鼠的脾脏指数提高53.85%,差异具有显著性(n=10,P<0.05);与高脂高糖饲料+ddH2O组大鼠相比,高脂高糖饲料+HW组大鼠的脾脏指数提高66.67%,差异具有显著性(n=10,P<0.05)(表1);与基础饲料+ddH2O组大鼠相比,高脂高糖饲料+HW喂养组大鼠的胸腺指数无显著性差异(n=10,P>0.05),而高脂高糖饲料+ddH2O组大鼠的胸腺指数降低40.00%,差异具有显著性(n=10,P<0.05)(表1)。以上数据表明饮用氢水能降低高脂高糖饮食对大鼠免疫系统造成的潜在损伤,从而保护免疫系统功能。
观察各组大鼠肝脏的外观,结果显示:基础饲料喂养组大鼠肝脏色泽红润,外表光滑,包膜结构清晰完整;高脂高糖饲料+ddH2O喂养组大鼠肝脏颜色发白,包膜结构不完整;高脂高糖饲料+HW喂养组大鼠的肝脏颜色、外观与基础饲料喂养组大鼠无明显差异(图2)。进一步对各组大鼠的肝脏指数进行统计分析,结果显示:与基础饲料+ddH2O组大鼠相比,高脂高糖饲料+ddH2O组大鼠的肝脏质量增加18.36%,肝脏指数提高13.67%,差异具有显著性(n=10,P<0.05);相比于高脂高糖饲料+ddH2O组大鼠,高脂高糖饲料+HW组大鼠的肝脏质量降低17.69%,肝脏指数降低23.31%,差异均具有显著性(n=10,P<0.05)(表1)。这些数据表明饮用氢水能缓解高脂高糖饮食对大鼠肝脏造成的损伤,从而保护肝脏功能。
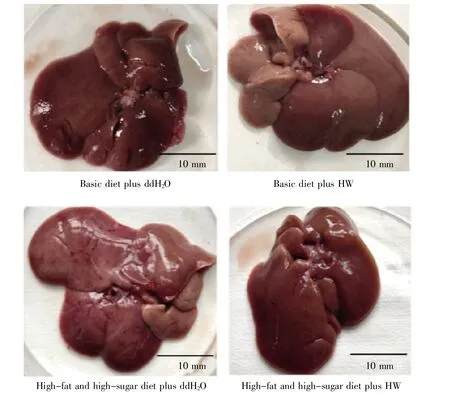
图2 各组大鼠肝脏颜色及大小比较Fig.2 Comparison of the liver color and size in rats of each group
此外,各组大鼠心脏和肾脏的外观、质量及脏器指数分析结果显示:与基础饲料+ddH2O组大鼠相比,基础饲料+HW组与高脂高糖饲料+HW组大鼠肾脏和心脏的外观、颜色均未发现明显变化,相应的脏器质量及脏器指数亦无显著差异(n=10,P>0.05)(表1),表明饮用氢水对大鼠心脏和肾脏无显著影响。
表1 各组大鼠脏器质量及指数Table 1 Organ mass and index in rats of each group(±s)

表1 各组大鼠脏器质量及指数Table 1 Organ mass and index in rats of each group(±s)
注:与基础饲料+ddH2O组大鼠相比,aP<0.05;与高脂高糖饲料+ddH2O组大鼠相比,bP<0.05(n=10)。Notes:aP<0.05,compared with basic diet plus ddH2O group;bP<0.05,compared with high-fat and high-sugar diet plus ddH2O group(n=10).
Groups Thymus mass/g Thymus index/(%)Spleen mass/g Spleen index/(%)Liver mass/g Liver index/(%)Left kidney mass/g Left kidney index/(%)Right kidney mass/g Right kidney index/(%)Heart mass/g Heart index/(%)Basic diet plus ddH2O 0.25±0.07 0.10±0.03 0.54±0.11 0.13±0.07 10.46±0.32 2.34±0.49 1.14±0.25 0.30±0.04 1.04±0.12 0.28±0.14 1.10±0.32 0.27±0.06 Basic diet plus HW 0.23±0.08 0.08±0.06 0.69±0.21 0.20±0.02a 9.69±0.23 2.38±0.56 1.39±0.18 0.37±0.08 1.19±0.31 0.30±0.17 1.15±0.27 0.32±0.10 High-fat and high-sugar diet plus ddH2O 0.16±0.06a 0.06±0.03a 0.46±0.11 0.09±0.02 12.38±0.33a 2.66±0.16a 0.96±0.23 0.23±0.04 1.10±0.24 0.25±0.13 1.04±0.12 0.26±0.14 High-fat and high-sugar diet plus HW 0.21±0.05 0.08±0.04 0.60±0.14 0.15±0.03b 10.19±0.17b 2.04±0.28b 1.08±0.18 0.21±0.10 1.02±0.21 0.22±0.08 1.09±0.15 0.27±0.15
2.4 饮用氢水对大鼠肝脏组织结构的影响
大鼠灌胃12周后,取肝脏组织进行病理显微观察,结果显示:基础饲料喂养组大鼠肝小叶结构清晰,肝细胞索排列整齐,细胞无明显病变,核结构清晰;高脂高糖饲料+ddH2O组大鼠肝小叶分界不清,肝细胞索结构紊乱,肝组织出现明显的空泡样变性;高脂高糖饲料+HW组大鼠肝细胞索排列整齐,细胞着色均匀,组织未见明显空泡现象,与基础饲料喂养组大鼠无显著性差异(图3)。以上信息进一步表明饮用氢水对高脂高糖饮食诱导的大鼠肝损伤有一定保护作用。
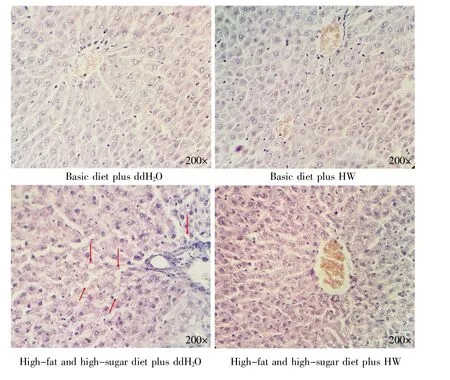
图3 各组大鼠肝脏组织的切片观察(HE染色)图中箭头所指可见肝细胞索结构紊乱,肝组织有明显空泡样变性。Fig.3 HE staining of rat liver tissue sectionsThe arrows point the disordered structure of the hepatocellular cord and the apparent vacuolar degeneration in liver tissue.
2.5 饮用氢水对大鼠血清转氨酶的影响
大鼠喂养至12周后,禁食12 h,摘眼球采血,收集血清,检测血清中GOT和GPT的活性,结果显示:与基础饲料+ddH2O喂养组相比,基础饲料+HW喂养组大鼠血清中GOT和GPT的活性分别降低9.71%和15.81%,但差异均不具有显著性(n=10,P>0.05);与基础饲料+ddH2O组大鼠相比,高脂高糖饲料+ddH2O组大鼠血清GOT活性提高77.56%,差异具有极显著性(n=10,P<0.01);与高脂高糖饲料+ddH2O组大鼠相比,高脂高糖饲料+HW组大鼠GPT、GOT活性分别降低27.04%和44.10%,差异均具有极显著性(n=10,P<0.01);高脂高糖饲料+HW喂养组与基础饲料+ddH2O喂养组的转氨酶活性无显著性差异(n=10,P>0.05)(表2)。以上数据提示:饮用氢水能降低大鼠血清氨基转移酶的活力,在一定程度上可缓解高脂高糖饮食对肝脏的损伤作用。
表2 各组大鼠空腹血清GOT和GPT的活性比较Table 2 Comparison of fasting serum GOT and GPT activities in rats of each group(±s)

表2 各组大鼠空腹血清GOT和GPT的活性比较Table 2 Comparison of fasting serum GOT and GPT activities in rats of each group(±s)
注:与基础饲料+ddH2O组大鼠相比,aaP<0.01;与高脂高糖饲料+ddH2O组大鼠相比,bbP<0.01(n=10)。Notes:aaP<0.01,compared with basic diet plus ddH2O group;bbP<0.01,compared with high-fat and high-sugar diet plus ddH2O group(n=10).
Groups Basic diet plus ddH2O Basic diet plus HW High-fat and high-sugar diet plus ddH2O High-fat and high-sugar diet plus HW Reference range[4]GPT/(U·L-1)68.00±20.05 57.25±16.50 79.50±12.50 58.00±15.50bb 33~98 GOT/(U·L-1)182.75±47.50 165.00±59.50 324.50±72.50aa 181.41±32.50bb 69~322
2.6 饮用氢水对大鼠血清抗氧化指标的影响
大鼠灌胃12周并禁食12 h后,摘眼球采血,收集血清,检测各组大鼠血清 T-AOC、SOD、GSH-Px、CAT活力以及MDA含量,结果显示:与基础饲料+ddH2O组大鼠相比,基础饲料+HW组大鼠血清T-AOC、SOD、CAT的活力水平分别升高22.85%、29.03%和60.80%,差异均具有显著性(n=10,P<0.05),血清MDA的含量降低36.25%,差异具有极显著性(n=10,P<0.01),而高脂高糖饲料+ddH2O组大鼠血清T-AOC、SOD、GSH-Px的活力分别降低35.62%、29.30%和35.25%,差异具有显著性(n=10,P<0.05),同时MDA含量升高27.31%,差异具有极显著性(n=10,P<0.01);与高脂高糖饲料+ddH2O组相比,高脂高糖饲料+HW组大鼠血清SOD、GSH-Px、CAT的活力分别升高45.07%、61.11%和89.94%,差异具有极显著性(n=10,P<0.01),而MDA含量则降低31.00%(n=10,P<0.05),且与基础饲料+ddH2O组无显著差异(n=10,P>0.05)(表3)。上述数据表明,饮用氢水能显著提高高脂高糖饲料喂养大鼠的抗氧化能力,降低脂质过氧化物含量。
3 讨论
氢作为一种还原剂,可选择性地清除活性氧,对癌症、糖尿病、非酒精性脂肪肝[9]、放射性皮肤损伤[10]等各类疾病均有防护作用。本研究发现,饮用氢水对大鼠体重、饮食、排便等日常生理及活动状况均无显著影响,表明氢水对大鼠基本体征和生理状况无显著毒副作用,该结果为氢水的应用安全性提供了实验依据。
脏器质量、脏器指数作为动物实验中常用的重要基础数据,在一定程度上可以反映药物对脏器的影响或损伤程度[11]。胸腺和脾脏作为重要的免疫系统器官,在细胞免疫和体液免疫中有着十分重要的意义,根据实验动物脾脏和胸腺指数的变化可以判断药物对动物免疫系统的影响程度[12]。本研究发现,饮用氢水能提高大鼠脾脏和胸腺指数(表1),提示其在一定程度上能改善大鼠免疫系统,并缓解高脂高糖饮食对免疫系统造成的损伤。
夏超群等[13]研究发现,长期高脂高糖饮食会造成肝脏指数的增加,对肝功能造成损伤。本研究证实,饮用氢水能降低肝脏指数,抑制肝组织空泡样变性,从而缓解高脂高糖饮食对大鼠肝脏造成的损伤。血清GOT和GPT的水平对肝脏疾病及其发病程度的诊断具有重要意义。徐旭东等[14]研究发现,当肝细胞受到损伤时,相关细胞器遭到破坏,GOT或GPT进入血液,导致血清中GOT、GPT水平升高。本文研究证实,饮用氢水能够降低高脂高糖喂养大鼠血清GPT和GOT的活力(表2),在一定程度上可缓解高脂高糖饮食造成的肝损伤,从而保护肝脏功能。张景云等[9]研究报道,氢水能够帮助肝脏清除炎症坏死细胞,可有效清除恶性自由基,显著抑制脂质过氧化,减少肝细胞氧化损伤。本研究进一步证实,饮用氢水能提高高脂高糖大鼠血清抗氧化酶活力(表3),推测氢水可通过提高机体的抗氧化作用抑制高脂高糖饮食造成的肝损伤。
表3 各组大鼠血清抗氧化指标的比较Table 3 Comparison of serum antioxidant indexes of rats in each group(±s)

表3 各组大鼠血清抗氧化指标的比较Table 3 Comparison of serum antioxidant indexes of rats in each group(±s)
注:与基础饲料+ddH2O组大鼠相比,aP<0.05,aaP<0.01;与高脂高糖饲料+ddH2O组大鼠相比,bP<0.05,bbP<0.01(n=10)。Notes:aP<0.05 andaaP<0.01,compared with basic diet plus ddH2O group;bP<0.05 andbbP<0.01,compared with high-fat and high-sugar diet plus ddH2O group(n=10).
Groups T-AOC/(U·mL-1)SOD/(U·mL-1)GSH-Px/U CAT/(U·mL-1)MDA/(nmol·mL-1)Basic diet plus ddH2O 43.29±4.94 317.48±17.21 1.39±0.30 9.26±2.10 83.08±16.63 Basic diet plus HW 53.18±4.72a 409.66±62.10a 1.69±0.40 14.89±3.67a 52.96±8.66aa High-fat and high-sugar diet plus ddH2O 27.87±3.09a 224.45±54.70a 0.90±0.23a 6.36±1.62 105.77±17.83aa High-fat and high-sugar diet plus HW 37.43±7.07 325.61±44.31bb 1.45±0.31bb 12.08±2.57bb 72.98±6.91b
氢水作为一种可再生、高效的新型抗氧化剂,具有广阔的应用前景。本研究进一步证明氢水在提高机体抗氧化作用水平、保肝护肝方面具有一定的功效,但其对高脂高糖饮食造成肝损伤保护作用的分子机制尚不明确,有待进一步深入研究。
利益声明:本文全体作者均声明不存在利益冲突。
