不同抗盐性苹果砧木对盐胁迫的生理响应
2021-08-11张夏燚吴玉霞张仲兴王双成王延秀
张 德,张 瑞,张夏燚,吴玉霞,赵 婷,张仲兴,王双成,王延秀
(甘肃农业大学园艺学院,甘肃 兰州 730070)
土壤盐渍化是世界范围的资源和生态问题,严重威胁农作物的生长[1]。中国西北黄土高原为苹果栽培的优势产区,但由于土壤盐渍化以及持续应用化肥导致次生盐渍化严重,限制了该区域苹果产业的发展[2]。垂丝海棠(MalushallianaKoehne)原产于甘肃河西走廊干旱、盐碱生境,是一种耐盐碱的苹果砧木资源。本项目组基于对不同生境垂丝海棠的耐盐性比较试验,获得高抗盐碱系‘9-1-6’[3-4],但其高抗盐机理仍不明确。山定子(MalusbaccataBorkh)原产于东北,是苹果生产上常用的砧木,耐寒、耐旱,但不耐盐碱[5]。
围绕农作物、蔬菜或耐盐模式植物的盐胁迫生理研究已有报道[6],且一致认为盐胁迫下植物通常受到渗透胁迫、离子胁迫和氧化损伤3种危害,从而导致膜透性改变、生理代谢紊乱和有毒物质积累,引起植物生长发育和形态建成改变[7-8]。研究表明,盐胁迫破坏包括光合系统、叶绿素荧光、渗透调节物质和抗氧化防御机制等生理过程[9]。Flexas等[10]研究认为气孔关闭是盐胁迫下降低CO2同化能力并导致光合效率下降的主要因素。孙璐等[11]在高粱的研究中得出,盐胁迫破坏了光系统Ⅱ反应中心,使PSⅡ原初光能转换效率受到抑制,需要启动热耗散机制保护光合系统。长期逆境条件下,植物自身会合成大量渗透调节物质和一些抗氧化酶来提高植物的抗逆性[12]。马铃薯中CAT、POD和SOD等抗氧化酶活性的提高增强了其抵御盐胁迫的能力[13]。NaCl胁迫下,苹果属植物八棱海棠、湖北海棠和山荆子的叶片游离脯氨酸含量增加[14],王佺珍等[15]研究表明脯氨酸积累与植物耐渗透胁迫存在正相关。前人的研究多集中于不同材料的抗盐特性或耐盐性比较,而对于不同耐性材料之间的生理机制差异少见报道。本研究以抗性明显不同的两种苹果砧木垂丝海棠‘9-1-6’(本课题组筛选)和山定子为材料,测定其光合荧光对盐胁迫的响应,探讨抗盐性不同的苹果砧木抗氧化酶活性和渗透调节物质含量的差异,以期丰富苹果砧木抗盐生理的内容,试验结果可望为优质苹果砧木的开发提供理论依据。
1 材料与方法
1.1 材 料
2020年1月将垂丝海棠‘9-1-6’(MalushallianaKoehne,抗盐性强)和山定子(MalusbaccataBorkh,抗盐性弱)种子用0.2%高锰酸钾消毒30 min,自来水冲洗12 h,置于4℃下沙藏35 d。3月中旬选择发芽一致的种子播于含有育苗基质的塑料花盆(11.2 cm × 16.8 cm,含1 kg基质)中,置于甘肃农业大学避雨棚(N 36°1′-37°9′,E 106°21′-107°44′)中,统一管理,定期除草浇水。幼苗生长至4片真叶时,移入大小及营养土重量相同的花盆中,每盆1株。
1.2 盐胁迫处理
2020年5月20日选取株高相似、叶片数相近的垂丝海棠‘9-1-6’和山定子各40株进行盐胁迫处理。试验设对照(CK,pH 6.8)和盐胁迫(SS,pH 7.0)两种处理,每处理5次重复,每重复4盆。根据预试验,选择100 mmol·L-1为胁迫处理浓度。CK组浇Hoagland营养液,处理组浇Hoagland营养液+100 mmol·L-1NaCl溶液。为避免盐激反应,处理浓度按50 mmol·L-1每天递增,达到设定浓度后开始计算胁迫时间。间隔3 d,于17∶00—18∶00浇灌500 mL营养液。胁迫处理开始第1次取样时间为2020年5月20日07∶00,依次在处理第3、40 d时选取位于植株中上部的功能叶进行各项指标测定,并拍摄形态表型照片。
1.3 测定指标及方法
1.3.1 光合特性指标 于晴天09∶00—11∶00,选取同一节位的功能叶,用光合仪(Li-6400,LI-COR公司,美国)测定净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci),重复5次。采用IMAGING-PAM叶绿素荧光仪和Imaging WinGegE软件(Walz,Effeltrich,德国)测定初始荧光(F0)、最大光化学效率(Fv/Fm)、表观光合电子传递速率(ETR)、PSII实际光化学效率(ΦPSII)、调节性能量耗散(Y(NPQ))、非调节性能量耗散(Y(NO))、光化学猝灭系数(qP)和非光化学荧光淬灭系数(qN)。
测定光合荧光参数后,采集叶片,擦去表面污物并去掉叶脉,-80℃保存待测其他指标。
1.3.2 抗氧化酶和渗透调节物质 参照张春梅[16]的方法测定H2O2含量及SOD和POD活性;采用参考文献[17-18]中方法测定APX活性、AsA和蔗糖含量;游离Pro含量用酸性茚三酮法测定[19];山梨醇含量测定采用Burg等[20]的方法。
1.4 数据处理
采用SPSS 22.0软件进行单因素Duncan检验方差分析,使用Origin 9.0软件制图,Imaging WinGegE软件选取荧光图片。
2 结果与分析
2.1 盐胁迫下垂丝海棠‘9-1-6’和山定子叶片的表型变化
随着胁迫的持续,两种砧木叶片发生不同程度的变化(图1)。胁迫3 d时,抗盐性砧木‘9-1-6’叶片无明显变化,而盐敏感型砧木山定子老叶失水并出现黄化、叶缘干枯。胁迫40 d,两种砧木叶片均出现干枯,但‘9-1-6’叶片仅边缘出现干枯斑点,而山定子叶片叶缘变褐,枯萎,部分叶片死亡脱落。

注:CS—垂丝海棠‘9-1-6’;SDZ—山定子;SS—盐胁迫。下同。Note: CS— Malus halliana ‘9-1-6’;SDZ—Malus baccata; SS—salt stress. The same below.图1 盐胁迫下垂丝海棠‘9-1-6’和山定子叶片表型的变化Fig.1 Changes of salt stress in Malus halliana and Malus baccata leaf phenotype
2.2 盐胁迫对垂丝海棠‘9-1-6’和山定子叶片光合参数的影响
随着胁迫时间的延长,两种砧木叶片Pn、Gs、Tr均降低,而Ci升高(图2)。胁迫3 d后,两种砧木叶片Pn、Gs和Tr均显著低于CK,但垂丝海棠‘9-1-6’叶片Pn、Gs和Tr显著高于山定子。胁迫40 d,两种砧木叶片Pn、Gs、Tr降至最低,与CK相比,Pn的降幅为58.4%、91.9%,Gs为57.9%、82.4%,垂丝海棠‘9-1-6’降幅显著小于山定子;Tr下降后分别为0.47 mmol·m-2·s-1和0.5 mmol·m-2·s-1,无显著差异;两种砧木叶片Ci胁迫40 d后均显著高于CK,分别为CK的1.69、2.13倍,且垂丝海棠‘9-1-6’叶片的Ci显著低于山定子,仅为其76.6%。
2.3 盐胁迫对垂丝海棠‘9-1-6’和山定子荧光参数的影响
2.3.1 盐胁迫对垂丝海棠‘9-1-6’和山定子F0、Fv/Fm、ETR、ΦPSII的影响 由图3可以看出,胁迫0 d时,垂丝海棠‘9-1-6’叶片的F0显著高于山定子,为其1.26倍,且垂丝海棠‘9-1-6’叶片F0在短期胁迫下无显著变化,而山定子叶片的F0随着胁迫的持续呈不断上升的趋势。胁迫40 d时,与CK相比,两种砧木叶片F0分别上升了22.8%和56.9%。
随着胁迫的持续,垂丝海棠‘9-1-6’和山定子叶片Fv/Fm和ΦPSII呈下降趋势。其中,垂丝海棠‘9-1-6’叶片Fv/Fm和ΦPSII短期胁迫下无显著变化,而山定子显著低于CK。胁迫40 d时,两种砧木叶片的Fv/Fm和ΦPSII均显著低于CK,相比CK,分别下降了12.9%、83.9%和67.0%、84.2%,垂丝海棠‘9-1-6’的降幅显著小于山定子;垂丝海棠‘9-1-6’叶片ETR先升后降,而山定子叶片ETR不断下降,40 d时,垂丝海棠‘9-1-6’叶片ETR显著高于山定子叶片,为其3.7倍,与CK相比,两种砧木叶片ETR分别下降了66.5%和91.7%。
2.3.2 盐胁迫对垂丝海棠‘9-1-6’和山定子Y(NPQ)、Y(NO)、qP和qN的影响 如图4、图5,随着胁迫的持续,垂丝海棠‘9-1-6’叶片Y(NPQ)、Y(NO)和qN呈上升的趋势,而qP呈下降趋势;山定子叶片Y(NPQ)呈先升后降趋势,Y(NO)、qN和qP变化趋势与垂丝海棠‘9-1-6’一致,但不同抗性的砧木变幅不同。胁迫0 d时,‘9-1-6’叶片的qN显著低于山定子,为其83.5%。胁迫至3 d,两种砧木叶片Y(NPQ)和qN均显著高于CK,山定子叶片Y(NO)显著高于CK。胁迫40 d时,垂丝海棠‘9-1-6’叶片Y(NPQ)显著高于CK和山定子,分别为CK和山定子的258%和320%;两种砧木叶片Y(NO)和qN分别为CK的2.27、3.88倍和1.80、1.81倍,qP分别为CK的0.50、0.25倍,山定子叶片Y(NO)和qN显著高于垂丝海棠‘9-1-6’,而qP显著低于垂丝海棠‘9-1-6’。
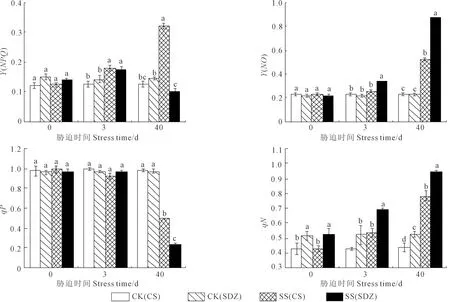
图4 盐胁迫对垂丝海棠‘9-1-6’和山定子叶片Y(NPQ)、Y(NO)、qP和qN的影响Fig.4 Effects of salt stress on Y(NPQ)、Y(NO)、qP and qN of M. halliana and M. baccata leaves

图5 盐胁迫下垂丝海棠‘9-1-6’(左)和山定子(右)叶片F0、ΦPSII、Y(NPQ)、Y(NO)、qP和qN的变化Fig.5 Changes of salt stress on F0、ΦPSII、Y(NPQ)、Y(NO)、qP and qN of M. halliana (left) and M. baccata (right) leaves
2.4 盐胁迫对垂丝海棠‘9-1-6’和山定子叶片抗氧化系统的影响
图6显示,随着胁迫的持续,两种砧木叶片APX、SOD和POD活性呈先升后降趋势,而ASA和H2O2呈不断上升的趋势。胁迫0 d时,垂丝海棠‘9-1-6’叶片POD活性和ASA含量显著高于山定子。胁迫3 d后,两种砧木叶片APX活性和ASA含量均显著高于CK,山定子叶片H2O2含量显著高于CK和垂丝海棠‘9-1-6’。胁迫40 d时,垂丝海棠‘9-1-6’叶片APX、SOD和POD活性均显著高于山定子,与CK相比,两种砧木叶片APX活性升幅分别为72.2%和48.6%,SOD和POD活性降幅分别为20.1%、38.5%和20.5%、28.9%;垂丝海棠‘9-1-6’叶片ASA含量显著高于CK和山定子,分别为CK和山定子的1.50、1.17倍;垂丝海棠‘9-1-6’叶片H2O2含量与CK无显著差异,但显著低于山定子,仅为其83%。
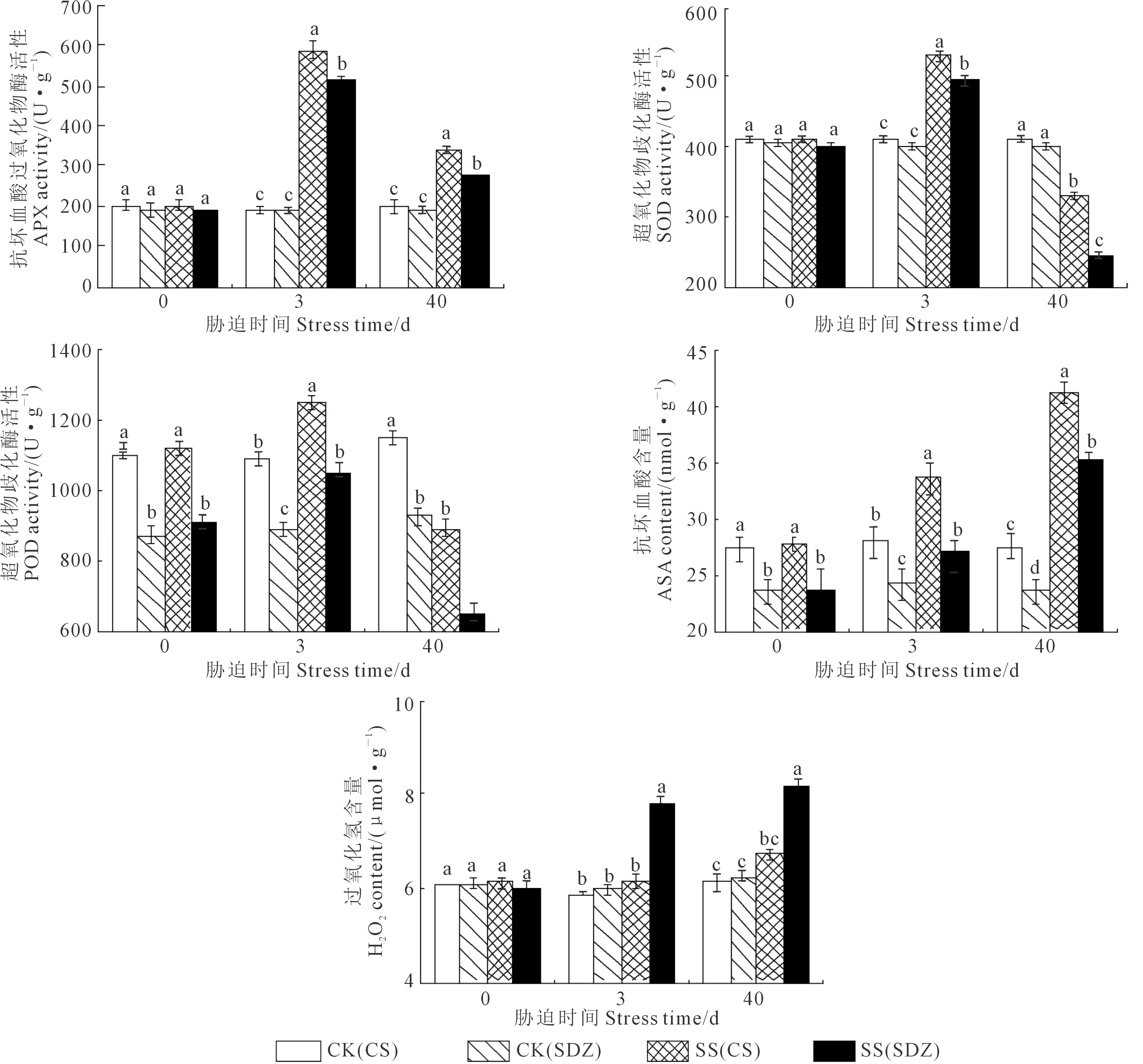
图6 盐胁迫对垂丝海棠‘9-1-6’和山定子叶片APX、SOD、POD活性及ASA、H2O2含量的影响Fig.6 Effects of salt stress on the activities of APX, SOD, POD and the contents ofASA、H2O2 of M. halliana and M. baccata leaves
2.5 盐胁迫对垂丝海棠‘9-1-6’和山定子叶片渗透调节物质含量的影响
由图7可知,随着胁迫的持续,两种砧木叶片中蔗糖和山梨醇含量呈不断上升的趋势;垂丝海棠‘9-1-6’叶片Pro含量不断增加,而山定子Pro含量先升后降。胁迫0 d时,垂丝海棠‘9-1-6’叶片蔗糖和山梨醇含量显著高于山定子,为其1.30、1.19倍。短期(3 d)胁迫下,两种砧木叶片Pro和山梨醇含量均显著高于CK,垂丝海棠‘9-1-6’叶片蔗糖含量显著高于CK。胁迫40 d时,垂丝海棠‘9-1-6’叶片Pro含量显著高于CK和山定子,分别为CK和山定子的1.88、2.52倍,山定子叶片显著低于CK,仅为其0.69倍;两种砧木叶片蔗糖和山梨醇含量均显著高于相应CK,且垂丝海棠‘9-1-6’叶片蔗糖和山梨醇含量显著高于山定子,为其1.4、1.1倍。
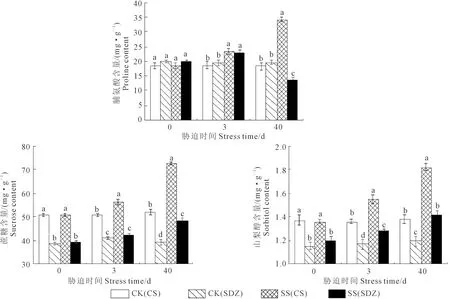
图7 盐胁迫对垂丝海棠‘9-1-6’和山定子叶片渗透调节物质的影响Fig.7 Effects of salt stress on osmolytes of M. halliana and M. baccata leaves
3 讨 论
3.1 垂丝海棠‘9-1-6’和山定子响应盐胁迫的光合荧光特性
盐胁迫下植物光合作用的变化一直是学者研究的热点。Farquhar等[21]研究表明,引起Pn降低的气孔或非气孔限制因素可根据Ci变化判断,当Pn和Ci均降低时,表明光合作用受气孔限制因素影响,当Pn降低而Ci升高则表示光合作用受非气孔限制的影响。本研究中,两种砧木叶片Pn的降低均伴随着Ci的升高,说明非气孔限制可能是两种苹果砧木叶片Pn下降的主要因素,即光合细胞机构和功能受到损伤所致。此外,盐胁迫也显著影响两种砧木叶片Tr和Gs,表现为Tr和Gs下降,这与罗达等[22]在盐胁迫杂种榛中的研究结论一致。胁迫40 d时,垂丝海棠‘9-1-6’Pn、Gs和Ci变幅显著小于山定子,而Tr无显著差异,可能是垂丝海棠‘9-1-6’叶片利用荧光或热耗散的方式耗散过多的光能,以保护光合机构免受损伤,保持较高的光合效率,表现出良好的耐盐性,张潭[23]在沙枣等树木的研究中也得出了相似的结论。
植物活体叶绿素发出的荧光信号包含丰富的光合信息,通过叶绿素荧光可深入了解胁迫对植物PSII的影响以及其对胁迫的适应机制[24]。本试验中,100 mmol·L-1NaCl不同程度地降低了两种砧木叶片PSII反应中心的潜在活性、Fv/Fm和ETR,增加了通过非光化学途径的能量耗散,这和前人对葡萄、玉米等[25-26]的研究结论一致。PSII天线色素的热耗散常导致F0降低,而PSII反应中心的破坏或可逆失活则引起F0的增加,Fv/Fm降低表明叶片PSII发生光抑制[27]。胁迫3 d时,山定子叶片F0显著高于CK,而垂丝海棠‘9-1-6’叶片F0无显著变化,可能是垂丝海棠‘9-1-6’叶片在短期胁迫下通过热耗散来保护PSII反应系统的动态平衡,而山定子叶片在感受到胁迫后PSII反应系统即失去平衡,使光系统中心遭受损坏所致。长期胁迫下,两种砧木叶片F0均显著增加,说明此时两种砧木叶片PSII反应中心均可能遭受破坏,且在相同的盐胁迫条件下两种砧木增幅不同,抗盐砧木垂丝海棠‘9-1-6’能够保持较高的Fv/Fm和ETR,其原因可能是耐盐植物比盐敏感植物色素含量变化小,而叶绿素含量的高低直接影响色素蛋白复合体的功能,从而影响叶绿体对光能的吸收、传递和转化[28]。
盐胁迫下,qP和ETR值降低,表明PSII天线色素捕获光能用于光化学电子传递的份额减少,为避免光合器官受到损伤,PSII反应中心需要启动保护性调节机制来耗散剩余光能[29],Y(NPQ)和qN可反映其耗散能力,Y(NO)反映光损伤程度[30]。盐胁迫下垂丝海棠‘9-1-6’叶片Y(NPQ)、Y(NO)和qN不断升高,而qP降低,表明垂丝海棠‘9-1-6’在盐胁迫下仍可通过热耗散等方式保持PSII光化学活性和光合电子正常进行;而山定子叶片Y(NPQ)和Y(NO)分别为CK的69.0%和400%,变幅显著大于垂丝海棠‘9-1-6’,表明山定子在100 mmol·L-1NaCl长期胁迫下几乎失去了自我保护能力,PSII反应中心受到了不可逆损伤。垂丝海棠‘9-1-6’相比山定子具有较高的光化学效率,可能是其启动热耗散机制缓解了盐胁迫对PSII反应中心的伤害,更进一步证实了由F0得出的结果,这与秦玲等[26]在葡萄中的研究结果相似。Ma等[31]在大豆研究中发现耐盐性强弱也可能与蛋白含量有关,说明盐胁迫对高等植物不同抗性品种光化学效率的影响存在差异,其响应盐胁迫的机制也不尽相同。
3.2 垂丝海棠‘9-1-6’和山定子响应盐胁迫的抗氧化酶和渗透调节特性
ROS可作为盐胁迫信号分子激发植物体内抗氧化防御系统[32],包括酶促与非酶促系统,他们协同使植物体内ROS的产生与猝灭处于动态平衡。盐胁迫容易破坏ROS的平衡,促进细胞内膜脂降解,引发细胞死亡[33]。本试验中SOD和POD均呈现出先升后降趋势,相对于CK,抗盐性砧木叶片的增幅大于盐敏感砧木,降幅小于盐敏感砧木,这与杨佳鑫等[34]在梅花中的研究结果一致。同一胁迫条件下不同抗盐性品种酶促防御系统的反应差异,表明植物较高的耐盐能力可能源于保护酶活性的增强。AsA是植物体普遍存在的一种非酶促抗氧化剂,AsA-GSH在APX作用下能够有效清除叶绿体中的H2O2[35]。长期(40 d)盐胁迫下,垂丝海棠‘9-1-6’叶片AsA含量和APX活性均显著高于山定子,而H2O2含量显著低于山定子,且与CK无显著性差异,表明抗盐砧木‘9-1-6’在盐胁迫下能够维持AsA-GSH循环的有效进行,有效抑制H2O2增加,这与李琲琲等[36]在大豆中的研究结果一致。两种砧木叶片非酶促防御系统的不同反应,表明叶片APX活性和AsA含量可作为植物耐盐能力的判断依据。
当植物处于盐渍环境中时,液泡内易积累Na+、K+和Cl-等,使液泡内渗透压升高,这时细胞质中会合成如山梨醇、蔗糖和脯氨酸等有机物来平衡液泡膜两侧的水势,减轻盐害[20]。本研究中垂丝海棠‘9-1-6’叶片脯氨酸(Pro)含量持续增加,这与孙聪聪等[37]在银杏叶片中的研究结果一致,脯氨酸积累提高了叶片耐渗透胁迫能力,从而提高叶肉细胞保水能力和对盐胁迫的适应能力;而山定子叶片Pro含量先升后降,可能是100 mmol·L-1NaCl胁迫超出了山定子的耐受范围,从而表现出弱抗性,Liu等[38]在拟南芥盐胁迫的研究中也得到了相同结果。果树在盐渍、干旱等逆境条件下可积累大量山梨醇缓解胁迫的危害[39];陈少良等[40]研究得出耐盐性较强的胡杨苗木胁迫后叶片中蔗糖含量的提高可维持液泡和原生质之间渗透势的平衡,还可在高盐条件下保持细胞质中多种酶的活性,耐盐性较弱的群众杨则缺乏这种调节能力。本研究中抗盐系‘9-1-6’叶片蔗糖和山梨醇含量在试验前后均显著高于CK和盐敏感砧木山定子(图7),与前人[39-40]研究结论相一致。
4 结 论
相比盐敏感砧木山定子,抗盐性强的砧木垂丝海棠‘9-1-6’通过保持较高的光合能力(Pn和Fv/Fm),积累大量渗透调节物质(蔗糖、山梨醇和Pro)和维持较高的抗氧化酶(APX、SOD、POD)活性,以调节光合机能、维持细胞渗透平衡及清除H2O2响应盐胁迫。
