60Co-γ辐射及PEG胁迫对桑树幼苗生理特性和相关基因表达的影响
2021-08-11赵东晓施新琴董亚茹孙景诗娄齐年王照红
赵东晓 施新琴 董亚茹 耿 兵 孙景诗 娄齐年 王照红 郭 光
(山东省蚕业研究所,山东 烟台 264002)
桑树(MorusalbaL.)属桑科(Moraceae)桑属(MorusL.)桑种(MorusalbaL.),是多年生落叶乔木或灌木。我国是世界上桑树种质资源最丰富的国家,也是蚕桑生产的发源地。桑树是蚕桑产业的重要载体,也是重要的经济树种。桑树的根、茎、叶和果实(桑椹)均富含生物碱、黄酮、多酚、多糖等生物活性物质及多种维生素和矿物质,具有抗氧化、抗肿瘤、抗衰老、降血糖、降血压等功能,有非常重要的药用价值[1-2]。此外,由于桑树的根系发达,具有较强的抗涝、抗旱、抗寒、耐贫瘠能力,可作为生态树种用于防风固沙和荒山矿山修复。
干旱是制约农业生产的非生物胁迫之一,也是造成作物减产最重要的环境因素[3]。我国是一个旱灾多发的国家,由旱灾造成的经济损失占气象灾害损失总量的50%[4]。随着全球气候变暖,干旱将以更高的频率,更长的持续时间以及更广的波及范围成为一种气候常态。干旱也是影响桑树生长和产量的重要环境因素之一[2]。因此,开展桑树抗干旱研究,提高桑树的抗旱性,对蚕桑产业的发展和转型具有重要意义。
核辐射诱变技术是一种有效的育种手段,辐射一方面可直接作用于植物细胞或组织,另一方面可作用于细胞内的水分子,产生超氧阴离子、羟基自由基、单态氧、过氧化氢等活性氧物质[5],从而间接造成细胞损伤。60Co-γ射线穿透力强、成本低且效率高,是最经济、有效的诱变因子。60Co-γ射线照射可造成植物DNA片段缺失或移位,影响细胞内生理生化反应,改变叶绿体类囊体结构,调控抗氧化系统,诱导次生代谢物质积累等[6-8],在较短周期内实现品种改良和新品种繁育的目的。核辐射有一定的“刺激效应”,即低剂量的辐射会对植物产生刺激效应,而高剂量的辐射会抑制或损害植物生长[9]。不同植物、品种、组织对辐射的敏感性不同[10]。目前,已有不少研究表明一定剂量的60Co-γ辐射可刺激植物的生长发育。40 Gy60Co-γ辐射处理库尔勒香梨萌动枝可提高果实品质[11];2~30 Gy60Co-γ 辐射可显著促进莴苣(Lactucasativavar. capitata)种子的萌发,促进幼苗根和胚轴的生长[12];20 Gy60Co-γ辐射可刺激硬质小麦(TriticumdurumDesf.)种子发根,促进根和上胚轴的生长[13];低剂量60Co-γ辐射可提高三果木(TerminaliaarjunaRoxb.)种子萌发率、活力指数,刺激幼苗生长[14]。此外,低剂量60Co-γ辐射还有助于提高植物抗逆性。150 Gy60Co-γ辐射可提高胡杨(Populaseuphratica)种子在NaCl胁迫下的发芽率和发芽势[15]。Shereen等[16]研究发现低剂量60Co-γ辐射可提高水稻(OryzasativaL.)的抗盐性;Moussa[17]发现一定剂量60Co-γ射线辐射大豆种子,可增强大豆植株的抗旱性,提高干旱胁迫下大豆的产量,最佳辐射剂量为20 Gy;李波等[18]认为600 Gy60Co-γ辐射能有效提高NaCl胁迫下苜蓿叶片和根可溶性蛋白、脯氨酸等含量和过氧化物酶、多酚氧化酶的活性,以此提高苜蓿的抗盐能力。适宜剂量60Co-γ辐射还可提高NaCl胁迫下海滨锦葵(Kosteletzkyavirginica)种子的发芽速度和整齐度[19]。
目前,关于60Co-γ辐射桑树种子,及对其幼苗抗旱性以及干旱胁迫相关基因表达的研究鲜见报道。本试验对桑树种子进行不同剂量60Co-γ辐射处理,用10%聚二醇(polyethylene glycol, PEG)溶液模拟干旱胁迫,探讨不同剂量60Co-γ辐射对PEG胁迫下桑树幼苗叶片和根质膜相对透性、抗氧化酶活性、渗透调剂物质及丙二醛(malonaldehyde, MDA)含量的影响,并检测过氧化物酶基因POD1、超氧化物歧化酶基因sodC和脯氨酸合成关键酶—吡咯啉-5-羧酸合成酶基因P5CS的表达,以期阐明60Co-γ辐射对PEG胁迫下桑树幼苗生长的影响,为桑树抗旱机制的研究及抗逆性育种提供一定参考。
1 材料与方法
1.1 试验材料与主要试剂
供试桑树品种为桂优12号,种子购自广西壮族自治区蚕业技术推广总站。在山东省农业科学院辐射中心进行桑种子60Co-γ辐射处理,辐射剂量率为10 Gy·min-1,辐射剂量为0(CK)、100、200、300、400 Gy共5组。每个辐射剂量设置3次生物学重复,每个重复2 000粒种子。
超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、MDA、可溶性蛋白、脯氨酸测试试剂盒均购自南京建成生物工程研究所。RNA提取采用TaKaRa MiniBEST Plant RNA Extraction Kit,反转录采用PrimeScriptTM1stStrand cDNA Synthesis Kit,荧光定量PCR采用TB GreenTMPremixExTaqTM,以上试剂盒均购自日本TaKaRa公司。荧光定量PCR引物由上海生物工程有限公司合成。其他试剂皆为分析纯,均购自上海国药集团化学试剂公司。
1.2 主要仪器与设备
UV-2550紫外分光光度计,日本SHIMADZU公司;TGL18M高速冷冻离心机,湖南凯达科学仪器有限公司;Multiskan FC自动酶标仪,美国Thermo Scientific公司;BIO-RAD CFX96实时荧光定量PCR仪,美国Bio-Rad公司。
1.3 试验方法
1.3.1 幼苗胁迫处理 辐射处理后的桑树种子种植到长10 cm、宽10 cm、深10 cm的营养钵中,种植土为蛭石、沙土、营养土体积比1∶1∶3,每盆播种桑种子10粒,四叶一心期定苗,每盆留苗4株。盆栽试验在植物培养室中进行,培养条件为:光/暗16/8 h/d,光照强度为480 lx,温度25℃。待幼苗生长至2个月时,每个辐射剂量挑选长势一致的桑树幼苗,平均分成2组。其中1组为对照组,浇1/4 Hoagland营养液,另1组为PEG处理组,浇10% PEG溶液(用1/4 Hoagland营养液配制)。对照组和PEG处理组每5 d浇灌一次,每个处理15盆苗。对不同处理的桑苗进行编号,编号见表1。在PEG胁迫第10天采集各组桑苗的叶片和根用于生理生化指标的测定,在PEG胁迫处理24 h采集各组桑苗的叶片和根用于相关基因表达量的检测。
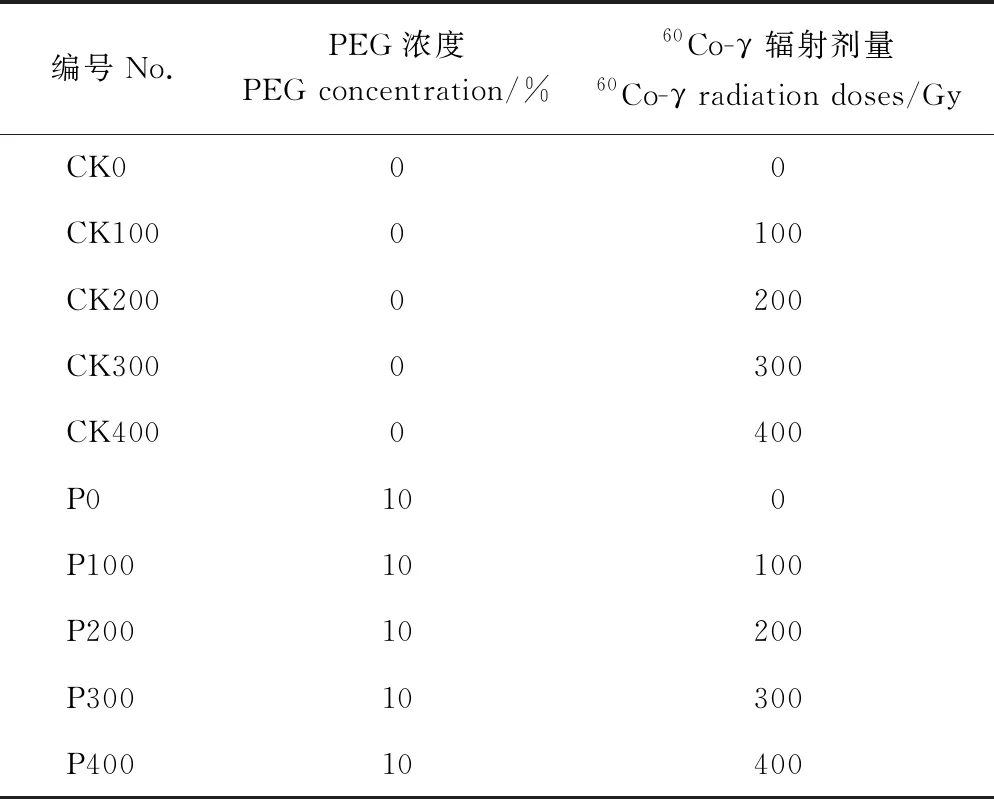
表1 不同处理的设置及编号
1.3.2 细胞质膜相对透性的测定 细胞质膜相对透性用相对电导率表示[20]。试管用去离子水冲洗3遍后烘干,加入20 mL去离子水,用雷磁DDS-307电导率仪(上海仪电科学仪器有限公司)测其初电导率,计为S0;将洗净叶片和根系用去离子水冲洗2次,用吸水纸吸干组织表面水分,剪成大小一致的小段,每个处理准确称取0.2 g材料置于已测初电导率值的试管中,真空抽气10 min,室温振荡1 h,测其浸泡液电导率,计为S1。然后将试管封口,沸水浴30 min,冷却后摇匀,测定终电导率,计为S2。每个处理做3个重复,按照公式计算细胞质膜相对透性:
细胞质膜相对透性=(S1-S0)/(S2-S0)×100%。
1.3.3 抗氧化酶活性及MDA、渗透调节物质含量的测定 取桑树幼苗叶片和根系鲜样,用蒸馏水冲洗干净,吸水纸擦干后用于POD、SOD、CAT活性,MDA、可溶性蛋白、脯氨酸含量的测定。
POD活性采用愈创木酚法测定;SOD活性采用氮蓝四唑(nitro-blue tetrazolium,NBT)还原法测定;CAT活性采用过氧化氢分解反应法测定;MDA含量采用硫代巴比妥酸比色法测定;可溶性蛋白含量采用考马斯亮蓝法测定;脯氨酸含量采用酸性茚三酮法测定。具体检测方法参照试剂盒说明书。
1.3.4POD1、sodC、P5CS基因表达量的检测 采用荧光定量PCR法检测不同处理桑树幼苗叶片和根中POD1、sodC、P5CS基因的表达。采集各处理组的叶片和根样品并提取总RNA,每个样品取500 ng RNA,反转录合成cDNA第一链。根据文献报道的POD1[21]、sodC[21]、P5CS[22]基因及内参基因MaACT1[20]的序列合成引物,引物序列如表2所示。利用CFX96实时荧光定量PCR仪(美国BIO-RAD公司),设置反应体系为20 μL,其中cDNA模板2 μL,2×TB GreenPremixExTaq10 μL,10 μmol·L-1上、下游引物各0.5 μL,ddH2O 7 μL。扩增程序:95℃预变性30 s;95℃变性5 s,60℃退火30 s,40个循环;95℃ 10 s,60℃ 30 s,变性DNA产物。每个样品设3个重复。根据测得的Ct值,采用2-ΔΔCt方法[23]比较各处理组桑树的叶片和根中POD1、sodC、P5CS基因的表达量。

表2 用于检测基因表达的引物
1.4 数据统计与分析
试验数据的处理与作图采用Microsoft Office Word 2007和Excel 2007软件,数据统计分析采用SPSS 20.0软件。用单因素试验统计分析方法对不同处理的杂交桑幼苗试验数据进行差异显著性检测。
2 结果与分析
2.1 60Co-γ 辐射对PEG胁迫下桑树幼苗质膜相对透性及MDA含量的影响
2.1.160Co-γ 辐射对PEG胁迫下桑树幼苗叶片和根质膜相对透性的影响 由图1可知,桑树幼苗叶片和根的质膜相对透性随着辐射剂量的增加呈现先降低后升高的趋势,均在200 Gy处理剂量下最低。正常培养条件(CK组)和PEG处理(P组)下,200 Gy叶片质膜相对透性与未辐射组相比分别显著下降了4.58和1.19个百分点,200 Gy处理根系分别下降4.96和7.46个百分点,其中PEG处理下达到显著差异。辐射剂量高于200 Gy时,CK组和P组叶片和根质膜相对透性均逐渐升高,在400 Gy剂量时最大。400 Gy剂量下CK组和P组叶片质膜相对透性较未辐射组分别增加1.75和8.02个百分点,其中后者达到显著差异;根中质膜相对透性在400 Gy剂量下CK组和P组较未辐射组分别增加3.46和12.94个百分点,CK组无显著差异,而P组差异显著。说明一定剂量60Co-γ 辐射桑种后桑树幼苗叶片和根系中质膜的损伤恢复较好,在PEG处理后效果更显著,但过高的剂量会加剧质膜损伤。
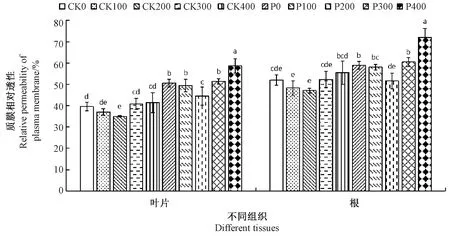
注:同一组织中不同小写字母表示在0.05 水平差异显著。下同。
2.1.260Co-γ 辐射对PEG胁迫下桑树幼苗叶片和根中MDA含量的影响 由图2可知,随着辐射剂量的增加,桑树幼苗叶片和根中MDA含量先降低后升高,200 Gy剂量下MDA含量最低。与CK0组和P0组相比,CK200组和P200组叶片中MDA含量分别降低4.61%和34.58%,根中MDA含量分别降低11.26%和35.56%,均在PEG处理下达到显著差异,CK组中差异不显著,说明相对于正常环境,PEG处理下200 Gy60Co-γ 辐射桑种后幼苗叶片和根中MDA含量明显降低,膜脂过氧化伤害程度较轻。当辐射剂量高于200 Gy时,CK组和P组叶片和根中MDA含量均逐渐升高,在400 Gy剂量下达到最高。与未辐射组相比,400 Gy辐射下CK组和P组叶片中MDA含量分别升高10.99%和17.91%,根中MDA含量分别升高2.73%和22.21%,均在P组中差异显著,CK组中差异不显著,说明高剂量60Co-γ辐射可加剧膜脂过氧化,造成PEG胁迫下MDA的过量积累。

图2 60Co-γ 辐射对PEG胁迫下桑树幼苗叶片和根部MDA含量的影响
2.2 60Co-γ辐射对PEG胁迫下桑树幼苗抗氧化酶活性的影响
由图3-A可知,随着辐射剂量的增加,桑树幼苗叶片和根中SOD活性均呈现先上升后下降的趋势,在200 Gy剂量下活性最高。200 Gy辐射下,CK组和P组叶片SOD活性分别比未辐射组升高4.49%和22.88%,根系SOD活性分别比未辐射组升高6.76%和21.05%,其中CK组中变化不显著,而PEG处理下显著升高。当辐射剂量大于200 Gy时,CK组和P组叶片和根系SOD活性低于未辐射组,且辐射剂量越大SOD活性越低。400 Gy辐射下,CK组和P组叶片中SOD活性分别比未辐射组下降14.56%和21.78%,根中SOD活性分别比未辐射组下降3.47%和33.63%,均在P组中差异显著,CK组中差异不显著。
由图3-B可知,与SOD活性相似,桑树幼苗叶片和根中POD活性也随辐射剂量增加呈现先上升后下降的趋势,200 Gy剂量下POD活性达到峰值。200 Gy辐射时,与未辐射组相比,CK组和P组叶片POD活性分别升高18.09%和33.78%,根系POD活性分别升高16.16%和27.54%,其中在CK组中无显著变化,而在P组中变化显著。300、400 Gy辐射时,CK组和P组叶片和根系POD活性低于未辐射组,400 Gy辐射时最低。400 Gy辐射下,与未辐射组相比,CK组和P组叶片中POD活性分别下降12.05%和31.34%,根中POD活性分别下降13.61%和26.00%,均在P组中显著,CK组中不显著。
由图3-C可知,桑树幼苗叶片和根中CAT活性变化规律与SOD、POD活性一致,辐射剂量在200 Gy以下时CAT活性逐渐升高,在辐射剂量为200 Gy时达到最高,辐射剂量高于300 Gy时CAT活性逐渐降低。200 Gy辐射时,与未辐射组相比,CK组和P组叶片CAT活性分别提高12.26%和22.68%,根系POD活性分别提高1.28%和48.12%,其中在CK组中变化不显著,而在P组中变化显著。400 Gy辐射时,CK组和P组叶片和根系CAT活性最低,与未辐射组相比,400 Gy辐射下CK组和P组叶片中CAT活性分别下降13.84%和34.61%,CK组差异不显著,而P组差异显著;根中CAT活性分别下降31.30%和19.29%,差异均显著。
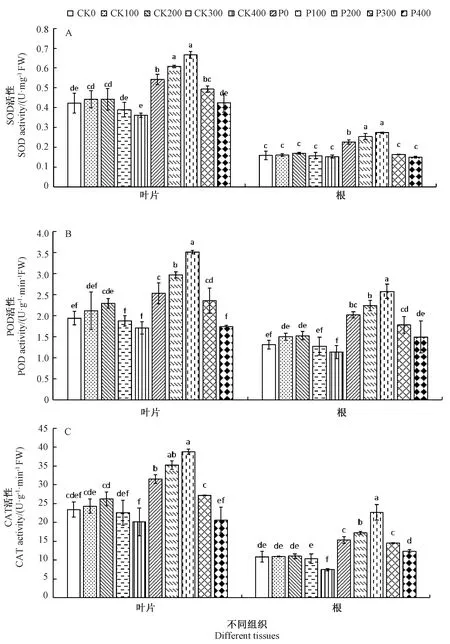
图3 60Co-γ 辐射对PEG胁迫下桑树幼苗叶片和根部SOD(A)、POD(B)和CAT(C)活性的影响
2.3 60Co-γ 辐射对PEG胁迫下桑树幼苗渗透调节物质含量的影响
由图4-A可知,100、200 Gy60Co-γ辐射可促进可溶性蛋白在桑树幼苗叶片和根中积累,300、400 Gy60Co-γ辐射则抑制了叶片和根中可溶性蛋白的积累。正常生长条件下,100、200 Gy辐射后叶片可溶性蛋白含量分别较CK0增加2.70%和4.51%,300、400 Gy辐射后叶片可溶性蛋白含量分别较CK0下降1.49%和6.39%,但各辐射剂量与CK0组相比均无显著变化。PEG处理下,100、200 Gy辐射后叶片可溶性蛋白含量分别较P0增加5.94%和16.60%,300、400 Gy辐射后叶片可溶性蛋白含量分别较P0下降7.69%和13.55%,其中200、300、400 Gy与P0的差异性均显著。根中可溶性蛋白含量的变化趋势与叶片相同,正常生长条件下,100、200 Gy辐射下根中可溶性蛋白含量分别较CK0增加了2.54%和10.52%,300、400 Gy辐射下根中可溶性蛋白含量分别较CK0下降3.50%和9.07%,其中200、400 Gy剂量与CK0差异显著。PEG处理下,100、200 Gy辐射下根中可溶性蛋白含量分别较P0增加0.76%和17.13%,300、400 Gy辐射下根中可溶性蛋白含量分别较P0下降1.08%和4.93%,其中200 Gy与P0的可溶性蛋白含量差异显著。
由图4-B可知,脯氨酸在桑树幼苗叶片和根中的含量随辐射剂量的增加表现出先升高后降低的变化规律。正常生长条件下100、200 Gy辐射后叶片中脯氨酸含量分别较CK0组增加2.91%和11.07%,300、400 Gy辐射后叶片脯氨酸含量分别较CK0组下降0.99%和3.03%,差异均不显著。PEG处理下,100、200 Gy辐射后叶片脯氨酸含量分别较P0组增加8.04%和14.75%,300、400 Gy辐射后叶片脯氨酸含量分别较P0组下降7.55%和20.67%,其中200和400 Gy与P0组的差异性均显著。根中脯氨酸含量的变化趋势与叶片相同,正常生长条件下,100、200 Gy辐射下根中脯氨酸含量分别比CK0组增加了8.85%和17.35%,300、400 Gy辐射下根中脯氨酸含量分别比CK0组下降4.67%和12.21%。PEG处理下,100、200 Gy辐射下根中脯氨酸含量分别比P0组增加2.46%和27.56%,300、400 Gy辐射下根中脯氨酸含量分别比P0组下降9.61%和20.80%,其中200 Gy剂量与P0组差异显著。

图4 60Co-γ 辐射对PEG胁迫下桑树幼苗叶片和根部可溶性蛋白(A)和脯氨酸(B)含量的影响
2.4 60Co-γ 辐射对PEG胁迫下桑树幼苗胁迫相关基因表达的影响
由图5-A可知,在正常生长条件下,与CK0组相比,400 Gy以下60Co-γ 辐射对桑树叶片和根中过氧化物酶基因POD1表达量无显著影响。P0组叶片和根中POD1表达量分别比CK0组显著升高了5.69倍和4.25倍。PEG处理下,100、200 Gy辐射下叶片POD1表达量分别是P0组的1.90倍和2.71倍,300、400 Gy辐射下叶片POD1表达量分别是P0组的0.91倍和0.60倍,其中100、200、400 Gy组达到显著差异。PEG处理下,100、200 Gy辐射下根中POD1表达量分别是P0组的1.23倍和2.10倍,300、400 Gy辐射下根中POD1表达量分别是P0组的0.86倍和0.53倍,其中200、400 Gy组达到显著差异。上述结果表明,100、200 Gy辐射可刺激叶片和根中POD1表达,而300、400 Gy则抑制了POD1表达。
由图5-B可知,正常生长条件下,与CK0组相比,100~400 Gy60Co-γ辐射对桑树叶片和根中超氧化物歧化酶基因sodC表达量无显著的影响。未辐射时,与CK0组相比PEG处理显著上调叶片和根中sodC的表达,其中叶片中上调了2.09倍,根中上调了5.20倍。PEG处理下,与P0组相比,叶片sodC表达量在100、200 Gy辐射下上调1.78倍和5.17倍,300、400 Gy辐射处理下调了35.51%和74.61%,各辐射剂量均达到显著差异。PEG处理下,与P0组相比,根中sodC表达量在100、200 Gy辐射下分别上调了1.40倍和2.81倍,300、400 Gy辐射下下调了9.58%和36.75%,其中100、200、400 Gy组之间达到显著差异。
由图5-C可知,正常生长条件下, 与CK0组相比,吡咯啉-5-羧酸合成酶基因P5CS表达量在各辐射剂量下无显著变化。与CK组相比PEG处理可显著刺激叶片和根中P5CS表达,其中叶片中上调6.70倍,根中上调5.93倍。PEG处理下,100、200 Gy辐射下叶片P5CS表达量是P0组的1.80倍和2.24倍,300、400 Gy辐射下叶片P5CS表达量是P0组的0.90倍和0.56倍,其中100、200、400 Gy组达到了显著差异。PEG处理下,100、200 Gy辐射下P5CS在根中的表达量是P0组的1.21倍和1.63倍,300、400 Gy辐射下P5CS在根中的表达量是P0组的0.82倍和0.28倍,各辐射组均达到显著差异。
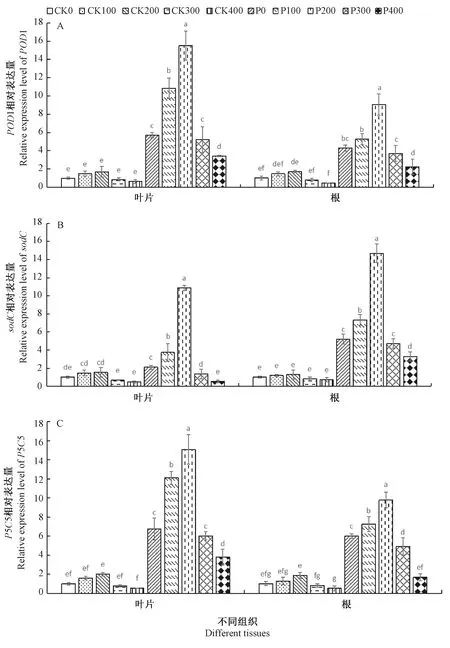
图5 60Co-γ辐射对PEG胁迫下桑树幼苗叶片和根部POD1(A)、sodC(B)和P5CS(C)基因表达水平的影响
3 讨论
植物固着生长的特性决定其只能被动遭受逆境的影响和制约。植物为了适应逆境,会通过改变形态特征和生理生化特性等方式来抵御逆境胁迫。PEG胁迫会损伤植物细胞膜的结构和功能,使细胞膜透性增大、电解质渗露,使细胞膜发生膜脂过氧化作用,从而在细胞中积累大量MDA[24]。本研究中,100和200 Gy60Co-γ 辐射桑种后,正常生长环境中桑树幼苗叶片和根质膜相对透性和MDA含量较低,说明适当剂量的60Co-γ 辐射会刺激桑树幼苗细胞代谢活性,减轻膜脂过氧化,维持质膜的完整性。300和400 Gy60Co-γ 辐射使桑树幼苗叶片和根质膜相对透性和MDA含量升高,说明辐射剂量超过一定阈值时会加速桑树幼苗膜脂过氧化,并破坏质膜结构,Helaly等[25]在柠檬中也得到了类似的结果。PEG胁迫下,100~400 Gy60Co-γ 辐射对桑树幼苗叶片和根部质膜相对透性和MDA含量的影响与正常生长条件下变化一致,但更明显,说明低剂量的60Co-γ 辐射可在一定程度上维持PEG胁迫下桑树幼苗细胞膜的稳定性,而高剂量辐射加剧了细胞膜的损伤,这与60Co-γ 辐射对拟南芥[26]在盐胁迫下的作用结果一致,这可能是因为适当剂量的60Co-γ 辐射能直接或间接激活某些膜脂过氧化过程中基因的表达。
逆境胁迫植物细胞中活性氧(reactive oxyen species, ROS)的积累会使膜脂过氧化,破坏细胞的生理和代谢。SOD、POD、CAT等抗氧化酶可清除过多的ROS,维持细胞内活性氧的动态平衡。本试验中,200 Gy60Co-γ 辐射的桑树幼苗在PEG胁迫下,叶片和根中SOD、POD、CAT活性相比未辐射处理幼苗显著升高,但辐射剂量达到400 Gy时叶片和根中SOD、POD、CAT活性相比未辐射处理幼苗显著下降,表明200 Gy60Co-γ 辐射可通过提升SOD、POD、CAT活性来增强桑树幼苗的抗旱性,但400 Gy辐射剂量过高,造成部分酶蛋白结构改变从而导致酶失活,加剧了桑树幼苗的伤害。这与拟南芥[26]、水稻[27]、无芒雀麦[28]中的研究结果一致。植物对逆境胁迫环境的适应过程由众多基因参与,并形成复杂的响应机制。荧光定量PCR结果显示,PEG胁迫下200 Gy60Co-γ 辐射可显著激发POD1、sodC的表达,400 Gy则抑制了POD1、sodC的表达,这可能是抗氧化酶活性发生变化的原因。
植物受PEG胁迫时,细胞中积累一定量的渗透调节物质(如可溶性蛋白、脯氨酸等),维持细胞渗透势,抵御PEG胁迫带来的渗透压。因此,在一定程度的逆境胁迫下,渗透调节物质含量的多少可表示植物遭受逆境胁迫的强弱[29]。本研究结果表明,200 Gy60Co-γ 辐射下,PEG处理后桑树幼苗叶片和根中可溶性蛋白和脯氨酸含量较未辐射处理显著升高,且脯氨酸合成途径中的关键限速酶基因P5CS的表达水平也显著提高,脯氨酸在细胞中的积累可维护胁迫下保护酶的活性,稳定生物膜和生物大分子结构[30],因此推测200 Gy60Co-γ 辐射增强桑树幼苗抗旱性部分原因是由于诱导脯氨酸合成关键基因表达,从而促进脯氨酸等渗透调节物质的积累。辐射剂量达到400 Gy时,可溶性蛋白和脯氨酸含量下降,P5CS的表达水平也受到显著抑制,与大麦[31]、苜蓿[18]、乌拉尔甘草[32]的研究结果一致,可能是由于过高剂量的60Co-γ辐射抑制蛋白合成,或破坏蛋白结构而造成蛋白降解,具体原因还需进一步研究。下一步将深入分析提高桑树抗旱性的精确辐射剂量区间,以及缓解不同程度PEG胁迫损伤的最佳辐射剂量区间,并探究辐射缓解PEG胁迫的具体机理。
4 结论
本研究结果表明,适宜剂量60Co-γ 辐射可以有效缓解10% PEG对桑树幼苗造成的伤害,降低叶片和根中MDA含量和质膜相对透性,减轻细胞膜脂损伤,提高SOD、POD、CAT抗氧化酶活性,促进可溶性蛋白、脯氨酸等渗透调节物质积累,上调POD1、sodC、P5CS的相对表达量,增强桑树幼苗的抗旱性,其中以200 Gy60Co-γ 辐射的种子抗旱性最强。本研究结果为干旱地区桑树种植栽培及坑旱性育种提供了一定的理论依据。
