新型抗菌药物研究进展与临床应用
2021-08-11叶静肖婷婷王雪婷朱云颖杨凯肖永红
叶静,肖婷婷,王雪婷,朱云颖,杨凯,肖永红
(浙江大学医学院附属第一医院 传染病诊治国家重点实验室,浙江 杭州 310003)
细菌耐药已经成为全球急需应对的公共卫生危机,全球每年因耐药菌感染导致的死亡数已经超过70万人,如果耐药不加控制,到2050年细菌感染将再次成为人类致死首要原因,预计每年将有超过1 000万人死于耐药细菌感染,累计社会经济损失将高达100万亿美元。为此,世界卫生组织在2015年制定了“耐药控制全球行动计划”,其中新型抗菌药物的研发是治疗各种耐药细菌感染最有效的手段。在各国政府对新型抗菌药物研究与开发鼓励政策下,既往趋于沉寂的新抗菌药物研发在近10年来重新活跃起来,并且不断有新产品上市供临床应用。本文就近年来开发的新型重要抗菌药物做简介,以期为相关研究和临床应用提供参考。
1 新型β-内酰胺酶抑制剂复方
随着碳青霉烯类耐药细菌流行,具有抑制碳青霉烯酶活性的新型β-内酰胺酶抑制剂的研发成为新抗菌药物开发热点,目前已有数个复方产品上市,包括头孢他啶/阿维巴坦(ceftazidime/avibactam)、亚胺培南/西司他丁/雷利巴坦(imipenem/cilastatin/relebactam)、美罗培南/法硼巴坦(meropenem/vaborbactam)。
1.1 头孢他啶/阿维巴坦
头孢他啶/阿维巴坦是头孢他啶与阿维巴坦按照质量比4∶1组成的复方制剂,被美国食品和药品管理局(FDA)批准用于复杂性腹腔感染、复杂性尿路感染以及敏感菌导致的其他感染的治疗。
阿维巴坦属于二氮杂双环辛酮(DBO)化合物,与传统的β-内酰胺酶抑制剂不同,其不属于β-内酰胺化合物。阿维巴坦对Ambler A类如超广谱 β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)和肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniaecarbapenemase,KPC)、C类如头孢菌素酶(Amp cephalosporinase,AmpC)和某些D类酶(OXA-48)具有广泛抑制作用。与阿维巴坦联合使用能恢复头孢他啶对因产生β-内酰胺酶耐药的肠杆菌、铜绿假单胞菌、鲍曼不动杆菌的抗菌活性,对多重耐药菌、泛耐药菌、碳青霉烯耐药菌均展现出很强的活性,特别对非金属碳青霉烯酶的抑制作用最为重要(见表1),但对金属β-内酰胺酶没有抑制作用[1]。
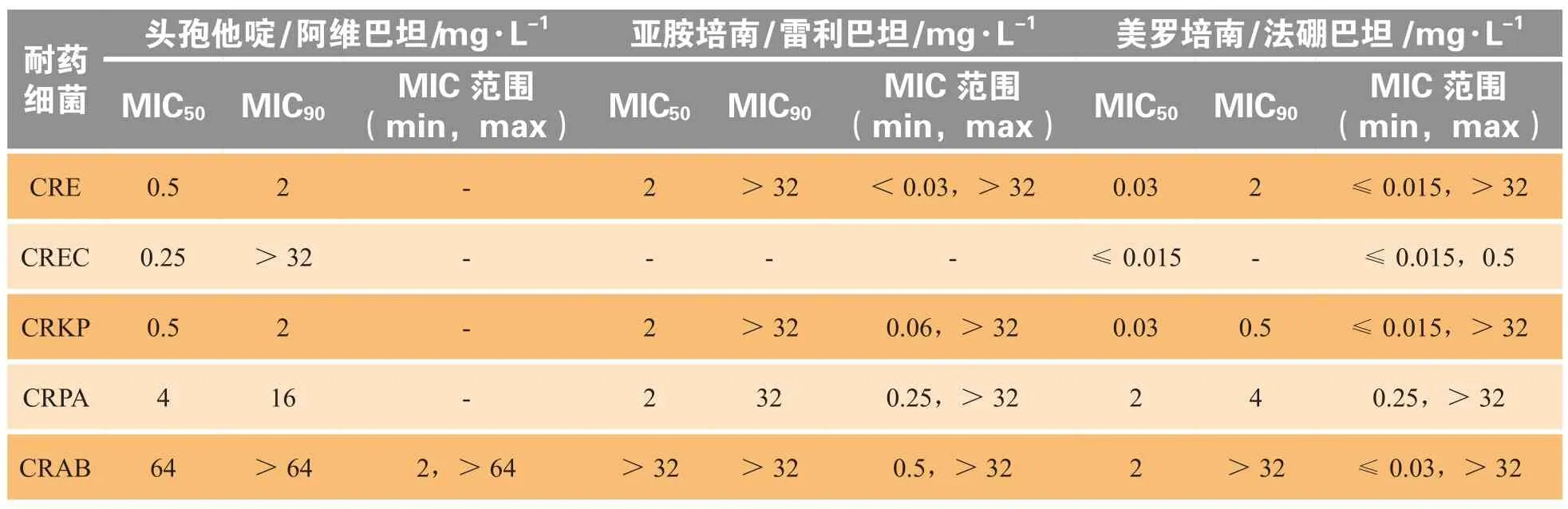
表1 3种新型β-内酰胺酶抑制剂复方对各种碳青霉烯耐药细菌抗菌活性比较[1-2]Table 1 Comparative in vitro antibacterial activity of three new β-lactamase inhibitor combinations against carbapenem-resistant bacteria
阿维巴坦与头孢他啶具有相似的体内代谢过程,药物之间不存在相互作用。头孢他啶/阿维巴坦和亚胺培南/西司他丁治疗成人复杂尿路感染的疗效和安全性比较显示,2组的微生物学应答率良好,分别为70.4%、71.4%[3]。头孢他啶/阿维巴坦和美罗培南对照治疗医院获得性肺炎(hospital-acquired pneumonia,HAP)的疗效与安全性研究显示,两者临床治愈率分别为77.4%、78.1%[4]。头孢他啶/阿维巴坦/甲硝唑和亚胺培南/西司他丁治疗复杂腹腔感染的疗效与安全性研究发现,两者微生物治愈率分别为81.6%、85.1%。一项meta分析评估了头孢他啶/阿维巴坦单一疗法或与其他抗生素联合治疗碳青霉烯耐药革兰阴性菌感染的疗效,结果显示单独使用或与其他抗生素联合使用的病死率不存在明显差异,两者分别为30.9%、38.1%,微生物疗效分别为63.4%、64.9%[5]。
头孢他啶/阿维巴坦引起的不良事件多数为轻至中度,最常见为消化系统不良反应如腹泻、便秘和消化不良等。
1.2 亚胺培南/西司他丁/雷利巴坦
雷利巴坦也属于DBO β-内酰胺酶类抑制剂(见表1),亚胺培南/西司他丁/雷利巴坦(500 mg /500 mg /250 mg)复方已被美国FDA批准用于治疗选择有限的或没有其他可替代药物的复杂性尿路感染、复杂性腹腔内感染和HAP/呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)。同样,雷利巴坦对金属β-内酰胺酶没有抑制作用[1]。
雷利巴坦与亚胺培南体内代谢过程相似。单次给药后雷利巴坦半衰期为1.4 ~ 1.6 h;亚胺培南半衰期为1.0 ~ 1.2 h。多次给药与单次给药的药代动力学参数值无明显差异[6]。
一项Ⅲ期临床试验比较了亚胺培南/西司他丁/雷利巴坦与黏菌素联合亚胺培南/西司他丁治疗亚胺培南耐药菌感染的疗效和安全性,结果显示2组患者微生物总体有效率分别为71%、70%[7];亚胺培南/西司他丁/雷利巴坦与哌拉西林/他唑巴坦治疗HAP/VAP的疗效与安全性比较显示,亚胺培南/西司他丁/雷利巴坦组与哌拉西林/他唑巴坦组全因病死率分别为15.9%、21.3%[8]。
亚胺培南/西司他丁/雷利巴坦安全性良好,最常见的不良事件为腹泻和恶心。
1.3 美罗培南/法硼巴坦
法硼巴坦是一种含硼基的新型Ambler A类和C类β-内酰胺酶抑制剂,与美罗培南组成复方用于治疗耐药细菌引起的感染。法硼巴坦对KPC酶具有抑制作用,同样对金属β-内酰胺酶没有抑制作用(见表1)[1]。法硼巴坦与美罗培南具有相似的体内代谢过程。美罗培南/法硼巴坦(2g/2g)单次静脉滴注后血药峰浓度(Cmax)分别为40.6和50.7 mg·L-1,药时曲线下面积(AUC)分别为 142 和 168 mg·h·L-1,药物清除率分别为14.6和12.3 L·h-1,消除半衰期(t1/2)分别为1.5和1.99 h。肾功能损害与药物清除率下降相关,随着肾功能下降法硼巴坦清除率下降程度大于美罗培南,因此使用过程中须注意随肾功能变化调整剂量[2]。
美罗培南/法硼巴坦与哌拉西林/他唑巴坦治疗成人包括急性肾盂肾炎在内的复杂尿路感染的疗效和安全性研究显示,2组总体有效率分别为98.4%、94.0%,微生物清除率分别为66.3%、60.4%。美罗培南/法硼巴坦与最佳治疗方案(包括多黏菌素、碳青霉烯类、氨基糖苷、替加环素单药或联合治疗及头孢他啶/阿维巴坦单药)治疗碳青霉烯类肠杆菌感染的疗效与安全性研究显示,2组临床治愈率分别为65.6%、33.3%,第28天全因病死率分别为15.6%、33%[9]。
2 新型头孢菌素
新型头孢菌素的开发也是新抗菌药物研发的方向之一,已经上市的产品包括第5代头孢菌素(头孢洛林、头孢比罗)、新头孢菌素β-内酰胺酶抑制剂复方(头孢洛扎/他唑巴坦)和头孢地尔(cefiderocol)。
头孢地尔是一种新型铁载体头孢菌素,通过细菌铁载体蛋白进入菌体(特洛伊木马机制),再与青霉素结合蛋白结合而发挥杀菌作用。2019年11月FDA批准头孢地尔用于复杂性尿路感染的治疗。
头孢地尔能够抵抗包括丝氨酸β-内酰胺酶[ESBLs、KPC酶、苯唑西林酶(oxacillinase,OXA)等]和金属β-内酰胺酶[新德里金属β-内酰胺酶(NDM)、维罗纳整合子编码的碳青霉烯酶(VIM)、亚胺培南金属酶(IMP)等]的水解作用,对包括碳青霉烯耐药、多重耐药的肠杆菌科菌、铜绿假单胞菌、不动杆菌属、嗜麦芽假单胞菌在内的革兰阴性杆菌具有很强的体外抗菌活性,对革兰阳性菌及厌氧菌的体外抗菌活性则相对较弱[10]。
头孢地尔在健康受试者单次给药输注2 000 mg后,Cmax为156 mg·L-1,AUC为389.7 mg·h·L-1,t1/2为2.74 h。大约60% ~ 70%的头孢地尔以原形从肾脏排泄,仅有小于10%的头孢地尔以代谢产物的形式排泄。对于中重度肾功能不全及终末期肾病患者,需要合理调整剂量。
一项随机、多中心、双盲Ⅱ期临床研究结果表明,头孢地尔治疗复杂性尿路感染的临床治愈率为89.7%,微生物清除率为73%,对照药物亚胺培南/西司他丁的临床治愈率为87.4%,微生物清除率为56.3%[11]。头孢地尔与美罗培南用药14 d治疗HAP的全因死亡率分别为12.8%、11.4%。比较头孢地尔与最佳治疗方案对碳青霉烯耐药革兰阴性菌感染的疗效与安全性的临床研究显示,2组的临床治愈率相似,分别为50%、52.6%[12]。Bassetti等[12]的研究结果支持头孢地尔作为选择有限的碳青霉烯类耐药感染的治疗药物。
3 新型糖肽类抗菌药物
新型糖肽类抗菌药物主要是万古霉素和替考拉宁的衍生物,在全球各地上市的药物包括特拉万星(telavancin)、达巴万星(dalbavancin)、奥利万星(oritavancin)3个药物(见表2)。

表2 万古霉素和新型糖肽类单次给药药物药代动力学参数比较[13-16]Table 2 Comparison of pharmacokinetics parameters of single-close vancomycin and new glycopeptides
3.1 特拉万星
特拉万星是一种新型脂糖肽类抗菌药,是万古霉素的半合成衍生物,含有一个额外的亲脂性侧链和一个带负电荷的亲水基团,能够对革兰阳性菌产生杀菌作用。特拉万星除通过与五肽肽聚糖前体的D-Ala-D-Ala末端结合而抑制细胞壁肽聚糖的交联,从而达到抑制细胞壁的合成发挥抗菌作用外,还会引起革兰阳性细菌的细胞膜去极化,破坏膜电位并改变细胞通透性,从而达到快速杀菌效果。特拉万星对各种阳性球菌和艰难梭菌具有抗菌活性,且抗菌作用较万古霉素强,对VanB、VanC型耐药肠球菌也具有抗菌作用,体外对万古霉素中介耐药的金黄色葡萄球菌(vancomycin-intermediateS.aureus,VISA)、耐药金黄色葡萄球菌也具有抗菌作用。体外研究发现,当特拉万星AUC/MIC比为404时获得最大杀菌效果;在免疫缺陷小鼠菌血症模型中,特拉万星对VISA亦有效[13]。
特拉万星需要缓慢静脉输注给药,在给药剂量1 ~ 12.5 mg·kg-1范围呈线性药代动力学特征,平均消除半衰期为7.5 h。特拉万星蛋白质结合率高(约93%),能较好地进入肺泡上皮细胞衬液(epithelial lining fluid,ELF)和肺泡巨噬细胞。主要通过肾脏排泄清除,在健康的老年受试者中,特拉万星的清除率没有降低,但肾功能损害的成年患者中药物清除率(CCr< 30 mL·min-1)明显下降[17]。静脉血液滤过可显著帮助清除特拉万星。肝功能不全对特拉万星的药代动力学特征没有显著影响。
美国FDA批准特拉万星用于治疗复杂性皮肤及软组织感染和HAP。复杂性皮肤及软组织感染临床试验中特拉万星临床治愈率与万古霉素相当;特拉万星对HAP的临床治愈率为82.7%,且不低于万古霉素组(80.9%),其中对于由金黄色葡萄球菌引起的HAP,特拉万星的治愈率(84%)高于万古霉素(74%)[18]。特拉万星和万古霉素的不良反应类似,但特拉万星肾损害发生率较万古霉素高。
3.2 达巴万星
达巴万星对革兰阳性菌包括耐甲氧西林金黄色葡萄球菌(methicillin resistantStaphylococcus aureus,MRSA)、甲氧西林敏感金黄色葡萄球菌(methicillin sensitiveStaphylococcus aureus,MSSA)、凝固酶阴性葡萄球菌(coagulase negativeStaphylococcus,CoNS)、链球菌等具有抗菌活性。达巴万星对耐青霉素和头孢曲松肺炎链球菌、替考拉宁不敏感CoNS、非VanA型肠球菌具有活性;对革兰阳性厌氧菌也具有活性。
健康人中使用单剂量达巴万星140 ~ 1 120 mg后观察到线性药代动力学特征[14]。单次1 000 mg达巴万星给药后,Cmax为301 mg·L-1,AUC为23 843 mg·h·L-1[15]。连续给药第 1 天使用达巴万星首剂1 000 mg 后Cmax为 278.3 mg·L-1,使用 500 mg 维持剂量后在第8天Cmax为166.3 mg·L-1;第8天和第15 天的 AUC 分别为 10 577 和 20 473 mg·h·L-1。达巴万星的血浆蛋白结合率约为93%,约有42%的药物以原形从尿液中排泄[15]。达巴万星单次给药后的终末消除半衰期为149 ~ 257 h[14-15]。肝功能不全和轻度肾功能不全(肌酐清除率50 ~ 80 mL·min-1)患者达巴万星给药后的药代动力学特征无明显改变,无需调整剂量。达巴万星的PK/PD参数的指标是AUC24h/MIC。
在社区获得性MRSA感染的患者中,达巴万星和利奈唑胺在临床和微生物学有效率上无明显差异。对于导管相关血流感染患者的治疗,达巴万星的治愈率为87%,万古霉素的治愈率为50%,经统计学分析,达巴万星的治疗效果优于万古霉素[19]。达巴万星的安全性良好,与利奈唑胺类似,主要的不良反应是口腔念珠菌病、腹泻、便秘、发热。
3.3 奥利万星
奥利万星由于独特的抗菌机制,不仅对万古霉素敏感菌株有抗菌活性,对万古霉素耐药菌也有抗菌活性,包括万古霉素耐药肠球菌和糖肽类耐药的金黄色葡萄球菌。
奥利万星静脉给药剂量与峰浓度和AUC呈线性关系,符合线性药动学特征。85%的奥利万星与蛋白质结合。奥利万星具有广泛的组织分布,分布容积约为1 L·kg-1,肾脏是其排泄的主要途径,其体内清除速率极慢,给药后7 d,尿液药物回收小于5%[16],其终末半衰期大于10 d[20]。肥胖患者或中度肾或肝功能不全的患者不建议调整剂量。奥利万星主要表现出浓度依赖性的杀菌作用,Cmax/MIC与其杀菌效果相关,Cmax/MIC比率为4时足以在体外产生针对MRSA的标准接种物的杀灭活性[20]。
一项随机双盲研究中共有968例皮肤软组织感染患者,475例接受了奥利万星单剂量1 200 mg静脉滴注的治疗,479例接受万古霉素治疗,共10 ~ 14 d,结果显示2组有效性无显著差异[21];奥利万星耐受性良好,其不良反应发生率与万古霉素相当,大多轻微且停药后短期内可恢复正常,常见不良反应为恶心、呕吐、腹泻、头痛、肢体和皮下脓肿。
4.1 特地唑胺
特地唑胺既可口服也可静脉注射给药。静脉滴注200 mg特地唑胺后Cmax为2.3 mg·L-1,蛋白结合率为70% ~ 90%,分布容积为67 ~ 80 L,易在肺巨噬细胞内蓄积;半衰期约为12h;口服生物利用度达90%以上,静脉用药转为口服时无需剂量调节[22]。
一项全球多中心、随机、对照皮肤软组织感染研究显示,静脉或口服常规剂量特地唑胺治疗的临床治愈率为79.7%,微生物清除率为75.9%,与对照药物利奈唑胺相似;特地唑胺治疗VAP的临床治愈率为56.3%,利奈唑胺为63.9%;特地唑胺安全性良好,最常见不良反应为恶心、腹泻、呕吐、便秘等消化道症状,消化道不适及外周神经症状发生率低于利奈唑胺[23]。
4.2 康泰唑胺
我国健康人群药代动力学研究表明,口服800 mg康泰唑胺后Cmax为26.5 mg·L-1,表观分布容积为24.5 L,组织分布较为广泛,清除率为8.83 L·h-1,消除半衰期约为1.91 h[25]。康泰唑胺受试者耐受性良好,目前已完成皮肤软组织感染的Ⅲ期临床研究。
5 四环素类
继替加环素后,近年来又有依拉环素(eravacycline)和奥马环素(omadacycline)2个四环素类衍生物上市。
5.1 依拉环素
依拉环素是一种新型完全合成的含氟四环素衍生物,2018年8月美国FDA批准其上市,用于成人复杂性腹腔感染治疗。依拉环素抗菌活性优于替加环素(见表3),对临床常见革兰阳性、阴性需氧及兼性厌氧菌,大多数厌氧菌以及头孢菌素、大环内酯类、β-内酰胺类/β-内酰胺酶抑制剂多重耐药菌均具有广泛的抗菌活性[26]。依拉环素动物试验显示,与治疗反应最佳相关的药效学参数是AUC0-24h/MIC。
依拉环素在健康受试者中的口服生物利用度较低,平均约为28%,单次口服200 mg后Cmax为(0.23±0.04)mg·L-1,AUC 为(3.34±1.11)mg·h·L-1。静脉注射依拉环素的平均稳态分布体积(Vss)为3.3 ~ 4.2 L·kg-1,t1/2为14.8 ~ 26 h。依拉环素蛋白结合率为71.4% ~ 82.5%,具有非线性浓度依赖性关系。依拉环素主要通过细胞色素P450酶(CYP)3A4和黄素单加氧酶介导的氧化代谢,主要从粪便中排泄,少量经肾脏排泄,在肾功能不全或轻度至中度肝功能不全的患者(Child-Pugh A级和B级)中不需要调整剂量,但Child-Pugh C级患者需要调整剂量[27]。
多项腹腔感染治疗研究发现,依拉环素与碳青霉烯和左氧氟沙星疗效相当[28]。依拉环素耐受性良好,轻度的剂量相关的恶心和中度静脉炎较常见。腹腔感染依拉环素治疗组患者总不良事件发生率较碳青霉烯治疗组患者更高,特别是恶心的发生率更高,但严重不良事件停药的患者无显著差异。
5.2 奥马环素
奥马环素是米诺环素衍生物,2018年10月美国FDA批准其用于治疗成人急性皮肤和皮肤软组织细菌性感染及社区获得性细菌性肺炎(CABP)。奥马环素对多种需氧革兰阳性、革兰阴性细菌和厌氧菌及一些非典型病原体具有较强的体外活性,对革兰阳性菌活性与伊拉环素相似,对革兰阴性细菌活性弱于伊拉环素[29](见表3)。AUC0-24/MIC为奥马环素最佳PK/PD指标。

表3 依拉环素、奥马环素与替加环素体外抗菌活性比较[26. 29]Table 3 Comparison of in vitro antibacterial activity of eravacycline, omadacycline and tigelcycline
奥马环素口服生物利用度为34.5%(口服300 mg和静脉注射100 mg剂量有相似的暴露量)。健康受试者单次静脉输注100 mg奥马环素,Cmax为1.51 mg·L-1,AUC 达 9.36 mg·h·L-1,血浆蛋白结合率只有21%,Vss高达190 ~ 204 L,健康受试者中ELF和肺泡巨噬细胞的浓度较高。奥马环素在人体内基本不被代谢,口服300 mg奥马环素后,81.1%从粪便中排泄,14.4%经尿液排泄。奥马环素的t1/2为13.5 ~ 17.1 h。对于肝肾功能损害的患者,不需要调整奥马环素剂量。
奥马环素在治疗急性社区获得性肺炎(community-acquired pneumonia,CAP)及细菌性皮肤和皮肤软组织感染方面疗效不逊于利奈唑胺或莫西沙星[30-31]。奥马环素耐受性良好,最常见的不良反应为胃肠道反应(恶心、呕吐)和注射部位局部不适。
6 其他新抗菌药物
6.1 普卓米星
普卓米星(plazomicin)是新一代注射用氨基糖苷类药物,是西索米星的衍生物,于2018年被美国FDA批准上市,用于治疗敏感菌引起的成人复杂性尿路感染。普卓米星对大多数革兰阳性、革兰阴性需氧菌均具有良好体外抗菌活性,包括产超广谱 β-内酰胺酶(extended-spectrum beta-lactamase,ESBL)及碳青霉烯类耐药的肠杆菌科[32]。与其他氨基糖苷类药物一样,普卓米星具有浓度依赖性杀菌活性。
成年人单次静脉注射普卓米星(15 mg·kg-1)的Cmax为51 mg·L-1,AUC为226 mg·h·L-1,Vd为18 L。普卓米星血浆蛋白结合率约为20%,主要通过肾脏排泄,在肾功能正常的患者中其平均血浆清除半衰期约为3.5 h。中度肾功能不全患者,普卓米星给药需要调整剂量。
普卓米星每日1次给药方案在治疗由肠杆菌科(包括耐多药菌株)引起的复杂性尿路感染的疗效并不劣于美罗培南。普卓米星常见不良反应以轻、中度消化道和中枢神经反应为主,包括耳鸣、耳部不适、头痛、嗜睡、恶心、感觉减退、头晕和视力模糊,停药后可恢复。相较于同类其他药物,普卓米星肾毒性明显较低[33]。
6.2 来法莫林
来法莫林(lefamulin)是首个在人体中可以全身使用的新型半合成截短侧耳素,现已获得美国FDA批准用于成人CAP的治疗。来法莫林通过与50S核糖体亚基的肽基转移酶中心结合来抑制细菌生长,对大多数常见呼吸道病原体具有有效的抗菌活性,包括大环内酯类耐药肺炎链球菌、MRSA以及流感嗜血杆菌和非典型呼吸道病原体[34]。
来法莫林具有良好的PK/PD特性,表现出时间依赖性杀菌作用,与其抗菌活性最相关的药效学参数是ƒAUC0-24/MIC。健康成人单次静脉注射来法莫林 150 mg 后,ƒAUC0-24为1 500.8 mg·h·L-1,Cmax为 330.1 mg·L-1,血浆蛋白结合率为 80% ~ 87%,可快速渗透到人体组织,在肺ELF中的浓度高出血浆5.7倍,这可能是由于P-糖蛋白介导的来法莫林向ELF的主动转运所致。来法莫林在体外能被CYP酶代谢,特别是作为CYP3A的底物和抑制剂。来法莫林的消除半衰期约为9 ~ 12 h。
来法莫林对成人CAP的疗效不劣于莫西沙星,有效率分别为89.3%和90.5%[35]。来法莫林安全性良好,最常见的不良反应为低血钾、恶心、失眠和输注部位疼痛。
6.3 吉布达星
吉布达星(gepotidacin)是首个三氮乙酰萘拓扑异构酶抑制剂,通过选择性地与细菌DNA促旋酶和拓扑异构酶Ⅳ相互作用来发挥作用,但其作用位点不同于喹诺酮类药物。吉布达星对多种细菌具有体外活性,包括金黄色葡萄球菌、肺炎链球菌和大肠埃希菌等。吉布达星对于金黄色葡萄球菌和肺炎链球菌的 MIC50/90为(0.25/0.5)mg·L-1,对大肠杆菌为(2/4)mg·L-1[36]。
健康志愿者单次口服吉布达星的绝对生物利用度为45%,血浆蛋白质结合率为33%,尿液中回收率约为60%,消除半衰期为9.94 ~ 11.6 h。严重肾功能不全需要调整吉布达星剂量或给药频率。
对于疑诊或确诊革兰阳性菌皮肤软组织感染患者,吉布达星(静脉注射和口服)治疗均安全有效的。吉布达星安全性良好,最常见不良反应有恶心、腹泻、呕吐、腹胀、头痛、转氨酶升高、γ-谷氨酰转移酶升高等[37]。
6.4 奈诺沙星
奈诺沙星(nemonoxacin)为无氟喹诺酮类抗生素,在我国被批准用于治疗CAP。奈诺沙星对革兰阳/阴性细菌以及非典型病原体(包括MRSA和耐万古霉素菌株)均具有较强的抗菌活性。奈诺沙星体外抗菌活性均优于环丙沙星和左氧氟沙星,与莫西沙星相似,但对结核分支杆菌无抗菌活性[38]。
奈诺沙星口服能迅速吸收,具有较高的生物利用度(近100%)。奈诺沙星在人体中广泛分布,血浆蛋白结合率约为16%。奈诺沙星主要通过肾脏排泄,72 h内约60% ~ 70%以原形经尿排出,消除半衰期为 10 ~ 12 h。
奈诺沙星每日口服500 mg治疗轻至中度CAP治疗3 d后,患者症状改善率为61.3%;疗程结束,有98.14 的患者症状明显改善或治愈[平均给药时间(8.24±3.73)d][39]。随机对照试验发现,奈诺沙星对CAP临床治愈率达94.3%,左氧氟沙星的治愈率为93.5%;奈诺沙星的微生物学清除率为92.1%,左氧氟沙星为91.7%。
奈诺沙星的安全性/耐受性良好,主要不良反应包括胃肠道功能紊乱、中性粒细胞减少、白细胞减少、头晕、头痛和血清转氨酶升高等。
7 结语
面对严峻的细菌耐药形势,新型抗菌药物的研究与开发在相关激励政策的引导下开始显现出增加的趋势,按照药物研究开发的创新性看,新型β-内酰胺酶抑制剂、头孢地尔、吉布达星等属于全新结构和作用机制类抗菌药物,从现有研究结果看具有较好的临床应用前景;糖肽类、唑烷酮类、喹诺酮类等则属于结构修饰药物,可能与既有的同类药物间存在交叉耐药现象,需要进一步临床研究加以确证。
