P38 MAPK通路抑制剂对UC-MSC功能的影响
2021-08-10方明霞董艺超成子安范雨萱陈昱圻高建恩郭昌龙
方明霞 董艺超 成子安 范雨萱 陈昱圻 高建恩 郭昌龙 马 旭*
1.北京协和医学院研究生院(100730);2.国家卫生健康委科学技术研究所
间充质干细胞(MSC)具有组织修复和免疫调控的作用:在炎症环境中能够有效的抑制T、B淋巴细胞的增殖,增加Treg细胞的含量;在体内或体外特定的诱导条件下,能够分化成骨、软骨、脂肪等多种细胞,目前被广泛的应用于组织损伤修复、自身免疫性疾病的治疗[1]。P38 MAPK信号通路是细胞内信息传递的主要信号通路之一,可调节细胞生长、分化、炎症、压力刺激、凋亡等多种病理生理过程,是促炎性细胞因子合成的关键调节途径[2]。本研究利用P38 MAPK通路抑制剂SB202190抑制脐带间充质干细胞(UC-MSC)的P38 MAPK通路,观察该通路抑制对UC-MSC形态、表型以及分化能力的影响,进一步评价P38 MAPK通路抑制的UC-MSC促进糖尿病大鼠背部皮损修复的能力。
1 材料和方法
1.1 材料
第3代脐带间充质干细胞购自中盛溯源公司;SPF级7周龄ZDF雌性大鼠购自北京维通利华公司;DMEM-F12培养液、胎牛血清、双抗、PBS、0.25% Trypsin购自美国Gibco公司,人脐带间充质干细胞成脂诱导分化试剂盒购自Cyagen公司,小分子化合物SB202190购自MCE公司,流式检测所用抗体CD14、CD19、CD31、CD73、CD105、CD44、CD90、CD34、CD45、CD146、HLA-DR购自Biolegend公司;6孔细胞培养板购自康宁公司,血糖仪、血糖试纸(1835960)购自稳捷公司;离心机购自湘仪公司,流式细胞仪采用BD Biosciences FACS Calibur。
1.2 细胞实验
1.2.1UC-MSC的复苏培养与鉴定取第3代UC-MSC复苏后,接种于含10%FBS+1%Anti-anti+DMEM /F12的培养瓶中于37℃、5%CO2恒温培养箱中培养。
1.2.2UC-MSC的小分子化合物处理UC-MSC在完全培养基中培养至第5代,0.25% Trypsin消化后接种于完全培养基,培养至融合度达80%时,实验组换用含8μM浓度小分子化合物SB202190的诱导培养基培养,诱导处理48h后,收集两组细胞,流式检测细胞表面CD14、CD19、CD31、CD73、CD105、CD44、CD90、CD34、CD45、CD146、HLA-DR的表达,同时进行成脂分化诱导培养。
1.2.3多组学测序收集上述两组细胞样本送至北京华大蛋白质研发中心有限公司进行转录组测序、小RNA测序。KEGG、GO富集分析各组学检测结果,筛选实验组与对照组细胞之间的差异表达基因。
1.3 动物实验
1.3.1构建糖尿病大鼠模型从北京维通利华公司购入7周龄ZDF雌性大鼠,常规饲料喂养1周后换用高脂饲料(上海雍利)喂养,室内保持12h昼夜节律,温度(25±2)℃,自由摄食、饮水,每周检测大鼠血糖值、记录体重变化,至空腹血糖值稳定维持在11.1 mmol/L以上,以成功构建糖尿病大鼠模型。
1.3.2创伤修复对建模成功的糖尿病大鼠进行随机分组:PBS干预组、UC-MSC干预组、P38 MAPK通路抑制的UC-MSC干预组,于各组大鼠背部开创1.5cm×1.5cm的正方形伤口,分别于伤口四边皮下定点注射200μl PBS、200μl PBS重悬的1×106UC-MSCs、200μl PBS重悬的1×106P38 MAPK通路抑制的UC-MSCs,隔天测量大鼠背部伤口面积,绘制伤口愈合曲线。
1.3.3免疫组化糖尿病大鼠背部伤口愈合率≥90%时取背部愈合组织,制备3μm厚的石蜡切片,分别用苯胺蓝染液、天狼星红染液对切片进行马松染色和天狼星红染色,观察各组大鼠背部愈合组织的胶原沉积情况。
2 结果
2.1 脐带间充质干细胞干性鉴定
显微镜下UC-MSC和P38 MAPK抑制-UC-MSC在生长过程中均呈现典型的MSC形态,即长梭形(图1)(1077页),细胞倍增时间为36h,证明P38 MAPK抑制剂处理不会造成UC-MSC细胞形态以及扩增周期的改变;成脂诱导分化实验中UC-MSC以及P38 MAPK抑制-UC-MSC在诱导分化的第21天经油红O染色于镜下均可观察到大量透亮且圆的脂滴(图2)(1077页);流式细胞术检测UC-MSC和P38 MAPK抑制-UC-MSC表面标志物表达情况,阳性标志物占比均>95%;阴性标志物占比均<2%(表1),符合国际细胞疗法协会(ISCT)定义的MSC三阳五阴的标准,即≥95%的细胞表达CD105、CD73、CD90,且表达CD45、CD34、CD14、CD19、HLA-DR的细胞≤2%。
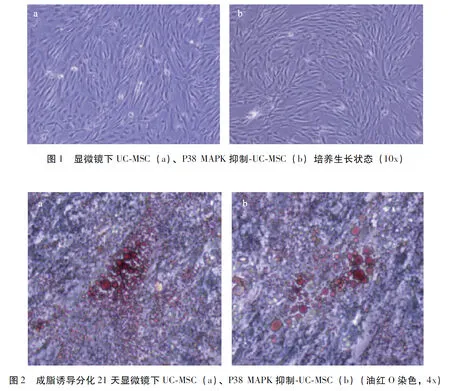

表1 两组细胞表面标志物检测结果 (%)
2.2 多组学测序
通过KEGG功能注释、GO富集分析P38 MAPK抑制-UC-MSC与UC-MSC的转录组测序、小RNA测序结果,发现P38 MAPK通路抑制的UC-MSC与未处理的UC-MSC存在大量差异表达的基因(图3,4)(1077、1078页)。随着DUSP8、FST、ITGB8等基因表达的增强,与之对应的细胞信号通路TGF-β signaling pathway、PI3K-Akt signaling pathway等也发生上调。另外,生物信息学联合分析测序结果发现P38 MAPK通路抑制的UC-MSC中PAI-1的表达增强(图5)(1078页),提示对应的下游与表皮损伤愈合有关的VEGF signaling pathway发生上调。

2.3 动物实验
于糖尿病大鼠背部损伤部位进行皮下干预,隔天测量大鼠背部伤口面积,在第3天经计算得到到P38 MAPK抑制-UC-MSC干预组糖尿病大鼠背部损伤皮肤愈合率29.9%,高于UC-MSC干预组的15.9%以及PBS对照组2.4%(图6)(1079页);至第15天可肉眼观察到P38 MAPK抑制-UC-MSC干预组糖尿病大鼠背部皮损的愈合较另两组好,经测量皮损愈合率均已达90%,伤口愈合组织马松染色及天狼星红染色可观察到P38 MAPK抑制-UC-MSC干预组伤口部位胶原形成情况较UC-MSC干预组以及PBS对照组好(图6)(1079页),综合各组大鼠背部伤口愈合情况、免疫组化结果以及愈合曲线(图7)(1079页)可知P38 MAPK通路抑制的UC-MSC促进组织修复的效果得到增强。

3 讨论
UC-MSC的组织修复和免疫调节的功能对于多种疾病的治疗及其研究都具有实际意义,同时UC-MSC易获取的特点使其成为再生领域的首要候选细胞,已有研究显示MSC可直接或间接促进表皮伤口愈合,涉及到的机制:①直接分化和替换丢失的组织成分;②将宿主细胞(如成纤维细胞,角质形成细胞,巨噬细胞和祖细胞)募集到受伤部位调节局部修复反应;③通过减弱免疫效应细胞的增殖并改变其细胞因子谱的产生缓解过度炎症反应;④释放免疫抑制和抗炎因子,如转化生长因子TGF-1,IL-4,吲哚胺2,3-二加氧酶;⑤通过直接的细胞间接触,分泌可溶性因子VEGF,FGF和IL-6促进血管形成,以及释放外泌体促进慢性伤口愈合[3]。
P38 MAPK通过激活涉及各种细胞功能(如细胞凋亡,细胞生长和分化)的转录因子而发挥其生物学作用。P38 MAPK通路激活后,存在于细胞质或细胞核中的转录因子就会被磷酸化和激活,目标基因表达,从而导致生物学反应的发生。这些转录因子主要包括ATF-1,ATF-2,GADD153,肌细胞增强因子(MEF)2C,CREB,C / EBP同源蛋白(CHOP),p53和NF-kB等[4-8]。p38 MAPK途径可以有效调节人全血、肺泡巨噬细胞、单核细胞、滑膜细胞和内皮细胞中促炎性细胞因子(如TNF-α,IL-1,IL-2,IL-6,IL-7和IL-8)的表达和活性[9],另外,p38 MAPK途径在免疫系统的细胞增殖和分化中也起到重要的调节作用,参与GM-CSF,CSF,EPO和CD40诱导的细胞增殖和分化[10-11]。
本研究发现抑制UC-MSC的P38 MAPK信号通路能够增强UC-MSC中VEGF信号通路上游基因PAI-1的表达,提示VEGF信号通路的上调。VEGF信号通路是组织修复的重要通路之一,其过表达能够有效的促进伤口愈合,本研究中动物实验的结果提示VEGF信号通路上调可作为P38 MAPK通路抑制的UC-MSC促进大鼠背部皮损愈合的推理原因之一,但是关于P38 MAPK通路抑制的UC-MSC促进伤口愈合的确切机制还需进一步研究。
