ASXL1缺失对人白血病HEL细胞生物学特性的影响
2021-08-10肖方楠刘怡宁张明英袁佳佳
蒋 晓,肖方楠,刘怡宁,张明英,袁佳佳,邢 文,周 圆
(中国医学科学院血液病医院,中国医学科学院血液学研究所,北京协和医学院血液学研究所,实验血液学国家重点实验室,国家血液系统疾病临床医学研究中心,天津 300020)
典型的费城染色体(philadelphia chromosome,Ph)阴性骨髓增殖性肿瘤(myeloproliferative neoplasms,MPNs)是造血干细胞恶性克隆性增殖并伴随成熟细胞增多的一类疾病,主要包括真性红细胞增多症(polycythemia vera,PV)、原发性血小板增多症(essential thrombocythemia,ET)和原发性骨髓纤维化(primary myelofibrosis,PMF)[1-2]。研究发现,>95%的PV患者中都携带JAK2V617F的突变,且近60%的ET患者和50%的PMF患者也具有JAK2V617F突变。
JAK2是非受体蛋白酪氨酸激酶Janus激酶(JAKs)家族的成员,JAK活化可以促进细胞的增殖、分化、凋亡和迁移,并且通过参与转录激活因子(JAK/STAT)途径,影响多种细胞生物学进程[3],但是JAK2V617F突变在3种不同表型Ph阴性MPN发病机制中的作用尚未完全清楚[4-5]。此外,对MPN患者的高通量基因组分析发现,表观遗传调控因子如ASXL1、TET2、IDH、EZH2和DNMT3A等体细胞突变往往与JAK2突变共存[6]。其中,ASXL1在表观遗传调控中起着重要作用,目前几乎在各种类型的髓系恶性肿瘤中都发现了ASXL1突变,例如骨髓增生异常综合征(myelodysplastic,MDS)、急性髓系白血病(acute myeloid leukemia,AML)和MPN等,其在MDS、MPN和AML中的突变频率分别约为20%、10%和20%[7-8]。临床研究表明,与仅携带JAK2V617F突变的PV患者相比,携带ASXL1和JAK2V617F共突变的患者血红蛋白(Hb)水平降低,白细胞(WBC)和血小板(PLT)计数增加,可触及脾肿大,克隆性异常核型,其生存预后更差[9-11]。
已知ASXL1突变和JAK2V617F共存对MPN的发病有显著影响,但ASXL1突变如何促进JAK2V617F突变导致的MPN疾病进展和预后不良尚不清楚。因此,本研究以携带JAK2V617F纯合突变的人红白血病细胞系HEL为模型,利用CRISPR-Cas9技术建立了HEL-AKO细胞系,为在细胞水平上阐明ASXL1功能缺失性突变与JAK2V617F协调参与MPN进展的作用机制提供了重要工具。
1 材料与方法
1.1 主要材料和仪器HEL是JAK2V617F突变阳性的人红白血病细胞系,购自ATCC细胞库,由本实验室保存。培养条件为含10% FBS的RPMI1640。
胎牛血清(fetal bovine serum,FBS)购自以色列Biological Industries公司;磷酸盐缓冲液(phosphate buffer saline,PBS)购自索莱宝公司;Cell Counting Kit-8购自日本Dojindo Laboratories公司;芦可替尼购自MCE;CFC半固体培养(MethoCult H4230)购自StemCell Technologies公司;流式细胞仪Canto II购自美国Becton Dickinson公司;常温台式离心机购自德国Eppendorf公司。
1.2 利用CRISPR/Cas9基因编辑技术建立ASXL1敲除的HEL细胞系
1.2.1病毒包装 靶向人ASXL1基因的guide RNA序列为5′-CAGATTCTGCAGGTCATA-3′,包装载体 psPAX2、pCMV-VSV-G以及目的质粒配制混合液,配制方法如下表所示,将混合液缓慢逐滴加入铺好的293T细胞(1×107cells),收集24和48 h病毒上清,超离浓缩,进行滴度测定后即可对HEL细胞进行感染,调整细胞密度为1×108L-1,根据病毒滴度,用含有Polybrene(终浓度5 mg·L-1)的培养基配制病毒混合悬液,进行一次感染,8 h后撤Polybrene,更换为新鲜培养基,过夜培养后进行二次培养。
1.2.2HEL细胞分选、测序 将经过二次病毒感染后的细胞扩大培养3 d。配制含嘌呤霉素(终浓度4 mg·L-1)的培养基,继续用含嘌呤霉素的培养基筛5-7 d。将筛选完的HEL细胞的进行单细胞分选,放置1周左右,等克隆长大,即可转出,根据每板克隆的生长情况,挑选相对较大的单细胞克隆转出,扩大培养,提取DNA,测序,根据测序结果,即可挑出目的克隆。
1.2.3细胞STR检验 取适量检材用Microread Genomic DNA Kit 提取DNA,采用MicroreaderTM21 ID System扩增20个STR位点和性别鉴定位点,使用ABI 3730xl型遗传分析仪进行PCR产物检测,使用GeneMapperID-X 软件(Applied Biosystems)对检测结果进行分析,并与ATCC和DSMZ数据库进行比对。
1.3ASXL1敲除对HEL细胞增殖能力的影响根据Life technologies Cell Trace Violet Cell Proliferation Kit操作说明书进行实验。分别取出1×106生长状态良好的HEL Control及HEL-AKO细胞系,细胞数根据细胞的增殖速度和检测的间隔时间决定。每1 mL细胞液(1×106)加入1 μL 5 mmol·L-1染色液进行染色。剩余细胞37 ℃培养箱继续培养,培养过程中不同时间点取出细胞并用4% PFA固定,待所有时间点取完后一同进行流式检测。
1.4 HEL-AKO细胞的体外迁移实验采用24孔板的Transwell小室(8 μm微孔),取1×105生长状态良好的HEL Control以及HEL-AKO细胞,加入到100 μL无血清培养基的上层Transwell小室中,在下室加入900 μL完全培养基,孵育24 h后,用4% PFA固定小室下表面上已经迁移过去的细胞后用0.1%结晶紫染色,在显微镜低下统计5个随机视野中迁移过去的细胞。
1.5 流式细胞仪检测细胞周期收集提前处理24 h的HEL Control以及HEL-AKO细胞系,参考碧云天BeyoClickTMEdU-647细胞增殖检测试剂盒说明书进行实验,处理完细胞后用流式细胞仪进行检测。
1.6ASXL1敲除对HEL细胞克隆形成能力的影响分别收集HEL Control以及HEL-AKO细胞,制备成10×细胞悬液,分别取100 μL加至1.2 mL H4230甲基纤维素中,使最终每孔细胞数为300个,用注射器将混匀的细胞加入24孔板中,3个重复孔。14 d后计数CFC数目,并用0.05%甲紫染色,扫描仪扫描。
1.7 HEL-AKO细胞对芦可替尼药物敏感性检测采用CCK-8法测定芦可替尼处理72 h后对细胞的半数抑制浓度IC50(half maximal inhibitory concentration)。取对数生长期的HEL和HEL-AKO细胞,用含有20%血清的培养基调整细胞浓度为8×107个·L-1,接种于96孔培养板中,每孔90 μL;处理组加不同浓度的药物,阴性对照组加等体积的药物溶剂,使每孔终体积为100 μL。培养72 h后,加入CCK-8在酶标仪上检测450 nm光密度(OD)值,并计算生长的抑制率。在GraphPad Prism7.0软件中,以同一药物的不同浓度对肿瘤细胞生长抑制率作图可得到剂量反应曲线,求出该药物的半数抑制浓度IC50,即细胞存活率减少50% 时的药物剂量。采用克隆形成法检测芦可替尼处理24 h后,HEL Control和HEL-AKO细胞在14 d后耐药克隆的形成情况,具体方法参照“1.6”。
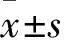
2 结果
2.1ASXL1敲除细胞的构建与鉴定选择生长状态良好的HEL细胞,分别感染携带pRSC-sgControl和pRSC-sgASXL1质粒的慢病毒。单克隆测序结果证明,HEL Control的DNA序列未发生任何变化,HEL-AKO的DNA序列发生13个碱基的缺失(GGTCATAGAGGCA),第36个氨基酸发生移码突变,编码出38个氨基酸(Glu36TrpfsX38)(Fig 1A)。考虑到CRISPR/Cas9基因编辑技术可能存在脱靶,我们利用https://ccg.epfl.ch//tagger/tagscan.html网站检测one mismatch和two mismatch可能脱靶基因,并挑选位于编码区的基因,设计引物,在HEL-AKO细胞中进行测序验证,均未发现脱靶(Fig 1B),本文中仅列举出one mismatch测序结果。细胞STR结果检测HEL细胞DNA扩增后图谱清晰,分型结果良好,细胞中没有发现其它细胞交叉污染,与ATCC中HEL 92.1.7 ErythroleukemiaHuman细胞的STR数据匹配率为83%。该细胞的STR位点和Amelogenin位点的基因分型图谱见附图(Fig 1C)。
2.2ASXL1基因敲除对HEL细胞系的增殖能力和细胞周期的影响为了探究ASXL1敲除之后是否会对HEL的增殖能力产生影响,我们利用CFSE实验以及克隆形成能力检测了其增殖能力,比较发现HEL-AKO细胞的增殖能力变慢(Fig 2A、B)。为进一步了解ASXL1缺失对细胞周期的影响,我们使用流式细胞仪进行细胞周期检测,结果显示ASXL1敲除之后其细胞周期的G2/M期占整个细胞周期的比例增加,G0/G1期和S期均不受影响(Fig 2C),此结果表明ASXL1可能是通过影响细胞周期的G2/M期来调控细胞生长。

Fig 1 HEL-AKO cell line established by CRISPR/Cas9 technology
2.3 检测ASXL1敲除对HEL细胞克隆形成能力和迁移能力的影响为进一步了解ASXL1敲除后对HEL细胞克隆形成能力的影响,我们随后又进行了半固体克隆形成能力实验,结果表明,ASXL1敲除之后,与对照组相比,HEL-AKO细胞的克隆形成变小且克隆数降低(Fig 3A、B)。如Fig 3C所示,HEL-AKO细胞的迁移能力与对照组相比明显增强。
2.4 HEL-AKO细胞经芦可替尼处理后耐药克隆增加芦可替尼作为唯一治疗中期或高风险骨髓纤维化的JAK2选择性抑制剂,具有明显的临床活性,因此我们又测定了芦可替尼对HEL-AKO细胞的半数抑制浓度(IC50)。结果表明,液体培养72 h条件下芦可替尼对HEL和HEL-AKO的半数致死剂量分别是2.058 μmol·L-1和2.13 μmol·L-1(Fig 4A),为了进一步考察药物处理后对细胞的长期影响,我们利用克隆形成实验来检测ASXL1敲除后HEL细胞的耐药克隆形成能力。选取对对照组细胞杀伤性较低的药物剂量处理细胞24 h(2 μmol·L-1Ruxolitinib),用PBS洗去残余药物后重新计数活细胞数,以相同体积细胞接种到0.4 mL H4230半固体培养基中,生长14 d后观察形成的耐药克隆的数目(Fig 4B)。其结果显示,药物处理后过表达HEL-AKO细胞形成的耐药克隆数目明显高于对照组,这说明药物处理后ASXL1缺失的白血病细胞对芦可替尼仍然具有较强的克隆形成能力。

Fig 2 Effects of ASXL1 knockout on proliferation and cell cycle of HEL cell lines n=2)
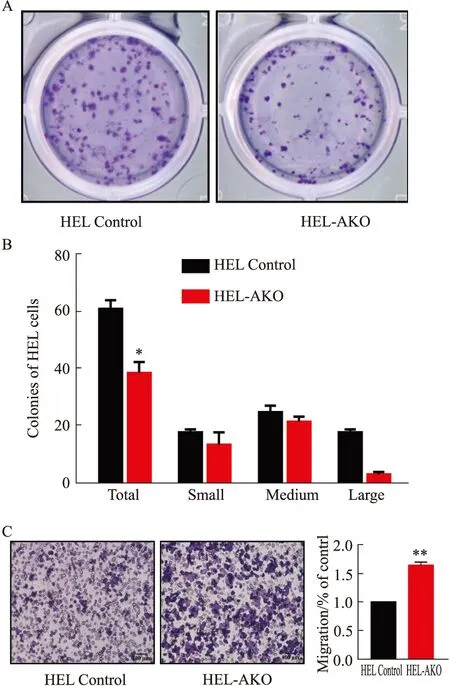
Fig 3 Clone formation ability of HEL-AKO cells n=2)
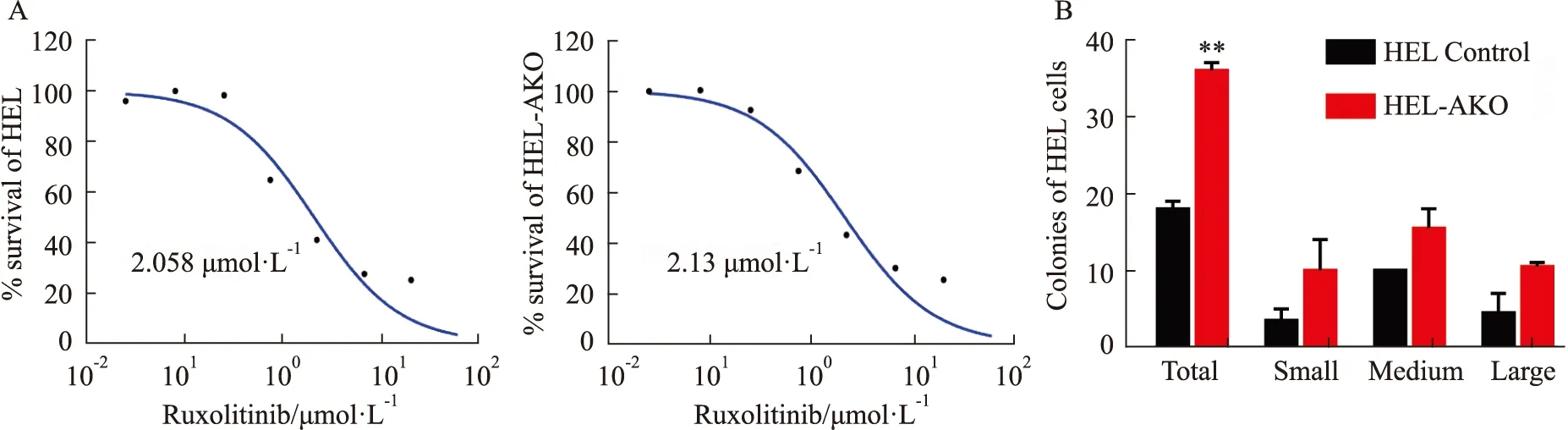
Fig 4 Effects of ruxolitinib on cloning formation ability of HEL-AKO cells n=2)
3 讨论
ASXL1突变为JAK1V617F突变阳性MPN中最常见的共突变基因之一,且共突变患者发生骨髓纤维化比例更高,疾病进展更快,且与疾病进展及不良预后相关,但ASXL1与JAK2V617F协同作用参与MPN的内在机制尚无报道,本研究基于这一背景,利用CRISPR/Cas9基因编辑技术成功建立了ASXL1基因敲除的HEL细胞系(HEL-AKO)。
在本研究中,我们发现ASXL1缺失后的HEL细胞的迁移能力变强,增殖能力变慢,细胞周期G2/M期进程延长,克隆形成能力减弱,在耐药实验中,HEL-AKO细胞对芦可替尼表现出更强的耐药性。芦可替尼作为一种JAK1和JAK2抑制剂,是MPN治疗中所应用的重要靶向药物,可以通过减少脾脏大小,改善骨髓纤维化的相关症状,并提高MPN患者总体生存期[12-13]。本研究发现,ASXL1缺失与JAK2V617F共存时的HEL细胞较单独JAK2V617F突变的细胞产生了明显的芦可替尼耐药性。ASXL1作为重要的表观遗传因子,主要通过影响组蛋白修饰水平发挥作用,例如H3K27me3和H3K4me3等。另外,研究表明,JAK2除了激活JAK-STAT等信号通路,其自身也参与表观遗传调节,直接影响组蛋白的转录后修饰,从而参与染色质修饰过程,造成原癌基因例如HOX基因上调[14-15],而这些HOX基因也大多正是ASXL1敲除后表达上调的基因,这提示我们ASXL1突变很有可能与JAK2V617F协同影响组蛋白修饰,影响特定的基因表达,进而影响了对芦可替尼的耐药性。此外,ASXL1被国际预后评分系统认为是PMF预后相关的独立不良预后因素[16],是否ASXL1缺失导致芦可替尼耐药也是其影响预后的重要原因。关于ASXL1缺失引起的耐药也可能涉及其他多种机制,有研究表明白血病细胞的多药耐药机制与自噬水平密切相关,也可作为重要的切入点之一[17]。
由此可见,ASXL1的缺失对HEL-AKO细胞的生物学特性具有非常重要的影响,下一步我们将利用本细胞模型,结合小鼠模型及患者原代标本,深入阐明ASXL1与JAK2V617F突变协同参与MPN的分子机制,寻找新的药物靶点和药物治疗组合,为临床实践提供进一步的实验依据。
