高迁移率族蛋白B1与肝癌细胞再增殖及肝癌患者预后的关系
2021-08-10贺思佳黄倩程进
贺思佳,黄倩,程进
(上海交通大学附属第一人民医院肿瘤中心,上海200080)
肝癌(liver cancer)是消化系统常见肿瘤,也是全球第六大常见癌症,被认为是导致癌症死亡的第二大原因[1]。在我国,肝癌的发病率位于癌症的第5位,而其病死率在癌症病死率中高居第2 位[1-2]。目前,针对肝癌的分子靶向、化疗、放疗、免疫治疗等综合治疗逐渐成为主要的治疗手段,在一定程度上能够改善肝癌患者预后[3-4],然而,肿瘤复发仍是肝癌治疗失败的主要原因[5],因此,从分子水平研究肝癌复发的发病机制尤为重要。
肿瘤再增殖(tumor repopulation)是指在放、化疗等细胞毒性治疗过程中,大量肿瘤细胞发生死亡,而少量残存肿瘤细胞加速生长,形成新的肿瘤的过程[6-7]。肿瘤再增殖被认为是导致治疗失败和肿瘤复发的重要原因。有研究[25]认为肿瘤干细胞参与肿瘤再增殖。也有文献[10-11]报道认为血管新生、巨噬细胞参与肿瘤再增殖过程。本课题组前期研究[6]发现放疗后诱导产生的凋亡细胞能够通过激活caspase-3,进一步活化下游不依赖钙离子的磷 脂 酶 A2(Ca2+-independent phospholipase A2,iPLA2),在iPLA2的作用下,花生四烯酸转化为前列腺素E2(prostaglandin E2,PGE2),以一种旁分泌的方式促进周围残存肿瘤细胞生长。这项研究首次提出放疗诱导的凋亡细胞能够刺激残存肿瘤细胞再增殖,阐明了caspase-3-iPLA2-PGE2信号通路在其中的重要作用。此外,本课题[12]还发现蛋白激酶C-δ(protein kinase C-δ,PKCδ)作为caspase-3 的底物,通过旁分泌VEGF-A 促进周围残存肿瘤细胞生长。由此可见,肿瘤再增殖是多重机制调控的结果,不断更新研究结果将帮助更好地认识肿瘤再增殖这一过程。高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种DNA 结合蛋白,其表达水平仅次于组蛋白,研究发现HMGB1在多种肿瘤细胞及组织中过度表达,并参与DNA复制、转录、修复、肿瘤增殖、转移等过程[13-16]。因此,本研究通过构建肝癌细胞再增殖体外模型以及数据库分析,探讨HMGB1 与肝癌再增殖之间的相关性与临床意义。
1 材料与方法
1.1 实验材料
胎牛血清购自Gibco 公司,0.25%胰蛋白酶、Lipofectamine 2000 购自Thermo Fisher 公司,RPMI-1640 和DMEM 高糖培养基购自GE Healthcare 公司,嘌呤霉素购自上海生工,荧光素酶底物(Dluciferin potassium)购自Promega 公司,质粒DNA 抽提试剂盒购自Omega 公司,甘草酸(Glycyrrhizin,Gly)购自于Santa Cruz Biotechnology 公司,本实验中所采用的质粒:plex-GFP-luc2、psPAX2、pMD2.G均由本课题组实验室构建保存。
1.2 实验方法
1.2.1 细胞培养本研究采用的Huh7 和Li7 人源肝癌细胞株均购自上海中科院,Huh7 选用DMEM高糖培养基培养,Li7 选用RPMI-1640 培养基培养,培养基均添加10% 胎牛血清、100 μg/mL 和100 U/mL 链霉素和青霉素。所有细胞均置于37 ℃、含5%CO2的恒温培养箱培养。
1.2.2 构建荧光素酶标记的报告细胞利用293T 工具细胞和Lipo2000 转染试剂盒按照说明书进行慢病毒包装[17]。将5×105个Huh7 和Li7 细胞分别铺于3.5 cm 培养皿中,待细胞贴壁后,以1∶1 将1 mL 包装好的慢病毒液和1 mL 10%完全培养基充分混合后加入培养皿继续培养细胞,24 h 后更换新鲜的10%完全培养基。若荧光显微镜下GFP 阳性的细胞超过30%则将细胞全部消化接种至10 cm 培养皿中,待生长汇合度达到70%左右,更换含有嘌呤霉素(2 μg/mL)的10%完全培养基进行筛选,筛选2~4 周,获得稳定表达Fluc-GFP 的Huh7 和Li7 作为报告细胞,分别命名为Huh7-Fluc 和Li7-Fluc 细胞。
1.2.3 利用小动物活体成像仪进行肿瘤细胞生物成像往铺有细胞的24 孔板或者96 孔板中加入荧光素酶底物(终浓度0.15 mg/mL),然后置入小动物成像仪中进行生物成像,检测荧光素酶活性。
1.2.4 验证细胞数量与荧光素酶活性之间的线性关系为了证明报告细胞的数量与其所表达的荧光素酶活性呈线性关系,将对数生长期的Huh7-Fluc和Li7-Fluc 细胞消化后计数,以250、500、750、1 000、1 200、1 500、1 750 和2 000 个铺于96 孔板中,每组设置3 个复孔,每孔加入100 μL 10%完全培养基。24 h 后待细胞贴壁后将24 孔板置于小动物活体成像仪中成像,并将所测得各组的光信号强度与报告细胞的数量进行统计学分析,为构建体外肝癌细胞再增殖模型提供基础。
1.2.5 构建肝癌细胞再增殖模型取对数生长期的肝癌细胞Huh7 消化后计数,按照1×105个/孔铺于24 孔板中,每组设置3 个复孔。24 h 后待细胞贴壁后,将24孔板置于Onor线性加速器(上海市第一人民医院放射治疗科,剂量率为3.6 Gy/min)中进行或不进行单次10 Gy 剂量X 射线照射处理,以此作为饲养细胞。次日,将Huh7-Fluc 细胞按照1 000 个/孔分别铺入饲养细胞所在的24 孔板中,另在空白孔中按照1 000 个/孔单纯接种报告细胞作为阴性对照。24 孔板以2%完全培养基每孔1 mL继续培养,隔天换液。培养6 d 后,进行细胞化学发光成像。Li7 肝癌细胞再增殖模型构建方法同Huh7。
1.2.6 使用HMGB1 抑制剂处理肝癌细胞再增殖模型肝癌细胞再增殖模型构建同前,对饲养细胞和报告细胞共培养组、报告细胞单独培养组均设立HMGB1 抑制剂Gly 处理组和对照组,均在每隔2 d更换2%完全培养基时加入。加药处理4 次后进行细胞生物成像。
1.2.7 TIMER2.0、GEPIA2 数据库分析TIMER2.0 是一个免费的交互式Web 服务数据库,其中Exploration 模块中的Gene_DE 可用于分析TCGA 数据库HMGB1 在肝癌与癌旁组织之间的表达差异[18]。登录此数据库网址(http://timer.cistrome.org),选择Exploration 中的Gene_DE,在Gene Expression 中输入HMGB1 即可获得HMGB1 在肝癌及癌旁组织中的表达差异。GEPIA2(gene expression profiling interactive analysis)即基因表达谱数据动态分析,是一个基于TCGA 与GTEx 转录组数据库建立的可视化癌症大数据分析平台。利用此平台对HMGB1 表达水平与肝癌患者生存预后的关系进行分析[19]。筛选条件设置为:⑴gene:HMGB1;⑵methods:overall survival;⑶ group cutoff:quartile;⑷ hazards ratio(HR):yes;⑸95% confidence interval:yes;⑹axis units:months;⑺datasets selection(cancer name):LIHC。
1.3 统计学处理
实验数据均采用SPSS 22.0 分析。数据以均数±标准差(±s)表示。相关性分析采用Spearman 等级相关分析,两组间均数比较采用Student'st检验,多组间差异的比较采用单因素方差分析,采用Kaplan-Meier 分析方法绘制生存曲线,Log-rank 检验来分析HMGB1 的表达与肝癌预后的相关性,P<0.05 为差异有统计学意义。
2 结果
2.1 稳定表达荧光素酶的肝癌细胞的数量与光信号强度呈线性相关
通过将所测得的各组化学发光信号强度与报告细胞数量进行统计学分析,结果显示稳定表达荧光素酶的Huh7-Fluc 和Li7-Fluc 细胞数量与光信号强度之间呈现出良好的线性关系,R2分别为0.989 9和0.990 1(图1)。因此,本实验通过成像检测化学发光信号强度来反映报告细胞的增殖情况,为构建体外肝癌肿瘤再增殖模型提供基础。

图1 报告细胞的数量与荧光素酶活性的线性关系A:Huh7-Fluc报告细胞的数量与荧光素酶活性呈线性关系;B:Li7-Fluc报告细胞的数量与荧光素酶活性呈线性关系Figure1 Linear relation between luciferase activity and reporter cell numbersA:Linear relation between luciferase activity of Huh7-Fluc and reporter cell numbers;B:Linear relation between luciferase activity of Li7-Fluc and reporter cell numbers
2.2 X射线照射处理后的肝癌细胞能够促进未照射的肝癌细胞发生肿瘤再增殖
将单次10 Gy 剂量X 射线处理或不处理的肿瘤细胞Huh7 和Li7 作为饲养细胞分别与相应的报告细胞Huh7-Fluc 和Li7-Fluc 进行共培养,6 d 后通过小动物成像仪进行成像,结果显示相对于单纯报告细胞组和未经X 射线处理饲养细胞组,X 射线处理后的饲养细胞对报告细胞的促生长作用更明显(均P<0.01)。表明X 射线照射后的肝癌细胞能够促进活肝癌细胞增殖,在一定程度上以体外模型的方式再现了临床上放疗过程中发生的肿瘤再增殖现象(图2)。
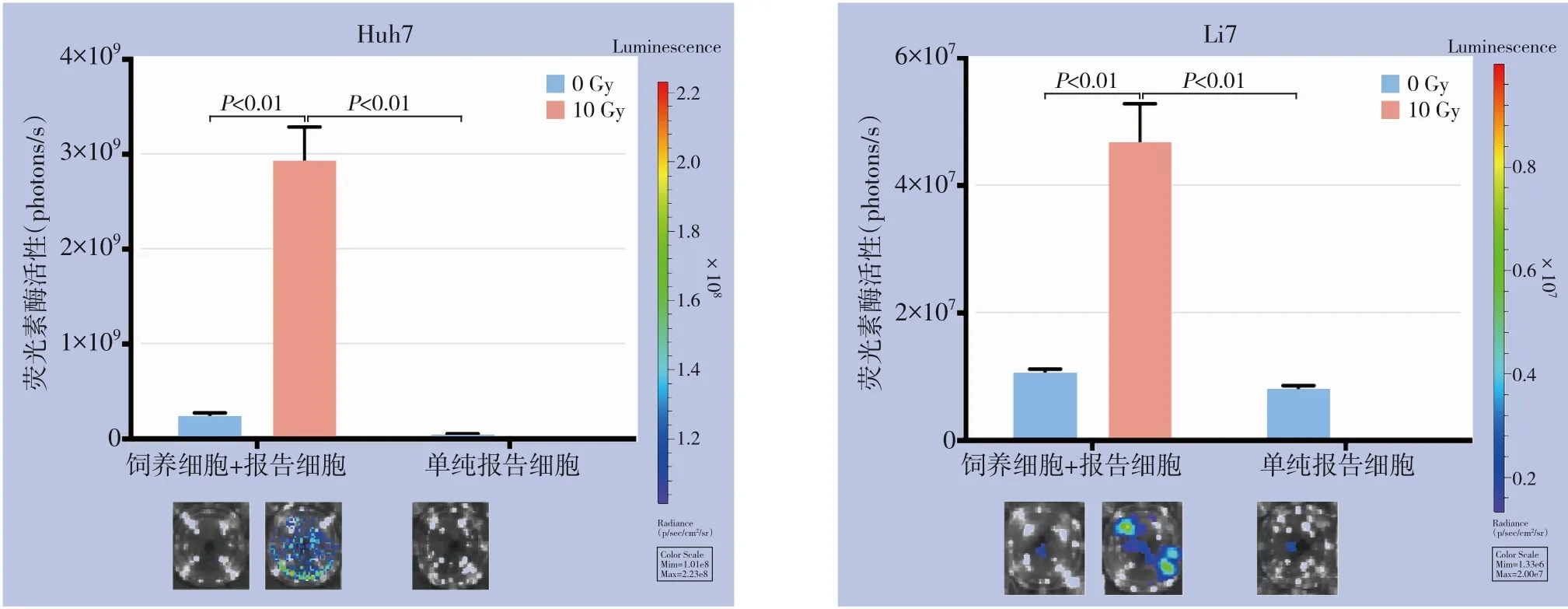
图2 各组报告细胞增殖检测Figure 2 Determination of growth of reporter cells in each group
2.3 抑制HMGB1可减弱X射线诱导的肿瘤再增殖
为了研究HMGB1 在X 射线诱导的肝癌细胞再增殖中的作用,在模型中加入HMGB1 抑制剂Gly,6 d 后通过小动物成像仪进行成像,结果显示加入HMGB1 抑制剂后X 射线处理后的饲养细胞对报告细胞的生长刺激作用明显减弱,但相同HMGB1 抑制剂浓度处理过的报告细胞并没有表现出明显的生长抑制,表明此浓度的HMGB1 抑制剂对于细胞本身无明显毒性作用,而对肝癌细胞再增殖模型却有明显的抑制作用,抑制剂浓度越高其对模型的抑制作用更明显(P<0.01),HMGB1 参与了X 射线诱导的肝癌再增殖的过程(图3)。
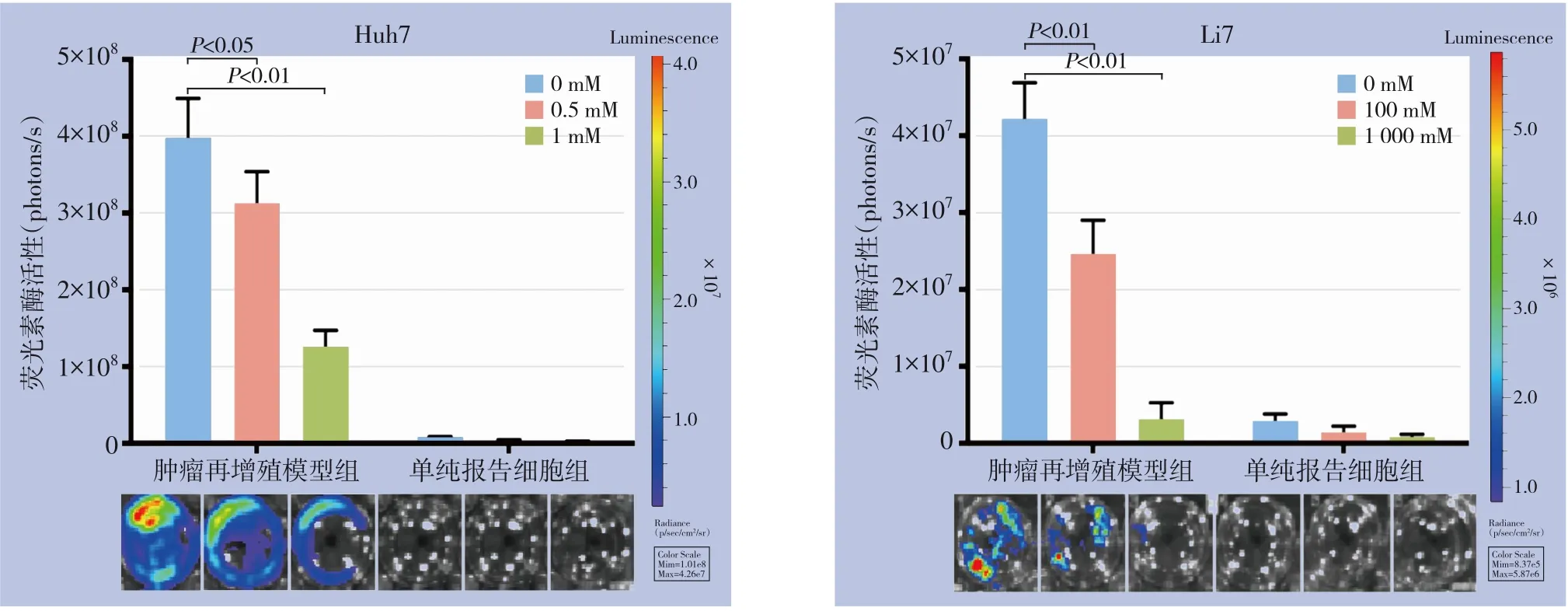
图3 HMGB1抑制剂Gly对报告细胞增殖的影响Figure 3 Effects of HMGB1 inhibitor Gly on reporter cells
2.4 TIMER2.0与GEPIA2数据库分析
利用TIMER2.0 数据库的数据集对HMGB1 基因在泛癌中的表达水平进行分析。结果显示HMGB1 在不同癌种中的表达水平不同,其中,在肝癌组织(LIHC)中其表达水平明显高于癌旁组织(P<0.01)(图4A)。
利用GEPIA2数据库的数据集进行在线生存分析。结果显示在肝癌中,HMGB1 基因高表达组(n=91)总生存期(overall survival,OS)较HMGB1 低表达组(n=91)更短(HR=1.8,P=0.022),差异具有统计学意义。表明HMGB1 的表达与肝癌的总生存期呈负相关(图4B)。而HMGB1 的表达与肝癌的无病生存期(disease free survival,RFS)无明显相关性(HR=1.5,P=0.059)(图4C)。
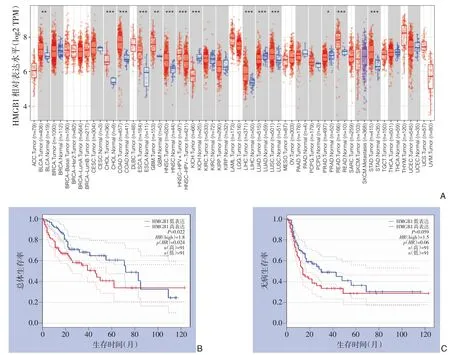
图4 HMGB1在肝癌组织中的表达水平以及与肝癌预后的相关性A:HMGB1在多种肿瘤中的表达情况;B-C:HMGB1的表达水平与肝癌预后关系Figure 4 The expression level of HMGB1 in liver cancer and the relationship between HMGB1 and prognosis of liver cancer patientsA:The expression level of HMGB1 in variety of cancers and adjacent normal tissue;B-C:The relationship be‐tween HMGB1 and prognosis of liver cancer patients
3 讨论
肝癌作为常见的消化道恶性肿瘤,早期缺乏特异性症状,确诊时往往处于晚期。尽管,随着目前综合治疗方式的更新和相应的临床试验的进展,晚期肝癌患者的生存预后已获得了一定的改善,但是肝癌复发仍是导致患者疾病进展的重要原因[20-22]。
肿瘤再增殖作为肿瘤复发的重要机制之一,目前人们对导致其发生的相关分子机制尚不完全了解[6]。本课题组长期从事肿瘤再增殖现象的机制研究,为了研究其中的调控机制,本研究构建了肿瘤再增殖模型,并成功在体外模拟了肿瘤再增殖这一过程,为后续研究提供了良好的模型基础[17]。在本研究中,首先构建了表达Fluc-GFP 的报告细胞,并成功利用肝癌细胞构建了肿瘤再增殖模型,明确了X 射线能够诱导肝癌细胞再增殖的发生,也进一步证实肿瘤再增殖这一现象的普遍性。
HMGB1 作为一种核蛋白,在细胞中表达丰度极高,仅次于组蛋白,在进化过程中高度保守且功能强大[23]。HMGB1 在分子结构上主要由2 个DNA 结合区域(HMG A box 和HMG B box)和1 个C端酸性尾端组成,已被证实在肿瘤的发生发展中具有双重作用[14,24]。已有研究[14]表明,HMGB1 的功能与其在细胞中的定位及翻译后修饰有关。在细胞核中,HMGB1 参与DNA 复制、修复、转录及维持基因组稳定等[25-26],在胞浆中,HMGB1 被认为是一种自噬的正向调控蛋白,能够与自噬蛋白Beclin-1 集合,诱导自噬发生[27]。而HMGB1 在细胞中的定位并不是一成不变,研究[23,28-30]表明,在生理或者病理状态下,HMGB1 能够通过主动或者被动的方式释放至细胞外,参与炎症、免疫、细胞生长、细胞死亡等生理病理过程。此外,在肿瘤中,HMGB1 对于肿瘤的作用主要由自身的氧化还原状态决定。研究[14]表明,还原型的HMGB1 主要对肿瘤生长起促进作用,而氧化型HMGB1 可以诱导肿瘤发生凋亡。另外,外源性HMGB1 能够通过细胞内吞的方式进入线粒体,诱导线粒体发生肿胀而引起细胞死亡。本课题前期研究[31-32]发现,放、化疗等细胞毒性治疗能够诱导肿瘤细胞释放HMGB1。在本研究中,通过在肝癌细胞再增殖模型中加入HMGB1 抑制剂Gly,观察抑制HMGB1 的表达和释放对肝癌细胞再增殖的影响。从结果可以发现,加入Gly 的肝癌细胞再增殖模型被显著抑制,表明HMGB1 参与了X 射线诱导的肝癌细胞肿瘤再增殖,HMGB1 有可能作为提高肝癌患者治疗效果和减少肝癌复发的潜在治疗靶点。
随着分子生物学技术的发展,肿瘤相关生物数据库使得高效分析基因测序数据成为可能,利用数据库的模块进行在线分析,是一种研究基因与肿瘤相关性的有效且便捷的方式。在本研究中,利用TIMER2.0 数据库检索,发现HMGB1 在绝大多数恶性肿瘤中呈高表达,其中在肝癌组织中表达水平明显高于癌旁组织。此外,本研究还利用GEPIA2 数据库对HMGB1 表达水平与肝癌患者预后的相关性进行分析,结果显示HMGB1 表达水平与肝癌患者的无病生存期无显著相关性,但是HMGB1 高表达的肝癌患者总生存期短,表明HMGB1 可能作为判断肝癌患者总生存期预后的潜在标记物。
综上所述,HMGB1 在肝癌组织中呈高表达,与肝癌患者总生存期预后负相关,同时,HMGB1参与了X 射线诱导的肝癌细胞再增殖过程,通过HMGB1 抑制剂Gly 能够显著抑制这一过程。虽然,HMGB1 调控肝癌细胞再增殖的具体分子机制尚未明确,HMGB1 抑制剂能否用于临床上预防放疗后肝癌复发,还需要进一步的深入研究,但本研究为理解和预防肝癌复发提供了新的思路。
