肝细胞癌微血管侵犯危险因素分析及术前预测列线图模型构建
2021-08-10邓家仲荚卫东
邓家仲,荚卫东
(安徽医科大学附属省立医院肝脏外科,安徽合肥230001)
肝细胞癌(hepatocellular carcinoma,HCC)是全世界范围内最常见的恶性肿瘤之一,是第三大癌症致死的病因[1]。由于HCC 早期临床症状并不明显,很多患者被确诊时已为中晚期,错过了最佳的治疗时间,行根治性手术切除术后5年复发率高达70%,即使行肝移植术仍有25%复发率[2-3]。微血管侵犯(microvascular invasion,MVI)是在显微镜下于内皮细胞衬覆的血管腔内见到癌细胞巢团[4]。大多数早期复发的患者最终病理提示MVI 阳性,因此MVI 常作为HCC 切除和移植术后复发的关键预测因素[5]。目前MVI 发生分子机制尚不明确,且只能通过病理学检查证实[6]。近年来,相关研究表明血清肿瘤标志物、炎症指标、血清蛋白标志物、微小RNA 等实验室检查可作为MVI 的预测因子,另外CT、磁共振、放射组学等影像学方法对术前MVI 的预测也有较好的效果[7-8]。然而,目前仍缺少能够有效预测HCC 患者MVI 并在临床上广泛普及的方法。
术前有效预测MVI 对HCC 患者的临床决策、术后辅助治疗和全面的预后评估具有重要的临床价值。本研究希望通过回顾分析安徽省立医院2017年1月—2020年11月入院行根治术的535 例HCC 患者术前的相关临床指标和影像学资料,研究旨在探讨MVI 的危险因素,并根据术前危险因素建立术前预测HCC 患者合并MVI 的列线图模型,以期指导临床实践。
1 资料与方法
1.1 临床资料
回顾分析安徽省立医院2017年1月—2020年11月入院行肝癌根治术的535 例HCC 患者的临床资料,男447 例(83.6%),女88 例(16.4%)。按入院时间将2017年1月—2019年12月433 例HCC患者归为模型组,2020年1月—2020年11月102 例HCC 患者归为验证组。纳入标准:⑴行肝切除手术且术后病理诊断为HCC;⑵术前未行肝癌相关治疗如:肝脏手术、介入治疗、放射治疗、化学治疗、靶向治疗等;⑶术前Child-Pugh 分级为A 或B 级;⑷临床病理资料完整。排除标准:⑴合并有其他非HCC 恶性肿瘤;⑵近期存在感染性疾病;⑶有明显出血史患者;⑷有血液系统疾病的患者;⑸合并门脉癌栓。本研究已通过安徽省立医院伦理委员会审批。
1.2 观察指标
⑴一般资料:性别、年龄、肝硬化、乙肝或丙肝感染等。⑵术前实验室检验:中性粒细胞绝对值、淋巴细胞绝对值、血小板计数、纤维蛋白原、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、谷氨酰转移酶(GGT)、甲胎蛋白(AFP)、lgAFP(将AFP 进行以10 为底的对数转换)、白蛋白(ALB)、乙肝病毒脱氧核糖核酸(HBV-DNA)等。⑶炎症比值指标:纤维蛋白原/白蛋白比值(FAR)、中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)。⑷术前影像学检查:肿瘤大小取CT 或磁共振最大肿瘤直径;肿瘤数目;完整假包膜为在增强CT 或MRI 上表现为门静脉期或延迟期HCC 边缘完整环形强化影,无完整假包膜包括除外完整假包膜的所有病例。
1.3 统计学处理
数据用IBM SPSS 24.0 和R4.1.0 软件处理。连续变量表示为平均值±标准差,分类变量表示为频率。利用受试者工作特征(receiver operating characteristic curve,ROC)曲线,通过计算Youden指数的最大值确定各指标对MVI 预测的最佳临界值。单因素的分析计量资料采用t检验,计数资料应用χ2检验进行分析得出结果差异预测因素,多因素Logistic 回归模型方法采用逐步向前法,分析HCC 患者发生MVI 的独立危险因素,使用比值比(OR)和95%可信区间(CI)评价其相关性。并使用R4.1.0 软件根据多因素分析结果建立列线图模型,使用一致性指数(C-index)为了量化列线图的辨别力,并使用带有1 000 个自举样品的校准曲线和外部验证来测量列线图的准确性。通过Youden 指数确定模型预测MVI 的最佳临界值及对应敏感度、特异度。P<0.05 为差异有统计学意义。
2 结果
2.1 模型组预测HCC 患者MVI 各项指标的最佳临界值
利用ROC 曲线确定预测MVI 的最佳临界值,中性粒细胞绝对值>2.895×109/L、淋巴细胞绝对值>1.215×109/L、纤维蛋白原>3.355 g/L、NLR>2.282、PLR>138.47、FAR>0.0751。本研究中GGT>60 IU/L、ALT>50 IU/L、AST>45 IU/L,指标界值采用安徽省立医院实验室检查正常范围上限。
2.2 模型组HCC患者MVI的危险因素分析
本研究模型组共纳入433例HCC患者,男363例,女70例;年龄26~86岁;HCC单发370例,多发63例;肿瘤直径(5.87±3.27)cm。术后病理提示223 例(51.5%)患者MVI 阳性,210 例(48.5%)患者MVI阴性。单因素分析(表1):年龄≤60 岁、中性粒细胞绝对值>2.895×109/L,纤维蛋白原>3.355 g/L、GGT>60 IU/L、ALT>50 IU/L、AST>45 IU/L、NLR>2.282、PLR>138.47、FAR>0.0751、lgAFP、肿瘤大小、无完整假包膜与MVI 相关。采用逐步向前法对上述指标进行多因素Logistic 回归分析结果显示(表2):NLR>2.282(OR=1.864,95%CI=1.184~2.933)、GGT>60 IU/L(OR=2.554,95%CI=1.631~4.001)、lgAFP(OR=1.455,95%CI=1.21~1.75)、肿瘤大小(OR=1.177,95%CI=1.084~1.277)、无完整假包膜(OR=2.019,95%CI=1.286~3.171)是MVI发生的独立危险因素。

表1 HCC患者术前预测MVI的单因素分析Table 1 Univariable analysis of MVI presence based on preoperative data

表2 术前预测MVI的多因素分析Table 2 Multivariate analysis of MVI presence based on preoperative data
2.3 建立列线图模型并验证
根据模型组多因素Logistic 回归分析的结果,将NLR>2.282、GGT>60 IU/L、lgAFP、肿瘤大小、无完整假包膜这5 个预测因子纳入术前预测HCC 患者合并MVI 的列线图模型。构建好列线图后将数据纳入模型,每个指标的数值对应相应得分,每个指标分数相加得到总分,后将总分根据列线图转化为MVI 的预测概率(图1)。
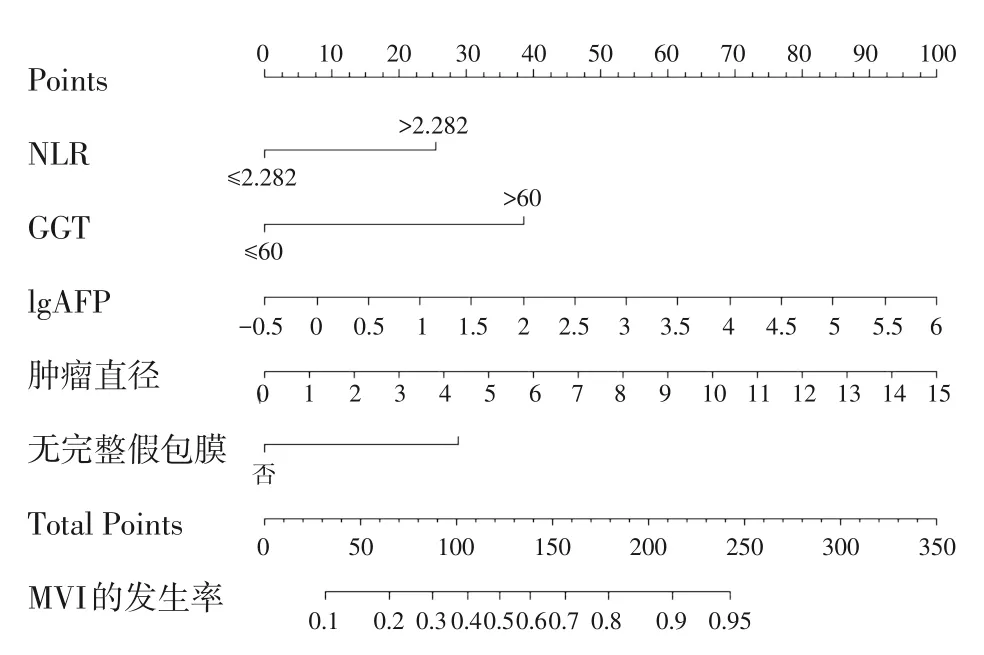
图1 预测HCC患者MVI风险的列线图Figure 1 Nomogram for preoperative prediction of the risk of MVI in HCC
2.4 模型组与验证组的校准曲线
自动抽样法随机抽样1 000 次进行内部验证,利用验证组数据进行外部验证,模型组与验证组校准曲线中标准曲线与校准预测曲线基本贴近(图2),表示根据该模型得出的MVI 的预测值与实际情况一致性良好。

图2 校准曲线A:模型组;B:验证组Figure 2 Calibration curvesA:Model group;B:Validation group
2.5 ROC曲线分析列线图的预测价值
计算得出模型组的一致性指数为0.785(95%CI=0.742~0.828)(图3A),验证组的一致性指数为0.824(95%CI=0.737~0.91)(图3B)。通过Youden指数计算出列线图最佳的总分截断值103,总分在这之上的划分为MVI 高风险人群,在这之下的划分为MVI 低风险人群。临界值下的敏感度、特异度、阳性预测值和阴性预测值在模型组分别为86%、61%、67%和82%,在验证组中分别为82%、56%、53%和83%(表3)。
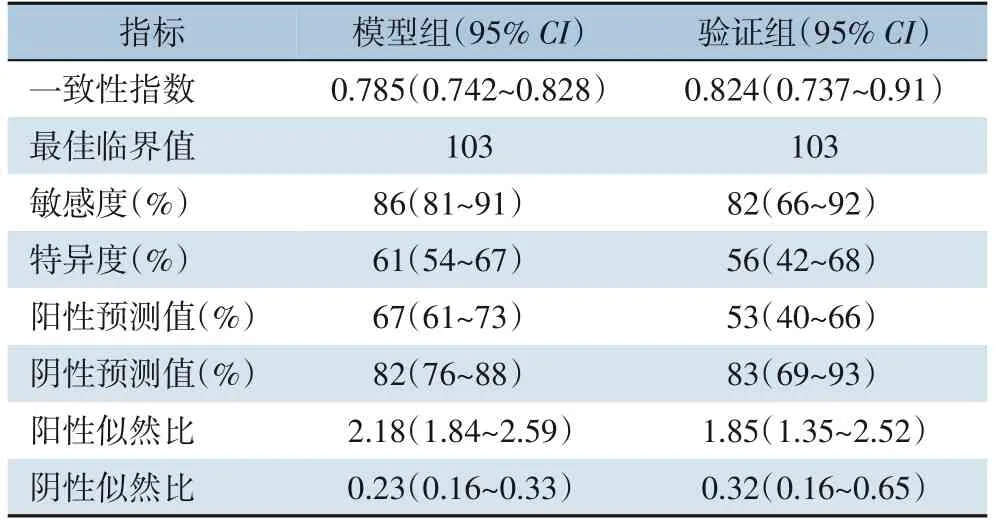
表3 列线图预测HCC患者合并MVI的准确性Table 3 Accuracy of the nomogram in predicting HCC patients with MVI

图3 ROC曲线A:模型组;B:验证组Figure 3 ROC curvesA:Model group;B:Validation group
3 讨论
微血管侵犯已是公认的HCC 患者不利的预测因子。随着认识的不断加深,其临床意义越来越被重视[9],是肝癌治疗方案选择、评估复发风险、推测患者预后的重要参考依据[8,10]。在指导是否进行肝移植术,解剖性肝切除术,扩大手术切缘及新辅助化疗中有着重要的临床价值[11-14]。然而,国内外对MVI 的术前预测仍没有统一的方案或标准。
Zeng 等[15]通过Meta 分析得出术前较高的NLR水平与肝细胞癌微血管浸润的风险呈正相关。本研究中通过对HCC 患者术前的相关炎症指标进行分析,发现NLR>2.282(OR=1.976,95%CI=1.264~3.090)是HCC 患者发生MVI 的独立危险因素,这与任家书等[16]的研究结果一致。肿瘤相关中性粒细胞和肿瘤浸润性淋巴等组分是肝癌免疫微环境的组成部分,在肝癌进程和免疫逃逸等过程中发挥着重要作用[17]。炎症不仅可以影响肿瘤的微环境,同时还可以促进血管侵犯[18]。炎性细胞在其中发挥着重要作用,其可以增加肿瘤周围的生长和生存因子,促进血管和淋巴管生成使肿瘤进展[19]。
GGT 是临床中常见的反映肝细胞损伤的指标,但因其特异度比较低很容易被忽略。本研究中,血清GGT>60 IU/L(OR=2.554,95%CI=1.631~4.001)与MVI 密切相关,这可能与肿瘤栓子的细胞将GGT 直接分泌到血液中有关[20]。GGT 是否与MVI 有关仍存在一定争议。Zhao 等[21]证实,血清GGT 水平与HCC 患者的长期生存和血管侵袭有关,并将GGT>130 IU/L(OR=19.779,95%CI=5.888~66.440)作为MVI 的术前预测因子。然而在梁志银等[22]的研究中,GGT>30 IU/L 虽然在单因素分析中有统计意义(OR=1.672,95%CI=1.102~2.537),在多因素研究中对MVI 的预测并不能发挥作用,这可能与截断值和其他预测因子不同有关。
此外,本研究中还发现lgAFP(OR=1.455,95%CI=1.21~1.75)是MVI 的独立危险因素。血清AFP 作为预测早期MVI 的重要血清学指标已得到广泛认可,但不同研究者AFP 截断值存在差异,以AFP 为20 μg/L[23]、100 μg/L[11]、或400 μg/L[21]为截断值,对MVI 均有较好的预测效能,在本研究中通过对AFP 进行对数转换后能有较好的检验效能。
多项目研究[11,24]证实肿瘤直径和MVI 的发生是密切相关的,本研究单因素及多因素分析显示肿瘤大小是MVI 的独立危险因素,随着肿瘤直径增大MVI 发生的风险也会随之增加。这可能是由于肿瘤血管为肿瘤生长提供营养,改变免疫微环境,加速肿瘤的恶性进程[25]。肝癌肿瘤直径越大,MVI的发生几率及发生转移的可能性越来越高,其预后也越差[26]。
假包膜是肝脏肿瘤膨胀性生长压迫到正常肝脏组织时,正常肝脏边缘发生纤维结缔组织增生。在本研究中发现无完整假包膜(OR=2.019,95%CI=1.286~3.171)是MVI 发生的独立危险因素。Zhu等[27]通过一项纳入了2 038 例患者的Meta 分析指出完整的假包膜可能是HCC 患者发生MVI 的保护因素,不完整的假包膜是危险因素。Wang 等[28]的一项纳入469 例HCC 患者的回顾性研究发现假包膜不完整或无假包膜是预测MVI 的独立危险因素,并且与患者预后相关,本研究进一步验证了上述观点。
单个因素预测MVI 往往存在敏感度和特异度相对较低等问题,通过临床模型的建立可很好的综合各个因素的优势,为临床提供更有价值的预测方案。Cucchetti 等[29]通过术前AFP 水平、肿瘤数目、大小和体积这4 个指标建立的人工神经网络可有效预测MVI 的发生,因其需要特定的软件实现,存在临床使用不便的缺点。Zhao 等[21]以AFP>400 μg/L、GGT>130 U/L、肿瘤总直径>8 cm、肿瘤数目>3 个为预测因子建立预测MVI 的评分系统,虽特异度较高,但该研究纳入的样本量较小。Lei 等[30]发现肿瘤直径、数量、包膜、AFP、血小板、HBV-DNA 载量和典型影像学动态变化图像这7 个因素跟肝癌MVI 的发生相关,以此建立了预测MVI 的列线图模型,其敏感度、特异度分别为73.5%、76.6%,但仅对乙肝相关患者适用。黄晨军等[31]通过年龄、血小板、白蛋白、lgAFP、AFP-L3、lg(异常凝血酶原)6 个指标构建诊断模型敏感度、特异度分别为72.70%、62.00%,然而Logistic回归方程运算复杂,不方便临床应用,且其预测的特异度相对较低。本研究中,分析得出NLR>2.282、GGT>60 IU/L、lgAFP、肿瘤大小、无完整假包膜是HCC 患者合并MVI 的术前预测因素。结合多因素分析结果建立了预测MVI 的列线图模型,敏感度、特异度、阳性预测值和阴性预测值在模型组分别为86%、61%、67%和82%,对术前预测HCC 患者是否合并MVI 有一定的甄别能力,与其他模型相比,该模型有较高的敏感度,但特异性相对较低,仍需进一步改进。本研究中各项指标在临床中较易获得,使用方便,具有一定的临床实用价值。同时,本研究仍存在不足之处,本研究为单中心回顾性研究,病例选择上存在偏倚,研究中纳入的术前临床资料相对有限,缺乏其他中心资料进行外部验证来进一步判断预测模型的临床实用价值,所建立的模型特异度上较低,急需开发准确度更高的特异性检测指标。
综上所述,本研究通过临床常用指标分析,基于NLR>2.282、GGT>60 IU/L、lgAFP、肿瘤大小、无完整假包膜建立预测MVI 的列线图模型有一定的预测效能,可直观的预测MVI 的发生风险,甄别出高风险人群,对指导临床方案有一定的实际意义。
