肝癌外科治疗理念的革新与挑战
2021-08-10肖亮周乐杜
肖亮,周乐杜
(中南大学湘雅医院普外肝脏外科,湖南长沙410008)
原发性肝癌是严重威胁我国人民健康和生命的主要癌症之一,其中3/4 以上的病例为肝细胞癌(hepatocellular carcinoma,HCC)(以下简称肝癌)[1]。2020年,肝癌高居我国恶性肿瘤发病率第5 位,病死率第2 位[2]。《“健康中国2030”规划纲要》提出:到2030年,总体癌症5年生存率提高15%。为实现这一目标,肝癌防治领域还有大量的工作需要开展。根治性切除手术或肝移植是肝癌患者获得长期生存的最有效方法。但学术界对于采用何种手术方式(腹腔镜还是开放手术,解剖性还是非解剖性切除)仍有争议。另外,随着近年来多种靶向和免疫药物的问世,肝癌的新辅助治疗,转化/降期治疗,术后辅助治疗,无疾病证据(no evidence of disease,NED)状态这些概念被逐步提及并引起重视,为改善肝癌患者的长期预后带来了新的希望。国内各临床中心也有不少术前转化治疗成功的案例报道,国内外也有多项肝癌的辅助治疗临床研究正在积极开展之中。本文聚焦目前肝癌外科治疗理念的革新与挑战,以期为肝癌的临床研究提供思路与参考。
1 腹腔镜还是开放肝切除?
自1991年腹腔镜肝切除手术(laparoscopic hepatectomy,LH)问世以来[3],经过30年的发展,LH 的安全性和有效性已经得到广泛验证[4-7]。相对于传统的开放手术,LH 具有切口小,手术创伤小,出血量少,恢复快,术后并发症少,住院时间短等优点[8]。我国的LH 发展迅速,已经成为世界腹腔镜肝脏外科的领跑者之一。董家鸿院士主编的《腹腔镜肝切除术治疗肝细胞癌中国专家共识(2020 版)》[9]推荐对于直径不超过5 cm 的肝癌,首选LH;对于5~10 cm 甚至更大的肝癌,经严格病例选择后在有经验的医疗中心也可开展LH,有相当的肿瘤学效果,且具有近期疗效优势。
但是,LH 的实施策略完全不同于传统的开放手术,后者常在术中通过双手的触摸协助定位肿块,方便确定或更改手术范围,且在紧急情况下,开放手术止血更为快捷、方便;而LH 缺少双手对肿块的直接触感,术中不便临时更改手术方案(特别是在肿块位置深,未突出肝脏表面时)。这就要求在术前制定好手术规划。笔者推荐术前经过细致的三维影像学评估,事先计划好需要离断哪几根血管,形成什么手术切面,才能达到既能完整切除荷瘤肝组织,又能在生理上最大限度保证有效的(即流入、流出道完整)剩余肝组织的目的[9],术中按此规划实施“定制的手术”。有时为了保证安全的肿瘤学切缘,LH 还必须借助术中超声或荧光腹腔镜定位肿块,这也对手术器械提出了更高的要求,制约了其在基层医院开展。另外,LH 的手术难度高于开腹手术,需要较长的学习曲线,而在这一过程中,由于经验的欠缺,可能会发生肿块切缘不够,影响手术效果的情况发生。以上这些LH 的局限性,也是被不少医生,特别是习惯开放肝切除的医生所诟病之处。然而,我们必须预见到,微创手术是大势所趋,不可阻挡,它不仅是医生对自身手术技术的更高要求,也是患者对医疗质量的更高要求。手术技术上的缺陷不难弥补,治疗理念上的转变才是最难,也是最为关键的。以上提到的这些LH 的局限性可以通过循序渐进的手术训练,术前审慎选择病例和规划手术方案,术中认真细致地手术操作克服。但必须在保证患者安全的前提下,充分评估手术难度,由有经验的医师开展[9]。
2 解剖性还是非解剖性肝切除?
按照幕内雅敏教授的观点,解剖性切除(anatomic resection,AR)是指系统性地沿门静脉将一个肝段及其所属门静脉分支支配的区域连同动脉等一并切除,包括肝叶,肝段和亚肝段的切除。具体包括4 个步骤:⑴通过血流阻断或染色法标记肝表面的肝段边界;⑵超声引导下以该肝段标志性静脉为边界进行肝实质离断;⑶肝断面暴露具有重要意义的肝静脉;⑷肝蒂根部附近结扎Glisson 系统[9]。非解剖性切除(nonanatomic resection,NAR)是指切除肿瘤及其周边一定距离内的肝组织,不考虑肝叶肝段的肝切除。
通常,能否实施肝脏手术,主要取决于3 个方面:患者的全身情况,肝功能情况和肿瘤情况。且对于伴有肝硬化的患者,残肝体积至少要在40%以上(对无肝硬化患者,可放宽到30%)。这是因为剩余肝脏越少,术后发生肝衰的风险就越大。因此,外科医生在不知不觉中会多保留一些非肿瘤肝组织,做肿块的局部切除,也即NAR。这在保证患者术后顺利恢复的同时,也带来了肿瘤切缘不足的风险。另外一个支持AR 的原因是肝癌常伴有微血管侵犯(microvascular invasion,MVI),它是显微镜下在内皮细胞衬覆的血管腔内的癌细胞巢团。MVI 可分为M0、M1(不超过5 个MVI,或MVI 发生于近癌旁肝组织区域/≤1 cm)和M2,其中,M2(>5 个MVI,或MVI 发生于远癌旁肝组织区域/>1 cm)为肝癌早期复发的高危因素[10]。由此可见,即使行切缘>1 cm 的宽切缘NAR,也有可能没有完全清除MVI,从而留下术后早期复发的隐患。AR 理论上切除了更多的肝组织,能够在最大程度上减少MVI 的残留,其肿瘤学效果将优于NAR[11]。但是,MVI 是术后的病理诊断,难以在术前指导制定手术方案。近年来,术前MVI 的预测方法已经成为该领域的研究热点[12-15]。笔者研究发现,术前ctDNA 可以有效预测MVI 的发生风险[16],这类患者采用AR 似乎更为合理[11,16]。其他研究者发现,术前AFP 高、肿块数目多、直径大[17]、边界不光滑、镶嵌结构等影像学特点也与MVI 正相关[14,18]。因此在肝功能和残肝体积足够的情况下,针对这些有高危因素的患者,推荐行AR,以获得更安全的肿瘤学切缘。
但是,如果肿瘤的位置临近需要保留的大血管,即使行AR,也可能是窄切缘的手术,肿瘤学效果可能和NAR 相当。这类患者可考虑从先行术前新辅助治疗,待肿块缩小或降期后手术。另外,对于这种情况,还有一个值得思考的问题是,如果在NAR 后采用术后辅助治疗(术区放疗或靶向、免疫药物)预防肿瘤复发,是否可达到和先降期治疗后再行AR 相当的效果?也就是说在靶向免疫时代,AR 是否仍为首选?哪种处理方案更优?这些问题还有待进一步临床研究的验证。笔者所在中心及东方肝胆外科医院、中山大学第一附属医院的回顾性研究均表明:术后病理证实MVI 的患者服用索拉菲尼或联合经肝动脉化疗栓塞(TACE)[19-21]可有效延长无瘤生存期和总生存期,初步揭示了对合并MVI 的肝癌患者行术后辅助治疗的价值。
3 肝癌的辅助治疗
对于有高复发风险(CRS 评分3~5 分)的初始可切除肝转移性结直肠癌,围手术期辅助化疗的价值已被认可[22-23],因其能提高手术根治性切除率[24],改善患者预后。但是,由于传统静脉化疗效果欠佳,肝癌辅助治疗的地位不高,长期以来局限于围手术期的护肝治疗、抗病毒治疗、TACE治疗和中医药治疗。
随着近年来多种靶向药物和免疫检查点抑制剂的出现,对肝动脉灌注化疗(HAIC)和术前癌栓放疗的再认识,为肝癌的围手术期辅助治疗打开了崭新的局面。具体而言,肝癌的辅助治疗可分为新辅助治疗,转化治疗/降期治疗以及术后辅助治疗。新辅助治疗是指对于初始可切除的肝癌患者,但可能存在术后较高复发风险,术前采用一段时间的局部或系统治疗再行手术治疗,以期改善预后。转化治疗是对初始不可切除或交界性可切除的患者实施术前治疗,达到可手术条件时再予切除[25]。降期治疗也属于术前治疗,但转化治疗不等同于降期治疗,比如CNLCIIIa 期肝癌(合并门静脉癌栓VP3/4)经治疗后门静脉癌栓退缩至分支(VP1/2),虽然没有降期,但已达到转化切除目的;同样一些肝癌患者经术前治疗后虽然成功降期(例如肿瘤从IIIa 期降到IIb 期),但可能因肝功能欠佳或残肝体积不够,仍达不到手术条件,无法手术切除,转化治疗失败。
对于初始可切除的肝癌,目前不少研究探索了新辅助治疗的价值。2020年ASCO 报道(未发表数据)一项新辅助治疗的研究,入组可切除的肝癌患者30 例,术前使用3 周期的纳武利尤单抗联合伊匹木单抗或纳武利尤单抗单药治疗,术后发现病理完全缓解(pCR)率达24%(联合组3 例,单药组2 例),主要病理缓解率达16%(联合组2 例,单药组1 例),没有导致手术推迟或取消的毒性反应发生。该研究整体40%的病理缓解率为免疫治疗在可切除肝癌中的新辅助治疗奠定了基础。2021年ASCO 报道一项国内的III 期随机对照临床试验,发现新辅助FOLFOX 方案HAIC 可改善超出米兰标准的BCLC A/B 期患者的预后,HAIC 组99 例患者的客观缓解率(ORR)63.6%,疾病控制率(DCR)96.0%,88 例(88.9%)患者行肝切除术。HAIC 组患者的总生存期(OS)和无进展生存期(PFS)均显著优于单纯手术组,而且术前HAIC 能降低MVI 的发生[26]。另一项国内的前瞻性单臂II 期研究发现,18 例卡瑞丽珠单抗(200 mg,1 次/2 周×3 个周期)联合阿帕替尼(250 mg,1 次/d×21 d)用于可切除肝癌术前治疗后ORR 为16.7%(RECIST v1.1)和44.4%(mRECIST),1 例疾病进展;17 例接受手术,其中5 例达到主要病理缓解,1 例达到pCR,安全性可控。中位随访5.7(0.7~9.0)个月,中位无复发生存期(RFS)未达到[27]。这些振奋人心的研究结果可能改写将来可切除肝癌的治疗模式。
《原发性肝癌诊疗规范(2019 版)》[10]提出,对于不可切除肝癌,术前TACE 和放疗有可能使肿瘤降期从而得到手术的机会,从而开启了转化治疗研究的大门。2021年6月,樊嘉院士主编的《肝癌转化治疗中国专家共识》[25]发布,将技术上不可切除的CNLC Ia、Ib、IIa 期肝癌和肿瘤学不可切除的IIb、IIIa 期肝癌定义为交界性可切除肝癌,鼓励积极探索术前转化治疗,以期改善患者预后。而对于技术上不可切除的IIb、IIIa 期患者,提出积极的系统+局部治疗,也可能使部分患者获得手术机会。笔者中心也有不少IIb、IIIa 患者经过积极的术前转化治疗后,肿瘤缩小/降期达到手术条件,从而接受了根治性手术,甚至有几例达到pCR(未发表数据)。
术后辅助治疗是对有复发因素的患者实施的治疗,以降低肿瘤复发风险,延长生存期。例如传统的抗乙肝病毒治疗和槐尔颗粒[10,28]。复旦大学中山医院进行的一项开放性、随机对照III 期研究,纳入280 例具有中危(单个肿瘤>5 cm 且无MVI)、高危(单个肿瘤合并微血管侵犯或多发肿瘤)复发风险的乙肝相关肝癌患者。随机分为术后辅助TACE 组(n=140)和对照组(n=140)。术后TACE治疗的患者3年OS(85.2%vs.77.4%,P=0.04)和RFS(56%vs.42.1%,P=0.01)显著高于对照组[29]。另一项回顾性研究纳入2005年5月—2010年5月接受根治性肝切除术的85 例肝癌患者。其中42 例在根治性肝切除术后接受了2 次HAIC(5-氟尿嘧啶1 000 mg/m2,奥沙利铂85 mg/m2和丝裂霉素-C 6 mg/m2),43 例仅接受根治性肝切除术(对照组)。HAIC 组OS 和RFS 显著高于对照组[30]。LANCE 研究(未发表数据)前瞻性纳入根治术后高危复发肝癌患者(大血管或胆管侵犯/肿瘤破裂或浸润邻近器官/II 级MVI 且合并以下中任何一项:肿瘤数目≥3 个、肿瘤最大径≥8 cm、肿瘤边缘不清晰或无完整包膜),发现仑伐替尼+TACE 治疗组的中位DFS为12.0 个月,较单纯TACE 组显著延长(8.0 个月,P=0.035 9)。目前,还有多项免疫单药或靶向免疫联合治疗用于肝癌术后辅助治疗的研究正在开展中,期待有让人振奋的结果出现。
但是,肝癌的辅助治疗有以下问题值得进一步探讨:⑴术前如何准确筛选/预测辅助治疗最适合/收益最大的患者,避免无效用药及加重患者经济负担,甚至丧失手术机会?⑵哪种辅助治疗方案转化效果最佳,对患者全身及肝功能、手术操作影响最小?⑶术前辅助治疗最佳的疗程是多久?⑷对于IIb、IIIa 期交界性可切除肝癌,先行转化治疗再手术还是先手术再加上辅助治疗,哪一种方案的长期效果更好?⑸如何避免积极的术后辅助治疗,造成严重的全身或者肝脏不良反应,从而降低肝癌复发后的再次手术或者局部治疗的安全性,甚至失去再次治疗机会?⑹术后辅助靶向、免疫治疗后肿瘤复发,是否会缩窄复发肿瘤用药的选择范围?⑺术后辅助治疗的终止时间没有高级别循证医学证据指导,短期用药后停药是否引起肿瘤复发?这些都是未来的探索方向。
4 NED状态
NED 是指肿瘤患者通过治疗后,使用现有检测方法未发现肿瘤残留的迹象,表示现阶段可发现的肿瘤已经从患者体内完全清除,与完全缓解同义。这个概念最初于2016年ESMO 转移性结直肠癌共识指南[24]中提出,《中国结直肠癌肝转移诊断和综合治疗指南(2018 版)》[31]将肠癌肝转移的治疗目标由R0切除转变为NED。这一状态的持续维持,被认为可转化为患者的生存获益。
目前,基于肝癌辅助治疗展现的良好疗效,有学者将NED 的理念移植到肝癌的治疗中,这将在一定程度上改变肝癌的治疗策略,采取更为积极的外科处理。例如:对于CNLC IIb 期的患者,《原发性肝癌诊疗规范(2019 版)》[10]推荐优选TACE 治疗,但在NED 治疗理念的指导下,外科医生可以通过多种手段,如手术结合射频消融甚至放疗,先将所有肝内病灶完全清除,然后辅以术后治疗以维持NED 状态;对于CNLC IIIa 期甚至是有肝外转移(肺部或腹腔种植转移,全身多处淋巴结转移)的IIIb 期患者,《原发性肝癌诊疗规范(2019 版)》[10]将TACE 和系统治疗放在前两位推荐,手术放在第三位或不做推荐。但在NED 的治疗理念指导下,也可考虑积极的术前治疗,再加上外科处理,将患者体内所有影像学可见病灶完全清除,然后辅以术后治疗以尽量维持NED 状态(图1)。只要NED 状态持续的时间足够久,就可能转化为患者的生存获益。
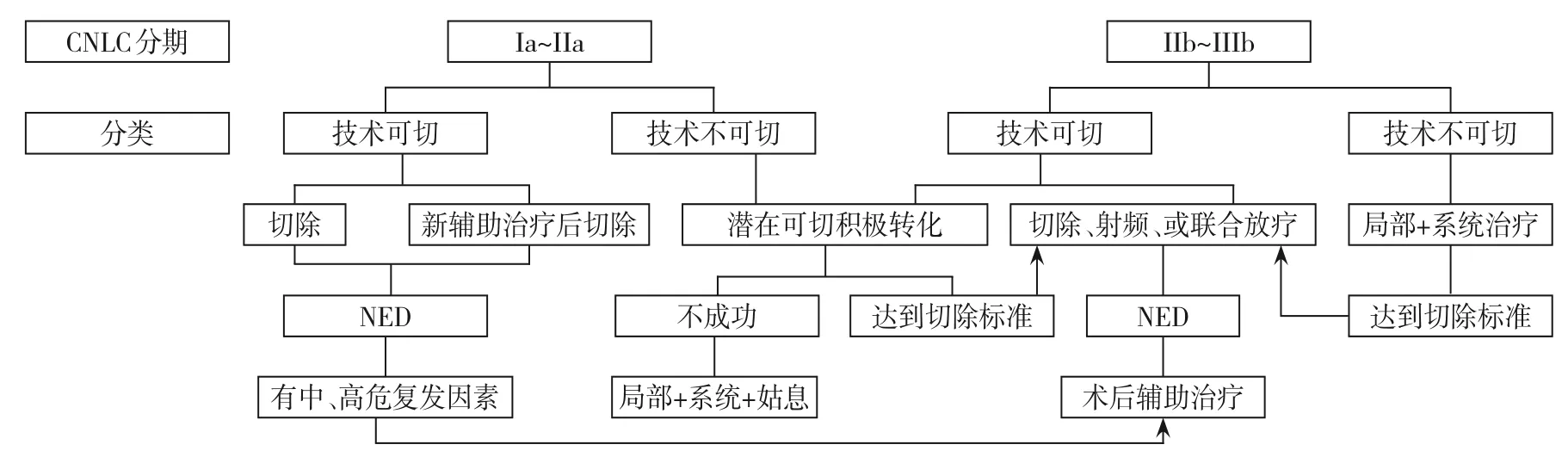
图1 基于NED的肝癌治疗策略路线图技术可切,技术不可切,潜在可切,新辅助治疗,转化治疗等概念同《肝癌转化治疗中国专家共识(2021版)》[25];中、高危复发因素:有MVI或多发肿瘤或肿瘤直径≥5 cm[19-21,29]Figure 1 Flow diagram NED-based treatment strategy for liver canerConcepts of technically resectable,technical unresect‐able,potentially resectable and conversion therapy are same as those in Chinese expert consensus on conversion therapy in hepatocellular carcinoma(2021 edition)[25];intermediate and high-risk of recurrence:presence of MVI or multiple tumors or diameter of tumor ≥5 cm[19-21,29]
当然,以上基于NED 的治疗策略还只是猜测,其基础是肝癌辅助治疗手段的进步,它可能进一步拓展外科治疗的适应证。它的实施有赖于各中心多学科诊疗团队的讨论制定“个体化”的治疗方案,其合理性更需要大样本、多中心、前瞻性的III 期临床研究的证实。肝癌的NED 状态维持预计将在未来几年内成为研究热点。
5 肝癌肝移植适用人群的扩展
国际上经典的肝癌肝移植适应证有Milan 标准(单个肿瘤直径不超过5 cm,或肿瘤数目不超过3 个,最大直径不超过3 cm;不伴有血管及淋巴结的侵犯),UCSF 标准(单个肿瘤直径不超过6.5 cm,或肿瘤数目不超过3 个,最大直径不超过4.5 cm,总的肿瘤直径不超过8 cm;不伴有血管及淋巴结的侵犯)。我国专家经过潜心研究,提出了更适合中国国情的杭州标准(肿瘤直径≤8 cm,或肿瘤直径>8 cm 且术前血清甲胎蛋白≤400 ng/mL 及肿瘤组织学分级为高、中分化;无大血管侵犯、淋巴结转移及肝外转移)和上海复旦标准(单发肿瘤直径≤9 cm,或多发肿瘤≤3 个,且最大肿瘤直径≤5 cm,全部肿瘤直径总和≤9 cm,无大血管侵犯、淋巴结转移及肝外转移)[32],弱化了肿瘤大小的限制,扩大了肝癌肝移植的适用人群。但以上标准都将肝癌的门静脉或肝静脉侵犯列为禁忌证,可以说,没有大血管侵犯是肝癌肝移植的底线。但在靶向免疫时代,国内不少学者通过积极术前转化治疗,如靶向药物联合PD-1 单抗、HAIC 及放疗等手段,待癌栓消除,肿瘤缩小降期达到前述标准后再行肝移植,术后继续使用靶向药物预防肿瘤复发,也取得了不错的近期效果,远期效果仍在观察中。肝癌局部及系统治疗手段的进步,极大地扩展了肝癌肝移植的适用人群,甚至可能出现新的肝癌肝移植标准。这也将成为将来肝癌治疗领域的一个研究热点。
6 结 语
总之,随着以靶向药物及免疫检查点抑制剂为代表的新型抗肿瘤药物不断涌现,随着对传统放疗和HAIC 治疗的再认识。肝癌的外科治疗手段与策略已经悄然发生了巨大的转变。随着NED 概念的提出,肝癌的治疗理念越来越向肝转移性结直肠癌的治疗策略靠拢,即期望通过围手术期积极的辅助治疗使得肝癌患者达到并维持NED 的状态,最终使患者取得生存获益。肝脏外科医师再也不能单纯依靠一把手术刀孤军奋战,而要积极地完成从“开刀匠”向肿瘤外科医师的转变,以适应新形势的发展。将来有必要开展更多的多中心、前瞻性临床研究,验证最新疗法的安全性和有效性,唯有如此,肝癌的疗效才有望进一步提高,最终惠及病患。
