微胶囊化植物根际促生菌剂的研究进展
2021-08-10董羽嘉何艳慧武占省
董羽嘉,何艳慧,武占省
(西安工程大学 环境与化学工程学院 西安市纺织化工助剂重点实验室,陕西 西安 710048)
植物根际促生菌(PGPR)剂是一类能促进植物生长的细菌,可以在植物根部定植之后通过促进植物营养的吸收、诱导根表面激素的产生或者分泌抗菌物质等来抑制危害性病原体的侵害,达到直接或者间接影响植物生长和发展的目的[1]。然而PGPR的接种剂一般以液体型菌剂或固体型菌剂施入土壤,菌剂会直接裸露于土壤环境中[2-3],当菌剂面临土壤营养环境的变化或土传微生物的竞争与原生动物捕食时,时常处于不稳定的状态,因此,PGPR菌剂的稳定性差、存活期短、有效活菌数量低、持效性差,这些制约了菌剂在农业生产中的广泛应用[4]。近年研究发现将菌体细胞固定在生物载体中或通过微胶囊技术包埋在胶囊中能够有效提高菌体的存活率和缓释性[5]。微胶囊技术是一种应用成膜材料包覆固体或液体芯材,使之形成微小粒子的技术,制得的微胶囊具有改善和提高芯材物质外观及其性质的能力,能够保护囊心物质不受外界的影响[5]。其中,用于固定生物的微胶囊又称为生物微胶囊[6-7]。
1998年墨西哥西北生物学研究中心的Bashan等充分肯定了植物促生菌的微胶囊剂型相比游离菌体剂型的显著优势,是将来研究应用的新趋势[8]。近年来,众多国内外学者对植物根际促生菌的微胶囊化进行了研究。Lin等[9]用海藻酸钠和脱脂牛奶固定化KlebsiellavariicolaGN02,所得的GN02微胶囊与游离菌体相比,不仅更加稳定、存活率更高,而且对玉米的生长有更强的促进作用。由于微胶囊化菌剂不仅能够缓解土壤中的不利环境对促生菌的影响,增加菌株存活率,而且通过控制释放速率能有效地延长菌株的存活期,有利于确保菌体的稳定性,所以微胶囊菌剂已经成为农业微生物制剂研究及应用的重要方向,受到国外学者广泛关注。本文总结了根际促生菌剂微胶囊的制备方法和不同的壁材对微胶囊菌剂性能的影响(图1),同时介绍了微胶囊的释放特性以及应用情况,并对微胶囊菌剂在生物农业上的未来发展前景进行了展望,以期对微胶囊菌剂的工业化生产和拓宽其应用范围提供参考。
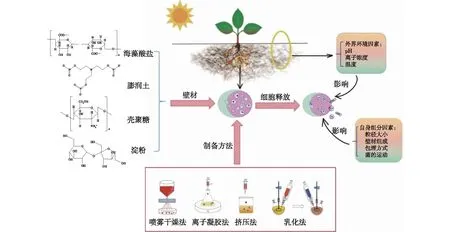
图1 植物根际促生菌的微胶囊化制备法及其释放示意Fig.1 Schematic diagram of microencapsulation and release of plant growth promoting rhizobacteria
1 根际促生菌微胶囊的制备方法
根际促生微胶囊菌剂所包埋的是具有生物活性的细胞或代谢产物,所以要求制备的条件必须温和,避免使生物质失去活性,现常用的制备方法主要有挤压法、乳化法和喷雾干燥法。
1.1 挤压法
挤压法是制备微胶囊最简单、最常用的方法,具体是将活性物质与壁材溶液混合均匀后,通过喷嘴以液滴的形式滴入固化液中,与壁材溶液发生交联作用,形成微小颗粒[10]。Schoebitz等[11]研究发现,混合海藻酸盐和淀粉制备的微胶囊粒径大约为2.3 mm,且在干燥后AzospirillumbrasilenseSp245几乎没有损失,包埋率较高。Wu等[12]将含RaoultellaplanticolaRs-2的壁材混合溶液从0.9 mm针孔径的无菌注射器中挤入20 g/LCaCl2固化液中,制得粒径为0.98~1.35 mm的海藻酸盐-淀粉包封的Rs-2微胶囊,得率可达90.4%。Wu等[7]采用挤压法以不同浓度的海藻酸盐制备KlebsiellaoxytocaRs-5微胶囊时发现,随海藻酸盐浓度的增加,胶囊粒径随之增大,当海藻酸盐为20 g/L时,胶囊颗粒更加均匀,粒径主要集中在1.0 mm左右。Pacheco-Aguirre等[13]采用挤压法,以黄原胶为壁材,对Bacillussubtiliscbrf24进行微胶囊化制备,最终的胶囊粒径在1.34 mm左右。
总的来说,挤压法制得的微胶囊的粒径大小取决于喷嘴孔径的大小、液滴下落的距离、固化液的选择以及壁材-细胞混合液的黏度等,一般制得的胶囊粒径较大,约为0.5~3.0 mm。由于挤压法操作简单、成本低廉,所以在制备微胶囊过程中应用较广。
1.2 乳化法
乳化法能够灵活地控制和调整微胶囊的大小,具体操作方法是先将芯材与壁材混合均匀后加入植物油中高速搅拌进行乳化,待形成均匀且稳定的油包水(W/O)乳化液滴后,加入交联剂使壁材溶液与之反应固化成型,将芯材包埋在壁材与固化剂形成的膜的微胶囊中。影响微胶囊粒径大小的主要参数有乳化过程中乳化剂的类型、分散相与连续相的黏度比以及搅拌速度等,用乳化法制得的微胶囊粒径通常较小,约为20 μm~2 mm。Ma等[14]采用乳化法,以脱脂乳为壁材与4%L.plantarumLIP-1菌混合后,滴加乳化剂(玉米油),在500 r/min条件下搅拌5 min后获得了粒径为60~70 μm的微胶囊;同时发现,胶囊的粒径随水/油的比例和搅拌速度的增大而减少,随乳化时间延长和脱脂乳浓度的增大而增大。
乳化法根据交联剂来源的不同,目前已经开发了外源乳化法和内源乳化法。1983年,Nilsson等[15]发明了外源乳化法(emulsification/external gelation)制备海藻酸盐微胶囊,具体过程:将海藻酸钠溶液和菌液共混,将此混合物分散到油相中形成W/O型乳化液,在乳化液中缓慢加入CaCl2溶液,促使Ca2+与乳液液滴中的海藻酸钠作用生成海藻酸钙膜后形成海藻酸钙微囊,静置后收集海藻酸钙凝胶珠。因固化剂的Ca2+从海藻酸钠液滴外侧扩散进入液滴而逐渐形成凝胶,故称为外源乳化法。Li等[16]采用外源乳化法,将一定量的海藻酸钠-膨润土的混合液及一定量的菌液混合后滴入含有1 mL Span 80的液体石蜡中,在不同转速下搅拌25 min,制备含PseudomonasputidaRs-198的微胶囊,其粒径为25~100 μm,并且微胶囊的粒径随乳化转速增大逐渐减小,粒径分布更加均一。Zou等[17]采用外源乳化法将20 g/L海藻酸钠与细胞悬液混合后加入含10 g/L Span 80的大豆油中,在300 r/min条件下搅拌15 min,制备含BifidobacteriumbifidumF-35微胶囊,结果发现,在有果胶和淀粉聚合物包覆时,胶囊的平均粒径约为120 μm。
与外源乳化法不同,内源乳化法的Ca2+来自海藻酸钠液滴内部的不溶性钙盐,它们与海藻酸钠在液滴内部原位形成凝胶。与外源乳化法相比,内源乳化法采用难溶性钙盐作为钙源,克服了外源乳化法中由于CaCl2溶液加入引起的微胶囊成簇的凝聚现象,使得微胶囊粒径易于控制,可形成粒径更小的微胶囊,且颗粒粒径更加均一[18]。Tu等[19]在海藻酸钠、明胶为主要壁材的溶液中加入难溶性钙盐颗粒,以棉籽油作为乳化剂,采用内源乳化法包封BacillussubtilisSL-13时发现:海藻酸钠为20 g/L、菌胶质量比为1∶3、CaCO3为25 g/L时,随明胶浓度的增加,微胶囊的粒径分布均一、含水量增加、包埋率显著增加,生物降解率降低,可以通过改变海藻酸钠和明胶的含量来改变微胶囊的生物降解性以及细胞释放速率;所制得的海藻酸钠-明胶微胶囊表面规则,包埋率为90%~94%,粒径为250~400 μm。Augustot等[20]以15 g/L的海藻酸钠为壁材,以菜籽油为乳化剂,在900 r/min搅拌15 min条件下,制备了粒径约为54.82 μm的含BifidobacteriumBB-12的Ca2+缓释微球。
1.3 喷雾干燥法
喷雾干燥法是将细菌的细胞分散到载体或壁材中,形成乳状液或分散液,然后将混合物雾化喷入热室的一种方法[21],制得的微胶囊形状均匀、呈球性好、粒径较小(一般小于100 μm)。Campos等[22]以不同比例和不同浓度的海藻酸钠和麦芽糊精混合物为壁材,用喷雾干燥法制备了含Enterobactersp.14的微胶囊,其粒径为5~50 μm。Schoebitz等[23]以麦芽糊精为壁材包封Serratiasp.时发现,在喷雾干燥的入口温度145 ℃和出口温度90 ℃的条件下,包封后的微胶囊细胞生物活性较低,由初始的2.8×109CFU/g减至2.8×106CFU/g。这可能是在喷雾干燥过程中,较高的温度和瞬间脱水导致PGPR的活菌数大幅减少或对不良环境的抗性明显下降。尽管如此,耐高温的芽孢杆菌属的微胶囊仍多采用喷雾干燥法来制备。有研究[24-25]表明,可以通过调整喷雾干燥进出口的温度来改善这一方法对胶囊中活菌数量的影响。Ma等[26]考察入口温度分别为105、125、145、165和185 ℃条件下BacillussubtilisB99-2的存活率时发现,在145 ℃时活菌数可达5.35×108CFU/g,存活率约为92.48%。Chi等[27]采用喷雾干燥法以进料流量1 000 mL/h制备BacillusmegateriumNCT-2微胶囊时发现,与130、170和190 ℃相比,进口温度为150 ℃时NCT-2的存活率最好。
与以挤压法和乳化法制得的微胶囊相比,喷雾干燥法制得的微胶囊大多是水溶性的。因此,在进入土壤的过程中可能会过早地释放其中的活性物质,减弱对其形成有效的保护,所以这种微胶囊的制备方法尽管会影响菌体的存活、释放特性,但是这类微胶囊在提高促生菌的稳定性和应用效果方面有重要作用。
目前大部分的微胶囊根际促生菌剂的制备和应用为实验室规模,因此,开展适用于大规模PGPR微胶囊菌剂的生产和制备工艺技术研究,将是推动微胶囊菌剂实际生产应用的重要研究方向。
2 根际促生菌的微胶囊壁材的选择
以微胶囊封装根际细菌主要是保护微生物避免受到环境的破坏,并且使其能够缓慢地释放进入植物的根际[28],所以壁材的性能与微胶囊化菌体的释放性能以及促生菌的生物活性有直接关系。天然的聚合物被广泛用于根际细菌的微胶囊化制备,主要有从海藻水凝胶中提取的海藻酸钠、卡拉胶和琼脂糖等;人工合成的聚丙烯酰胺、聚苯乙烯和聚氨酯等聚合物也被用于活细胞的包埋[29];淀粉、麦芽糊精、淀粉糖浆干粉和阿拉伯树胶等碳水化合物也被广泛用于喷雾干燥封装技术[30]。这些材料的低黏度和良好的生物相容性能使其成为工业化生产应用的封装材料。
2.1 海藻酸盐
海藻酸是存在于褐藻中的一类天然多糖,是β-D-甘露糖醛酸(mannuronic acid,简称M)和α-L-古洛糖醛酸(guluronic acid,简称G)通过β-(1→4)糖苷键连接形成的一类线形无分枝的链状阴离子聚合物[31]。当海藻酸盐遇到二价阳离子或聚阳离子时,会发生离子转移,形成既具有高强度又具有弹性的凝胶,由此制得海藻酸盐微胶囊[31]。由于海藻酸无生物毒性,与微生物菌体生物相容性好、传质性能良好,可在自然条件下发生分解和生物降解,制备过程无须有机溶剂,室温下可实现包埋过程,形成的胶囊有较高的表面孔隙率,有利于胶囊的扩散,并且可通过简单控制海藻酸盐浓度来控制微胶囊的孔径等优良特性,被广泛用于菌剂微胶囊的制备[32-33]。Wu等[7]用15~20 g/L的海藻酸钠溶液采用挤压法制备KlebsiellaoxytocaRs-5微胶囊时发现,在海藻酸钠溶液和Rs-5的体积比为3∶ 1时所制得的微胶囊在细胞释放7 d后仍有较高的活性。Amine等[34]以海藻酸钠为壁材,采用挤压法制备了粒径为2 mm左右的B.longumATCC 15708微胶囊,在30 g/L海藻酸盐条件下微胶囊的包封产率约为67%。Homayouni等[35]采用乳化法制备海藻酸盐包封的Lactobacilluscasei微胶囊,平均粒径约为17.8 μm,且包埋率随CaCl2溶液体积的增大而增加。
由于海藻酸盐的成本较高,并且以单独海藻酸盐为壁材制成的微胶囊力学强度不够高,所以在制备和使用过程中加入如黏土矿物、淀粉或壳聚糖等添加剂来降低成本,更可提升微胶囊的稳定性[36]。
2.2 黏土矿物
向海藻酸盐中添加填充材料,如黏土、膨润土、高岭土和蒙脱土等作为重要壁材,可提高固形物的含量,显著增加微胶囊的力学强度,并能使胶囊中的细胞具有更好的控释性能[11]。He等[37]在制备含RaoultellaplanticolaRs-2的海藻酸盐-膨润土微胶囊时发现,膨润土的添加提高了含R.planticolaRs-2微胶囊的力学性能,减缓了细胞的释放速率,微胶囊的稳定性也得以提升,与不含膨润土的微胶囊相比,膨润土-海藻酸盐微胶囊在室温保存180 d后细胞存活率仍可达88.9%。Kadmiri等[38]在海藻酸盐中分别添加高岭土或蒙脱土为壁材制备PseudomonasfluorescensMs-01(Pf)和AzosprillumbrasilenseDSM1690(Ab)的微胶囊时发现,在添加高岭土的微胶囊中储存3个月后,细菌存活达到14.8 (以细菌数目的对数值表示),表明高岭土的存在更有利于微胶囊中的菌体存活。Li等[16]用海藻酸盐-膨润土制备PseudomonasputidaRs-198微胶囊时发现,随膨润土含量的增加,微胶囊粒径、包埋率和产率都显著增加,但含水量下降。
2.3 淀粉
淀粉及其水解产物(麦芽糊精或糊精)是一种广泛分布于自然界的可再生的生物聚合物,基于其低成本、生物相容性及其保水性、低黏度等[39]等优点,它们经常被用作包裹材料,具有广泛的工业应用前景。
Wang等[40]采用氧化后分子量更低的氧化海藻酸钠与淀粉形成的复合材料为壁材,包封PseudomonasprotegensSN15-2时发现,通过改变复合材料中淀粉的比例,能够有效调节微胶囊的粒径、制得率、包封率、释放速率及降解率。Schoebitz等[11]向海藻酸盐中分别添加膨润土和淀粉对包封的A.brasilense菌株在干燥后的存活率时发现,添加淀粉的海藻酸盐制备的微球在贮藏400 d后A.brasilense存活细胞最多,菌密度在109CFU/g左右。在根际促生菌剂微胶囊化的应用中,由于淀粉是碳降解过程中的重要资源,可被微胶囊内的细胞所利用;如果提高壁材中的淀粉含量,就会弱化淀粉与海藻酸盐分子间的作用力,从而增强微胶囊的尺寸稳定性,可显著提高微生物细胞的存活率[12],因此,淀粉将是工业化生产微胶囊菌剂的重要原料。
2.4 壳聚糖
壳聚糖结构与纤维类似,是带有正电荷的一种直链多糖,具有无毒、较好的生物相容性与降解性等优点[41],是良好的生物微胶囊壁材。壳聚糖所具有的亲脂性可以用于去除油性物质,特别是与含油降解细菌有关的物质[42]。
Chanratana等[43]分别以湿壳聚糖、干壳聚糖、湿海藻酸钠和干海藻酸钠为壁材,制备MethylobacteriumoryzaeCBMB20菌株的微胶囊菌剂时发现:壳聚糖微胶囊对菌株CBMB20的包埋率更高;在4 ℃储藏90 d后,湿壳聚糖的微胶囊中CBMB20的存活率最高(达到80%)。Chen等[44]和Hsieh等[45]用三聚磷酸盐作为混凝剂将恶臭假单胞菌(Pseudomonasputida)包裹在壳聚糖微胶囊时发现,壳聚糖包封的细胞可以耐受更高浓度的三氯乙烯。Costa等[46]采用壳聚糖包封降解十六烷的OchrobactrumanthropicUFPEDA831和BacilluspumilusUFPEDA840菌株时发现,壳聚糖提高了菌株的活性和产壳聚糖酶的能力,且固定化细胞比游离菌对十六烷的去除率更高,在144 h内将1% (体积分数)溶液中的十六烷除去了90.8%。现将PGPR微胶囊壁材及制备方法总结于表1。
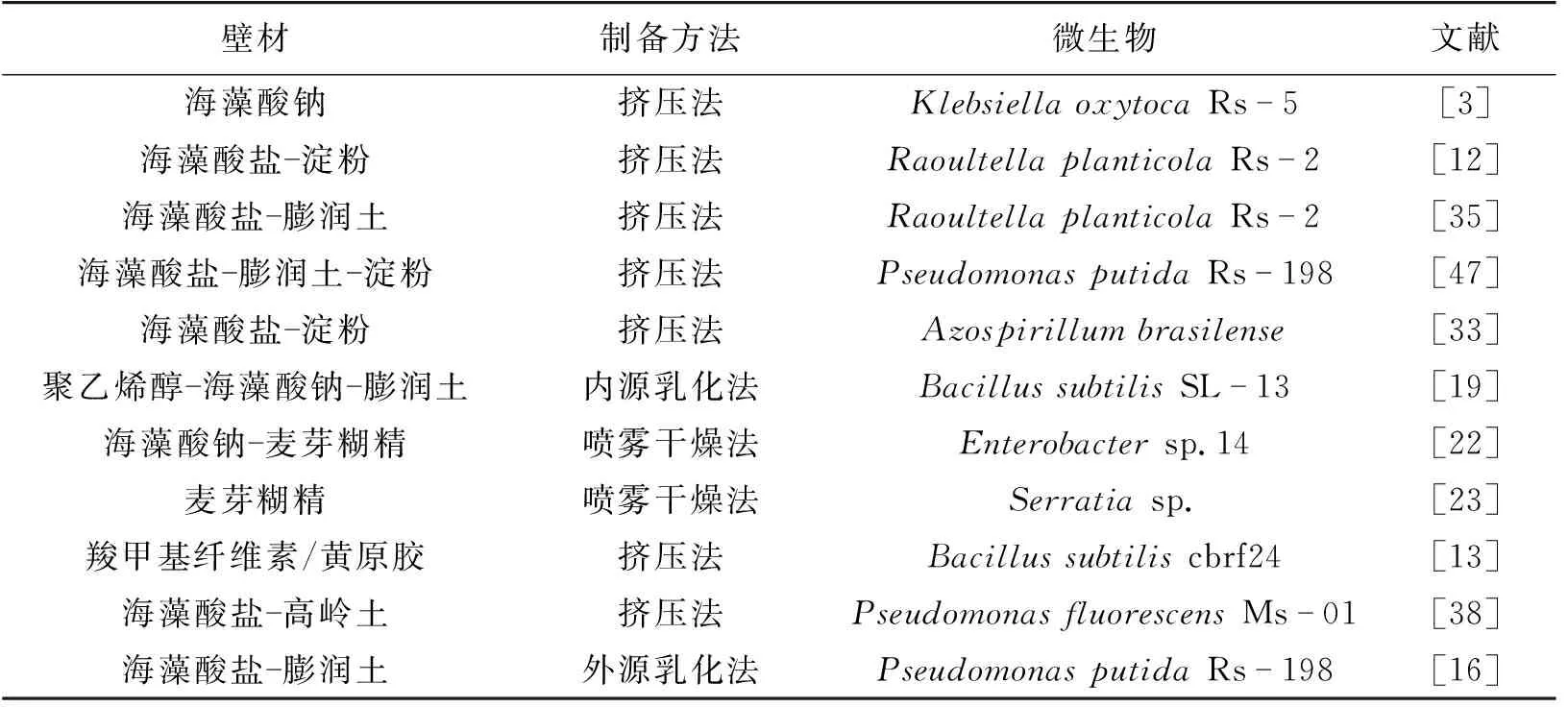
表1 PGPR微胶囊化壁材及制备方法
虽然微胶囊化菌体壁材的优化与选择已经实现了由单一的海藻酸盐到生物可降解的复合材料的转变,然而,开发控释细菌微胶囊的关键是寻找一种廉价的、来源丰富的、生物可降解的材料作为壁材原料。材料的生物可降解性与壁材的天然性质、结构有很大的关系,而菌剂中菌体细胞的释放率在某种程度上也依赖于壁材的生物可降解性能和力学强度。因此,开展低成本、非传统的生物降解性合成材料作为壁材的创制研究,并研究相关材料与微胶囊的释放特性、力学性能和生物降解性的相关性,是目前研究的重要趋势之一。
3 微胶囊释放特性
与药物微胶囊释放不同,将目标活细菌及其代谢产物从胶囊中以预定的速率控制释放到作物根际是微胶囊化PGPR成功的关键。Chanratana等[43]分别利用壳聚糖和海藻酸钠作为壁材,制备包埋MethylobacteriumoryzaeCBMB20的微胶囊时发现:在30 ℃的盐水中壳聚糖和海藻酸钠胶囊化菌在72 h内几乎没有释放;72 h后才开始释放,且壳聚糖配方的微生物释放慢于海藻酸盐配方的。
胶囊中菌体的释放特性受各种因素的影响。一方面,菌体的释放与胶囊自身组分有关,如胶囊的壁材组成、粒径和包埋方式等。Liu等[48]以C.cellulansGS6细胞作为胶囊化的核心物质,研究壁材海藻酸盐与几丁质、纤维素、橄榄油对释放量和释放动力学的影响时发现,可以通过设计胶囊不同的壁材种类和添加量来控制细胞的释放量和释放速率。Wu等[49]研究发现,增加壁材中淀粉的添加量,可增加微胶囊的生物可降解性,从而提高细胞释放速率和释放量。微胶囊的粒径大小容易受到制备条件的影响,对于核壳微胶囊,膜的厚度和渗透性也对活细胞在微胶囊中释放有重要影响。Wu等[4]在研究不同壁材的成分对微胶囊中细胞释放量的影响时发现,增加淀粉和海藻酸盐的浓度都导致Rs-2释放量的增加,而膨润土是例外,因为增加膨润土的用量会导致微胶囊的力学强度增强,反而使细胞的释放量降低。由此可见,通过改变壁材的组成来调节和控制细胞释放速率和释放量,可以满足植物生长的需要。
另一方面,外界的环境(如pH、温度和离子浓度等)也会影响微胶囊的释放。Wu等[50]研究以海藻酸钠和膨润土包埋的菌株Rs-198微胶囊的扩散渗透系数(DPC)及其与生长、代谢产物释放和细菌存活率的关系时发现:较高的环境温度增加了分子运动的速率和溶质分子进出胶囊的速度,因此微胶囊的DPC值随温度的升高而快速增大;另外由于微胶囊在酸性条件下收缩,中性甚至碱性条件下膨胀,所以DPC值在pH为5.0时最低,pH为9.0时最高;较高浓度的盐溶液会导致微胶囊外渗透压增大,阻碍了溶质分子和菌株细胞从微胶囊中释放,所以微胶囊的DPC值随盐浓度的增加反而降低。Young等[51]研究发现,贮存5个月后微胶囊化的BacillussubtilisCCpg104仍具有高的存活性,可达(5.3±1.3)×108CFU/g,在24~144 h期间,pH 8时的细胞释放速率显著高于pH 7和pH 6时的。
国外学者对药物在微胶囊中的释放研究较多,但对于微胶囊菌体缓释性能的研究报道较少,而且缺乏微胶囊中菌体在不同环境下控制释放特性及机制研究结果,所以研究活菌的运动性能以及与微胶囊中控制释放的关系,对于后期微胶囊化菌剂在作物根际的应用以及开发适应于农作物要求的控释胶囊菌剂至关重要。
4 根际促生菌微胶囊的应用
微胶囊化菌剂能够避免不利环境因素对促生菌的影响,有效提高菌体的存活率,可以持续地将菌剂释放到作物根际,延长菌剂持效性,充分发挥促生菌的效能。因此,促生菌微胶囊化剂型的开发和应用研究是生态农业发展的研究趋势。
Vassilev等[8]采用微胶囊共包埋的菌丝真菌Glomusdeserticola和溶磷菌Yarowialipolytica接种在营养贫乏土壤中,可以有效地促进番茄的生长。Young等[51]研究发现,富含腐殖酸的海藻酸盐微胶囊化植物促生菌剂具有显著的体外溶解磷酸钙能力,并且微胶囊化菌株显著促进莴苣的生长。Rekha等[52]在无菌条件下研究游离的和胶囊化的恶臭假单胞菌(PseudomonasputidaCC-FR2-4)和枯草芽孢杆菌(BacillussubtilisCC-pg104)对莴苣生长的影响时发现:胶囊化的接种剂型能够隔离土壤中不利环境,延长枯草芽孢杆菌在土壤中存活期、存活率;游离细胞接种在开始14 d内效果显著,但随后(21 d后)胶囊化的CC-pg104更有优势,能显著地增加莴苣根的生长,这主要是由于细胞从胶囊中的缓慢或控制释放,有助于微生物菌体在土壤中长期存活并定殖。Wu等[50]研究发现,接种微胶囊Rs-198菌剂不仅能显著提高5 g/L盐胁迫下的棉花植物的生物量,还可提高棉花的可溶性蛋白含量(19.47%),由此可见,微胶囊化Rs-198的菌株可有效缓解盐胁迫对棉花的危害。Pongsilp等[53]研究琼脂固定化EnsiferfrediiLP2/20对甘蓝生长以及对植物养分和土壤元素的影响时发现,接种固定化的E.frediiLP2/20后,增加了植物的干质量,土壤有机质以及全氮、磷、钾、钙、镁、铁和锌等元素含量,降低了细菌总丰富度和多样性。Chanratana等[54]研究发现,以壳聚糖固定化的MethylobacteriumoryzaeCBMB20能够提高植物的干质量、养分吸收(N、P、K和Mg2+)、光合效率和减少过量的Na+流入植物细胞,进而降低Na+/K+的比值,改善了在盐胁迫条件下生长的番茄植株根际环境。Wu等[55]研究了KlebsiellaoxytocaRs-5的微胶囊,相比于接种游离的Rs-5,接种微胶囊化菌剂的棉花籽在盐胁迫条件下的发芽率提高了8.34%,有效缓解了盐胁迫对作物的影响,同时棉花的叶绿素a、可溶性糖、丙二醛和脯氨酸含量均高于游离菌株处理的棉花植株。Wu等[4]以海藻酸钠-淀粉-膨润土为壁材制备的RaoultellaplanticolaRs-2微胶囊菌剂处理过的棉花植株,其干质量和鲜质量相比较于未处理的棉花分别提高了30.9%和13.0%,并且氮、磷含量分别增加了37.9%和61.9%,增加了棉花植株对氮和磷的吸收,从而促进了作物的生长。
由于胶囊化菌剂制备过程的局限性,其应用研究主要集中在盆栽和小范围区域中,胶囊化菌剂的大批量生产和应用研究是目前亟须解决的瓶颈问题。
5 结论与展望
相比于其他菌剂类型,微胶囊化可以提高被包封根际促生菌的存活率并达到控释的目的,随着微生物菌剂研究的深入,微胶囊化根际促生菌已经展现了巨大的应用前景和广阔的市场价值。针对不同特性的根际促生菌选择合适的胶囊化材料及方法进行包封,能有效提高微胶囊得率和菌株的存活能力。在本文所综述的几种制备方法中,挤压法操作简单、成本较低,但所制得的胶囊粒径较大;乳化法能够灵活调控胶囊的大小,可用于制备粒径较小的胶囊;喷雾干燥法所制得的微胶囊形状均匀、呈球性好、水溶性好,但干燥过程中的高温环境会影响不耐高温的普通根际促生菌的存活,但适合芽孢杆菌属菌株的微胶囊化。因此为提高微胶囊的制备效率,在实际操作中要根据根际促生菌种类选择适合的制备方法。
为推动促生菌剂的微胶囊菌剂的大规模生产和应用,亟须开发适合微胶囊根际促生菌剂的制备工艺。海藻酸盐是最常使用的壁材,加入黏土矿物能够增加微胶囊的力学强度以减缓释放速率,加入具有生物可降解性的壳聚糖、淀粉等壁材可调控释放速率。因此,综合各类壁材对释放速率的影响,在生产微胶囊菌剂时考虑到各种材料的特性,进行复合壁材微胶囊菌剂的开发并探索复合型壁材对释放特性的调控机制,以达到理想的可控释放效果是目前应该被重点关注的。
微胶囊化菌剂在根际应用的优势是毋庸置疑的,但是目前对于在不同气候条件、土壤环境、作物生长下微胶囊化剂型的施入方式、施入时间及施入量对菌体在植物根际的定殖、存活、数量消长等规律以及对作物的产生效果等方面,国内外均未见深入报道。对微生物菌体微胶囊的应用技术以及控释性能与微生物菌体在土壤和植物根际的定殖、存活和数量消长的相关性研究是今后重要研究方向。同时,根际促生菌剂微胶囊工业化生产也是未来的发展趋势,对拓宽其在农业上的应用范围和促进其在农业上的应用效果具有重要的现实意义、生态效应及社会效应。
