蛋白变性剂对酵母蔗糖酶及其修饰酶的催化活性影响及其作用分子机制
2021-08-09黎春怡王丹菊黄卓烈
黎春怡,王丹菊,黄卓烈
1.茂名职业技术学院,广东 茂名525000;2.华南农业大学生命科学学院,广东 广州510642
蔗糖酶(又称转化酶,invertase)广泛存在于真菌、细菌和植物体中,可将蔗糖水解为葡萄糖和果糖。蔗糖酶对生物体的糖类代谢和生长发育都具有重要的意义,直接参与植物的生长、器官建成、糖分运输等[1],并间接参与细胞分化和植物发育的调控[2]。蔗糖酶属于糖苷水解酶GH32家族[3],在酵母细胞中以高度糖基化的胞外蔗糖酶和低糖基化(<3%)的胞内蔗糖酶两种形式存在[4]。食品工业上,蔗糖酶主要用于由蔗糖生产糖浆和人造蜂蜜,也可用来作杏仁糖果和桃仁糖果的软化剂,还用以分解蜂蜜中的蔗糖作为工业酒精生产的碳源[5]。在工业上具有较高的经济价值。
酶是在生物细胞内合成的,大多数是在细胞内使用。而当将这些酶提取出来用于工业或医学时,一般酶的活性都很低,酶学性质极不稳定。若对酶进行化学修饰可以改善和提高酶在工业应用过程中的一些不良性质,提高酶的稳定性和抵抗蛋白质变性剂的能力,并赋予某些优良性质。这就可拓宽酶的工业应用范围。目前发现,壳寡糖(chitooligosaccharides,COS)是一种优良的修饰剂。
壳寡糖是壳聚糖部分降解产物,是由乙酰氨基葡萄糖或氨基葡萄糖通过β-1,4糖苷键连接起来的水溶性低聚糖。小分子量(MW1×103~1×105)的COS与高聚壳聚糖相比,其晶体结构的紧密性显著降低,溶解性大大增强,生物活性、配位能力明显提高,具有许多高聚壳聚糖所不具备的生理活性和功能性质。
本文在利用壳寡糖修饰酵母蔗糖酶后,探讨两种蛋白质变性剂对酵母蔗糖酶及其修饰酶的活性影响,并通过对酶的催化动力学参数变化、紫外吸收光谱、紫外差示光谱、荧光光谱等光谱分析,探讨在两种变性剂作用下酵母蔗糖酶及其修饰酶活性变化与其分子构型和构象之间的关系。
1 实验部分
1.1 材料与仪器
酵 母 蔗 糖 酶(yeast invertase,YInv)(EC 3.2.1.26)的纯酶(美国Sigma公司),生化试剂考马斯亮蓝G-250(Fluka公司),壳寡糖(chitooligosaccharides,COS,MW5000)为国产食品级生物制剂,其余试剂均为国产分析纯试剂。
主要仪器设备包括凝胶成像系统(珠海黑马公司),TFD5503冻干机(韩国ilShin Lab公司),F4500荧光光谱仪和UV3010紫外光谱仪(日本日立公司)等。
1.2 实验方法
1.2.1 蔗糖酶的修饰、纯化和鉴定 壳寡糖修饰蔗 糖 酶(chitooligosaccharides-modified-invertase,COS-Inv)由本实验室按照此前的方法[6]进行制备、纯化和鉴定。修饰方法如下:用平均分子量为5 000的壳寡糖(COS)修饰YInv。25 mg YInv纯酶溶于5 mL NaAc-HAc缓冲液(0.1 mol·L−1,pH 4.0)中,加入5 mL 0.1 mol·L−1NaIO4溶液,混匀,再加入0.5 g蔗糖,搅拌30 min后加入400μL乙二醇终止反应。将此溶液在2 L NaAc-HAc缓冲液中进行透析。透析管截留分子量为10 kD。重复透析3次,每次4 h。透析后在溶液中加入0.5 g蔗糖和40 mg COS,搅拌反应4 h后,加入1 mol·L−1的NaBH4溶液1 mL。继续搅拌4 h后,然后将溶液在2 L NaAc-HAc缓冲液中透析4 h,得到了修饰酶粗酶(粗COS-Inv)。以上步骤均在4℃暗室中进行。将此粗COS-Inv溶液在DEAE-52阴离子交换柱中层析纯化,用0.05 mol·L−1pH 6.0磷酸缓冲液洗脱。收集各分部洗脱液进行蛋白质和酶活性鉴定。COS-Inv达到电泳纯的纯度后才能用于本研究的各项实验。
1.2.2 YInv与COS-Inv的活性测定 酶液(YInv或COS-Inv,以pH 5.0的0.1 mol·L−1NaAc-HAc缓冲液配制为浓度约1 g·L−1)分别于30℃恒温水浴中保温10 min。2 mL蔗糖溶液(溶于0.1 mol·L−1NaAc-HAc缓冲液中,pH 5.0)于50℃恒温水浴中保温10 min,加入0.1 mL酶液(YInv或COS-Inv),50℃准确反应10 min后,加入2 mol·L−1的NaOH溶液0.1 mL终止反应,然后测定溶液中还原糖的生成量。还原糖含量的测定采用文献[7]方法,以葡萄糖和果糖(质量比1∶1)作为标准物。蛋白质含量的测定参照Bradford[8]的方法,采用牛血清白蛋白作为标准物。
YInv或COS-Inv在50℃ 、pH 5.0的条件下,每毫克蛋白质在1 min内催化蔗糖水解产生1μg还原糖定义为1个酶活性单位(U)。
1.2.3 YInv与COS-Inv在蛋白变性剂中的活性测定 在50℃、pH 5.0下分别测定YInv与COS-Inv在不同浓度的尿素和盐酸胍中的活性变化情况。其中,酶液和蔗糖溶液均用含变性剂的缓冲液配制;酶液于30℃预保温30 min。YInv与COS-Inv的活性测定方法参照1.2.2进行。
1.2.4 在蛋白变性剂中YInv与COS-Inv的动力学参数测定 以不同浓度的蔗糖溶液为底物,在50℃、pH 5.0下分别测定YInv与COS-Inv的Linweaver-Burk曲线,求出其Km值和vmax值并进行比较。其中,尿素与盐酸胍分别用缓冲液配制为0.2 mol·L-1溶液;酶液与蔗糖溶液均以变性剂溶液进行配制;酶液预保温温度为30℃,酶活性测定方法参照1.2.2进行。
1.2.5 YInv与COS-Inv在变性剂中的光谱测定以缓冲液为空白,分别测定YInv与COS-Inv在0.2 mol·L-1尿素和0.2 mol·L-1盐酸胍中的紫外吸收光谱;以缓冲液中YInv作空白,分别测定YInv在0.2 mol·L-1尿素和0.2 mol·L-1盐酸胍中的紫外差示光谱;以缓冲液中COS-Inv作空白,分别测定COS-Inv在0.2 mol·L-1尿素和0.2 mol·L-1盐酸胍中的紫外差示光谱;以缓冲液为空白,分别测定YInv与COS-Inv在0.2 mol·L-1尿素和0.2 mol·L-1盐酸胍中的荧光发射光谱。
2 结果与讨论
2.1 变性剂对YInv与COS-Inv的活性的影响
从图1(a)中尿素浓度为0时的酶活性可知,修饰酶COS-Inv的活性约是天然酶YInv的2.5倍,尿素对YInv和COS-Inv活性的影响不一样。YInv在一系列浓度尿素中,其活力是受连续抑制的,酶活性抑制程度随着尿素浓度的增加而增大。然而,低浓度(<0.3 mol·L-1)的尿素对COS-Inv有一定的激活作用。当尿素浓度为0.2 mol·L−1时,COS-Inv的酶活性比对照(尿素浓度为0 mol·L−1时)提高了10.54%。当尿素浓度大于0.3 mol·L−1时,COS-Inv的活性开始下降。比较YInv与COS-Inv在尿素中的稳定性,尽管二者酶活性下降趋势大致相同,由于修饰后COS-Inv的活性是YInv的活性约2.5倍,在经4 mol·L−1尿素处理30 min后,COS-Inv的活性仍保持较高,为YInv未经尿素处理时的96.63%。
由图1(b)可见,在不同浓度的盐酸胍溶液中YInv和COS-Inv的活性是连续受到抑制的,二者的活性变化趋势大体一致,其程度随着盐酸胍浓度的增加而增大。而且COS-Inv活性下降趋势比YInv明显,经0.1 mol·L−1盐酸胍处理后,YInv保留82.74%的活性,COS-Inv保留79.79%的活性。经1 mol·L−1盐 酸 胍 处 理 后 ,YInv残 留 活 性 为30.99%,COS-Inv为28.94%。

图1 变性剂对YInv和COS-Inv的活性影响:(a)不同浓度尿素中的酶活性,(b)不同浓度盐酸胍中的酶活性Fig.1 Effect of protein denaturants on activity of YInv and COS-Inv:(a)enzyme activity in different concentrations of urea solutions,(b)enzyme activity in different concentrations of GuHCl solutions
尿素和盐酸胍常用于蛋白质的变性研究,以探讨蛋白质构象与功能的关系研究。大量研究表明,极低浓度的尿素和盐酸胍对多种酶[9-13]有激活作用。在本研究中,盐酸胍和尿素对YInv和COS-Inv的影响是不同的。盐酸胍对YInv和COS-Inv的活性影响大体一致,YInv和COS-Inv在盐酸胍中是受到明显抑制的。可能是由于盐酸胍是电解质,可以通过正离子(胍离子)效应减弱维持蛋白质三级结构的静电作用,同时还可通过氯离子和胍离子与蛋白质相应带电基团的相互作用产生的静电效应[14],破坏了酶分子的整体构象,导致YInv和COS-Inv在盐酸胍中迅速失活。尿素则对YInv和COS-Inv的活性表现出不同的影响。YInv在尿素中的活性受到抑制,而低浓度的尿素(<0.3 mol·L-1)对COS-Inv却有激活作用。可能是由于YInv肽链与尿素结合形成双氢键,二级结构受到破坏,整体构象改变而失活;而COS的引入对尿素与酶分子肽链的结合起了一定的保护作用。同时低浓度的尿素微扰了COS-Inv活性部位的局部构象,使其柔性增加,表现为酶活性的提高。
2.2 动力学分析
以蔗糖为底物研究了50℃、pH 5.0条件下,YInv和COS-Inv在尿素和盐酸胍溶液中的催化动力学(图2)。用双倒数作图法分别计算出YInv和COS-Inv在0.2 mol·L−1尿素和0.2 mol·L−1盐酸胍中动力学参数(表1)。由图2(a)可知,与在缓冲液中相比,YInv在0.2 mol·L−1尿素中的Km和vmax均明显增大,说明尿素的存在改变了YInv催化位点构象,使其vmax增大,但同时又破坏了结合位点,致使酶结合底物的能力大大降低,最终导致表观酶活性下降;而COS-Inv在尿素中的Km和vmax均有所下降,可见在低浓度下尿素对COS-Inv的激活作用是通过提高COS-Inv与底物的亲和力来实现的,可以推断,尿素通过改变了酶的活性中心的构象,使酶与底物的结合位点向有利于与底物结合的构象转变,酶分子与底物的亲和力增加,从而提高酶的活性。
YInv在0.2 mol·L−1盐酸胍中的Km和vmax均小于缓冲液中[见图2(b)和表1],可知YInv和底物的结合能力增加但最大反应速度下降,说明盐酸胍改变了酶分子的构象。虽然酶结合位点的柔性增加,酶与底物结合力增大,但同时又破坏了催化位点的构象,最大反应速度降低,其反应机理类似于反竞争性抑制。而COS-Inv在0.2 mol·L−1盐酸胍的Km大于缓冲液中,vmax则略有增加,可以推断盐酸胍对COS-Inv的抑制是通过降低酶与底物的亲和力来实现的,类似于竞争性抑制。

图2 YInv和COS-Inv的催化动力学分析:(a)YInv与COS-Inv在缓冲液和0.2 mol·L-1尿素中的Lineweaver-Burk曲线,(b)YInv与COS-Inv在缓冲液和0.2 mol·L-1盐酸胍中的Lineweaver-Burk曲线Fig.2 Catalytic kinetic analysis of YInv and COS-Inv:(a)Lineweaver-Burk curves of YInv and COS-Inv in buffer and in 0.2 mol·L-1 urea solution,(b)Lineweaver-Burk curvesof YInv and COS-Inv in buffer and in 0.2 mol·L-1 GuHCl solution
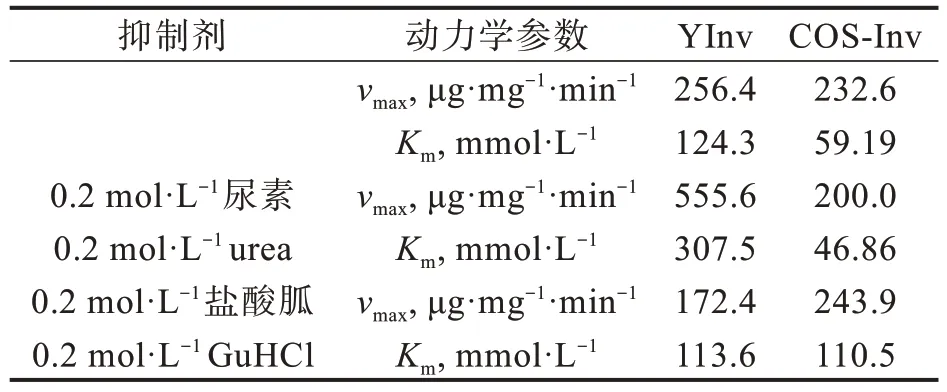
表1 YInv和COS-Inv在尿素和盐酸胍溶液中的催化动力学参数Tab.1 Catalytic kinetic parameters of YInv and Cos-Inv in urea and guanidine hydrochloride solutions
2.3 变性剂对YInv和COS-Inv紫外吸收光谱的影响
大多数蛋白质的紫外吸收光谱在280~290 nm及200~235 nm处各有一个吸收峰,一般认为230 nm波长以下的紫外吸收峰的变化主要反映酶蛋白主链构型的变化;当肽链骨架由无规则卷曲变成α-螺旋时,吸收明显下降[15]。本文通过研究变性剂对YInv和COS-Inv的紫外吸收光谱(图3),探讨变性剂对YInv与COS-Inv催化活性的影响和分子构型构象变化之间的关系。

图3 变性剂对YInv和COS-Inv紫外吸收光谱的影响:(a)0.2 mol·L−1尿素,(b)0.2 mol·L−1盐酸胍Fig.3 Effect of denaturing agents on ultraviolet absorption spectra of YInv and Cos-Inv:(a)0.2 mol·L−1 urea solution,(b)0.2 mol·L−1 GuHCl solution
由图3(a)可知,与在缓冲液中的结果比较,经0.2 mol·L-1尿素处理的YInv的紫外吸收光谱峰型基本保持不变,在217 nm和273 nm附近的2个特征吸收峰波长不变但峰值有所下降;COS-Inv的紫外吸收谱峰型也基本保持不变,但在219 nm和276 nm附近的两个特征吸收峰也未发生改变但峰值有所下降。由图4(b)可知,经0.2 mol·L-1盐酸胍处理的YInv的紫外吸收谱峰型基本保持不变,217 nm和273 nm附近的两个特征吸收峰峰值有所下降;COS-Inv的紫外吸收谱峰型也基本保持不变,在219 nm附近的特征吸收峰峰值有所下降。
有机分子的紫外吸收光谱与其分子结构有紧密的联系[16-17],如果有机分子的结构改变,其紫外吸收光谱也就改变。经0.2 mol·L−1盐酸胍和0.2 mol·L−1尿素处理后的YInv和COS-Inv的紫外吸收光谱没有太大的变化,特征吸收峰均未发生明显位移,仅是吸光强度有所降低,这说明盐酸胍和尿素并未改变二者的构型,但却引起了肽链的构象变化[15,18-19]。
2.4 变性剂对YInv和COS-Inv紫外差示光谱的影响
紫外差示光谱的变化能进一步反映酶在有机溶剂中与Tyr及Trp残基有关的构象变化。220 nm和236 nm的差吸收与酶分子主链去折叠有关,232 nm的紫外差示吸收峰与主链的构象变化有关,蛋白质的α-螺旋结构的变化可能和236 nm差吸收的变化直接相关,260、285和292 nm差示吸收峰主要与Phe、Tyr和Trp有关[20]。
从图4(a)可见,YInv和COS-Inv在0.2 mol·L−1尿素中紫外差示光谱出现负吸收峰(190~340 nm),分别在214 nm和213 nm处有最大负吸收值。YInv的紫外差示光谱在214 nm有最大负吸收峰,及在大于220 nm的波段存在持续的负吸收,说明在此浓度下的尿素影响酶分子中的Trp、Tyr、Phe的微环境。COS-Inv在0.2 mol·L−1尿素中的紫外差光谱与YInv相似,但负吸收峰的位置则发生轻微红移,吸光值更小。由此推测,低浓度的尿素微扰了COS-Inv活性部位的构象,Trp和Tyr残基由极性环境转变成非极性环境,使解离状态的Tyr转变为非解离状态,导致紫外光吸收的减少,而Trp微环境的非极性化也使紫外光吸收减少。说明YInv和COS-Inv两者在尿素中二级结构构象都发生了变化[20-22]。
图4(b)的结果说明,在0.2 mol·L−1盐酸胍中YInv的紫外差示光谱出现了明显的负吸收峰和明显的正吸收,COS-Inv的紫外差示光谱也出现了明显的负吸收峰和轻微的正吸收。因而,YInv在209~227 nm有明显的负吸收峰,可能与酶分子主链的去折叠有关;而YInv和COS-Inv在190~208 nm以及COS-Inv大于227nm波段出现持续的正吸收,则可能与盐酸胍使肽链构象趋向松散,Trp和Tyr暴露有关。这说明,与在缓冲液中的实验结果比较,在盐酸胍中YInv和COS-Inv的二级结构构象都有变[20-22]。
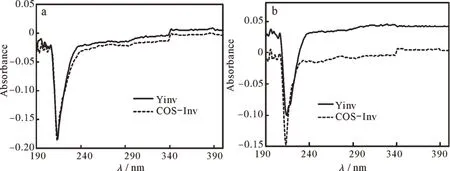
图4 变性剂对YInv和COS-Inv紫外差示光谱的影响:(a)0.2 mol·L−1尿素,(b)0.2 mol·L−1盐酸胍Fig.4 Effect of denaturing agents on ultraviolet differential spectra of YInv and COS-Inv:(a)0.2 mol·L−1 urea solution,(b)0.2 mol·L−1 GuHCl solution
2.5 变性剂对YInv和COS-Inv的荧光光谱的影响
蛋白质在270~300 nm的荧光吸收主要是来自Trp、Tyr和Phe,当用280 nm波长激发时,蛋白质的荧光光谱的最大值在313 nm和350 nm范围内,恰与Tyr荧光特征发射峰一致,后者恰与Trp一致[23]。溶剂和介质、生色基团的微环境、空间配置关系所引起的能量转移以及其解离的状态等因素都可以引起荧光发射光谱的变化[15]。
由图5可见,与在缓冲液中相比,YInv和COS-Inv在0.2 mol·L−1尿素及0.2 mol·L-1盐酸胍中的荧光发射峰的峰型及位置基本未出现变化,λmax为338~339 nm,说明YInv和COS-Inv在0.2 mol·L−1尿素及0.2 mol·L−1盐酸胍中的构型基本没有改变。但无论YInv还是COS-Inv,在两种变性剂中的荧光强度都出现不同程度的减弱。在变性剂中荧光强度的变化说明酶分子的构象已经发生了明显变化[14,18,21-22]。
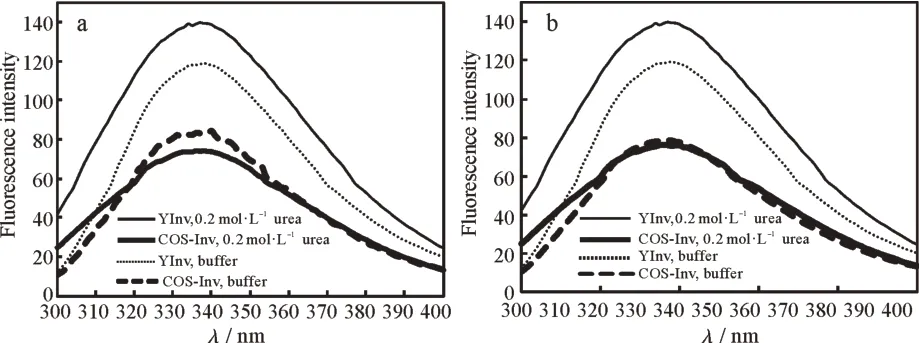
图5 变性剂对YInv和COS-Inv荧光光谱的影响:(a)0.2 mol·L−1尿素,(b)0.2 mol·L−1盐酸胍Fig.5 Effect of denaturing agents on fluorescence spectra of YInv and Cos-Inv:(a)0.2 mol·L−1 urea solution,(b)0.2 mol·L−1 GuHCl solution
在0.2 mol·L-1盐酸胍中,胍可能通过静电效应(由氯离子和胍离子与蛋白质相应带电基团的相互作用引起)激活蛋白质部分折叠中间态,诱导酶蛋白肽链伸展,改变了Trp残基微环境的空间结构,从而使得荧光有所淬灭。YInv和COS-Inv在0.2 mol·L-1尿素中的荧光发射峰值降低可能是由于尿素与酶蛋白分子表面Tyr残基形成更稳定的氢键[24]造成荧光淬灭;也可能是由于被激发分子向周围分子转移能量所至[25]。
3 结 论
综合上述YInv和COS-Inv在两种变性剂中的活性变化以及光谱分析,可见酶的活性变化与酶的分子构象(特别是活性部位的构象)密切相关。酶分子构象无论是趋向于伸展还是部分伸展、部分螺旋、折叠,都对酶分子活性中心产生很大影响[26]。氯乙醇之类的有机溶剂对蛋白质构象的影响与有机溶剂的浓度有密切关系。有机溶剂浓度低时,变性蛋白呈现易聚集的伸展构象;当浓度提高时,又逐渐变成了α-螺旋;有时,其螺旋含量超过天然状态的螺旋含量。此实验结果说明,变性蛋白质的构象也可以是紧密的构象[27]。当变性剂浓度达到一定程度后才发生导致活性丧失的紊乱构象或紧密构象等深度变化,使酶活性呈直线下降。从本实验来看,COS的引入以及在0.2 mol·L-1尿素中有利于YInv或COS-Inv的构象得到一定程度伸展。此构象的存在有利于酶与底物的结合和催化反应的进行,因而使酶激活。而盐酸胍使YInv或COS-Inv的构象变化剧烈,可能会使体系中的极性和介电常数减少,酶分子的静电斥力增大,多肽链会高度伸展,则不利于酶催化活力的构象的形成,造成酶变性失活。酶分子活性部位的相对柔性或运动性可能为酶的催化活力所必需,对于酶活性部位的功能基团的正确空间集合关系的任何细微变化都将影响酶的活力[22]。
变性剂可通过改变酶的空间构象而使酶激活,反过来也可以引起酶的失活。焦铭等[28]用“四态模型”来描述蛋白质在盐酸胍和尿素中的变性过程,即蛋白从天然态依次转变为蓬松的四聚体和部分折叠的无活性二聚体,并最终转变为去折叠态,也就是形成了变性中间态。本研究中,低浓度(<0.3 mol·L-1)的尿素促使COS-Inv活力升高。我们认为,COS-Inv在尿素变性过程中也形成了变性中间态——部分折叠的激活二聚体,此状态下的酶分子肽链部分伸展,形成一种开放式的结构,该结构有利于酶的催化作用。在盐酸胍的作用下,YInv和COS-Inv虽然也形成了变性中间态,但该结构却不利于酶的催化作用。此外,对于不同的酶,在同一种变性剂中所表现出来的作用效果也是不尽相同的。即使是同一种酶,由于研究手段以及变性剂的不同,也有可能得到不同的结果。在同样浓度的尿素作用下,COS-Inv表现为激活而YInv表现为抑制。这可能与酶分子的活性中心所处的位置以及变性剂的性质两者相互作用的结果有关。
