丛枝菌丝网络介导苜蓿植株间机械损伤信号的传递
2021-08-09李莎斯那永宗徐若字淑慧范林元刘涛
李莎,斯那永宗,徐若,字淑慧,范林元,刘涛*
丛枝菌丝网络介导苜蓿植株间机械损伤信号的传递
李莎1,斯那永宗2,徐若1,字淑慧1,范林元3*,刘涛1*
(1. 云南农业大学云南与生物技术学院, 昆明 650201;2. 德钦县升平镇人民政府农业综合服务中心, 云南 迪庆 674599;3. 云南省林木种苗站, 昆明 650201)
为了解植株间的菌丝网络(common mycorrhizal networks, CMNs)的功能,对丛枝菌根菌丝网络在紫花苜蓿()机械损伤信号传递中的作用进行了研究。结果表明,与经机械损伤处理的供体植株有CMNs连接的受体植株叶片中挥发物的数量和种类都显著高于无CMNs连接的植株;供体植株经机械损伤处理后,有CMNs连接的受体植株的超氧化物歧化酶(SOD)等抗逆酶活性都显著升高。这表明机械损伤诱导的防御信号可通过地下菌丝网络传递给邻近植株,激活邻近植株防御系统,使邻近未受机械损伤的苜蓿植株改变挥发性气体,并改变其防御酶活性,用以修复损伤带来的伤害。
紫花苜蓿;菌丝网络;防御信号;防御酶
植物的固着性使其必须时常能感知、处理和响应各种不同的环境刺激,包括各种生物胁迫和非生物胁迫。在长期进化过程中,植物已经进化出非常敏感的响应机制,能够感知这些信号并做出适当的反应[1]。在非生物胁迫中, 机械损伤最为常见,植物损伤后识别损伤信号,并启动适当的防御反应[2], 上调表达抗病相关和防御食草动物的基因。拟南芥()在机械损伤几分钟内,其防御相关酶活性迅速提高,并释放出大量信号物质[3], 如挥发物,此变化持续时间可达数小时[4]。另有研究表明,未受损的植株若暴露于受损伤植物释放的挥发物(volatile organic compounds, VOCS)中,也会表现出明显的防御反应[5],这种通过感受受伤植株释放的VOCS,提高自身防御基因表达水平的方式,有利于提前让邻近植物做好防御,提高对不利环境的适应能力。有研究表明,受伤红薯()释放的VOCs可以被邻近正常植株感知,从而激活其体内防御相关酶或启动防御系统[6]。目前, 关于植物地上部分气体交流的研究已有较多报道,但关于植株间地下部分防御信号交流的报道极少。
菌根菌丝网络(common mycorrhizal networks, CMNs)是同一物种的不同植株间,以及不同物种的植株间形成的菌丝桥,可构成植物间在地下进行物质交流的通道,进行无机营养物质和有机光合产物的传递,菌丝网络相当于“超级公路”,可将化感物质、信号传导物质作为早期防御信号传递给邻近植株[7–8]。有研究表明,CMNs可以介导番茄()植株间抗病抗虫防御信号的通讯,由CMNs介导的邻近植株会“窃听”到这种防御信号,促进邻近植株提前做好防御准备[8]。近年来对CMNs介导的抗病抗虫信号传递研究取得了一定进展,但关于菌丝网络能否在苜蓿()间传递机械信号还未见报道。
因此为了解机械损伤信号能否通过地下菌丝网络传递给邻近植株,本文通过隔绝地上部分的交流,采用紫花苜蓿构建地下菌丝网络,通过分析邻近苜蓿植株挥发性物质和相关防御酶活性的变化, 探讨受体苜蓿植株能否通过CMNs感知到机械损伤植株传递的防御信号,并启动抗性防御反应,为菌丝网络传递机械损伤信号的机理研究提供参考。
1 材料和方法
1.1 材料和试验设计
以模式植物紫花苜蓿()为材料,种子由中国科学院昆明植物所提供。播种前,将种子在70%乙醛中浸泡3 min,无菌水冲洗2 min后备用。苜蓿播种3周后,选择健康、长势一致的植株移栽入17 cm×17 cm×21 cm的塑料盆中,每盆8株小苗,放入温度为20℃~25℃、相对湿度为(60± 10)%的大棚中,日常管理用无菌水进行浇水。移栽50 d后移入西南生物多样性实验室,机械损伤处理前将整个盆栽用透明的玻璃箱罩住。
试验菌种 AMF单孢球囊霉()购买于中国丛枝菌根真菌种质资源库。栽培基质为腐殖土和黄土的混合物(2∶1), 121℃高压蒸汽湿热灭菌2 h,以消除土壤中的真菌孢子,冷却后装入装置盆,约为3/4盆高,浇水湿润,加入20 g菌剂(孢子、菌丝、定殖根段和沙子的混合物),再覆盖1.5 cm的土壤。
试验装置 试验装置(图1)连接处用30m的尼龙网和疏水膜间隔,避免两盆植物的根系和水分接触。用玻璃箱隔绝后进行机械损伤。试验设置4个处理,T1:接种AM菌且轻度机械损伤的主体植株(CMNW);T2:接种AM菌但无机械损伤的邻近植株(CMN),T3:未接菌且轻度机械损伤的主体植株(NCMNW), T4:未接菌无机械损伤的邻近植株(NCMN)。每个独立的实验装置分别有1个“机械损伤植株”和1个“邻近植株”组成。机械损伤是用灭菌的直径为0.5 cm的打孔器, 在苜蓿成熟叶片主脉两侧打孔,每盆每天打孔20个[8],连续损伤6 d,第
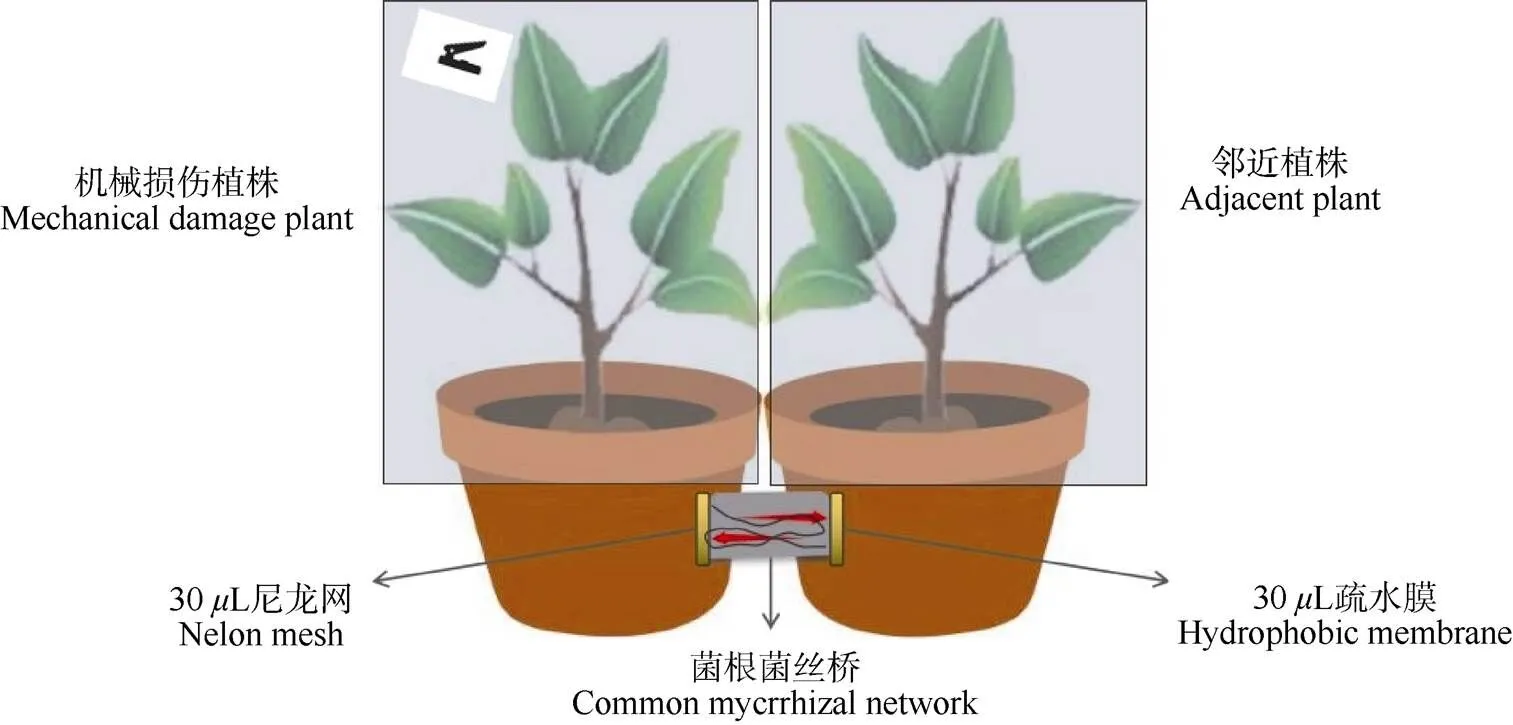
图1 试验装置示意图
1.2 菌根侵染率的测定
采用盛萍萍等[9]的方法。取若干1 cm长的根段洗净放入FAA固定液固定12 h,清洗5次后加入适量的20% KOH,在90℃下水浴30 min,然后用流水冲洗5次,在5%冰醋酸中浸泡5 min,用5%醋酸墨水染色,60℃水浴30 min,在清水中浸泡2 h, 再用Sudan染色液60℃水浴60 min,清水冲洗3 min, 70%乙醛脱色5 min,然后制片并观察。
1.3 酶活性的测定
称取0.1 g苜蓿叶片,加入1 mL的提取液,冰浴磨浆。在4℃下21.43×离心10 min,上清液为粗酶液。
超氧化物歧化酶(SOD) 粗酶液加入反应试剂充分混匀,25℃避光静置30 min。采用可见分光光度计在波长450 nm下测吸光值[10]。抑制百分比=[(A空白管1-A空白管2)-(A样本管-A样本对照管)]/(A空白管1-A空白管2)× 100%, SOD (U/g)=[抑制百分比/(1-抑制百分比)/样本质量]。
抗坏血酸过氧化物酶(APX) 粗酶液加入反应试剂充分混匀,25℃避光静置30 min。采用分光光度计在波长290 nm下分别测定30和300 s的吸光值,分别记为A1和A2,最终酶活性的吸光值为A=A1-A2,APX (mol/g)=(A×粗酶液体积/测定液体积×鲜质量)。
脂氧合酶(LOX) 粗酶液加入反应试剂充分混匀,25℃静置5 min。采用分光光度计在波长234 nm下测吸光值,LOX (U/g)=(10000/吸光值/叶片质量)。
植物丝裂原活化蛋白激酶(MKK1)和钙依赖性蛋白激酶(CPK11) 称取1 g苜蓿叶片,加入9 mL pH为7.2~7.4的PBS冰浴磨浆,在5.36×下离心20 min,收集上清液。酶标板上设置空白孔(空白孔不加样品及酶标试剂)、标准孔和样品孔,样品孔底部加入样品,轻轻混匀;用封板膜封板,于37℃温浴30 min,浓缩洗涤液用蒸馏水30倍稀释,每孔加满洗涤液,静置30 s后弃废液,重复4~5次;除空白孔外每孔加入酶标试剂50 mL;重复温浴和洗涤步骤;加入显色剂A 50 mL和显色剂B 50 mL, 轻轻混匀,37℃避光显色10 min, 加入终止液50 mL终止反应。在酶标仪450 nm波长下测量吸光值。
1.4 挥发性物质的GC-MS分析
采集的叶子用液氮研磨成细粉末, 取100 mg粉末加到1.5 mL离心管中。加入0.5 mL正己烷, 震荡30 s,然后放在冰上10 min,涡旋重复2次以上。提取结束后,从冰中取出离心管,在21.43×下离心1 min。取0.2 mL的有机层等份加入最终浓度为0.002%的内标物[11]。
采用气相色谱-质谱分析检测。气相条件:气相色谱柱HP-5MS (安杰龙5910), 进样口温度为230℃,检测器温度为180℃。以无分离模式加入1 mL加标样品。载气为氦气,流速为0.5 mL/min, 升温程序:初始柱温为50℃,保持3 min,然后以5℃/min升至200℃,再以10℃/min升至230℃,保持2 min。质谱条件:电离方式EI;电子能量70eV;接口温度280℃;阈值100;扫描/秒为2.67;扫描模式为全扫描(SCAN), 扫描范围40~450 aum。每个样品检测3次。
1.5 数据分析
采用Draw venn diagram和DPS软件录入数据和作图,用SPSS 20软件对数据进行统计分析。相关图表制作在Excel中完成。
2 结果和分析
2.1 AM真菌定殖
结果表明,接菌处理和不接菌处理的丛枝菌根真菌侵染率存在显著差异(图2),接菌处理的供体植株和受体植株的根系侵染率分别为76.3%和72.3%,说明AM真菌与苜蓿植株能建立良好的共生关系。从图3可以明显看出苜蓿植株根系中AM菌丝孢子结构,供体植株与受体植株之间建立了CMNs,而不接菌的苜蓿植株不管是供体植株还是受体植株的根系都没有发现菌丝侵染,其AM真菌侵染率几乎为零(图2)。AM真菌的定殖与CMNs的建立是本次试验开展的基础。
2.2 挥发性物质的测定
GC-MS分析表明,有菌丝网络(CMN)的邻近损伤受体苜蓿植株释放的挥发性有机物(VOCs)与对照(NCMN)的差异明显,供体紫花苜蓿植株连续机械损伤6 d后,邻近受体植株6和100 min的VOCs种类比NCMN增加近2倍,VOCs数量分别比NCMN增加了31%和24% (图4)。从表1可见,供体苜蓿植株机械损伤后,有CMNs连接的邻近健康受体苜蓿叶片挥发性气体的数量和种类都显著高于没有菌丝连接的对照,CMN 6 min和100 min分别检测出92和81种,NCMN 6 min和100 min分别检测出83和64种(图4)。CMN比NCMN增加了2-己烯醛、亚油酸、3,6-二甲基-癸烷、庚烷、亚油酸辛酯、2,4-二丁基苯酚、新戊二烯、亚油酸、正十四烷基、正十六酸、十六酸乙酯、亚油酸乙酯、角鲨烯等化合物。
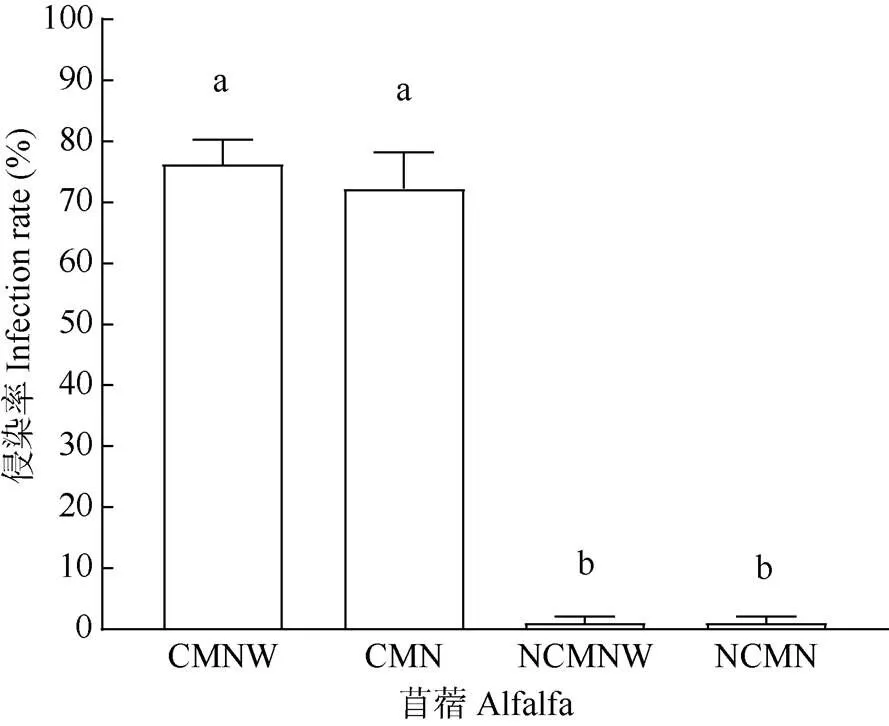
图2 苜蓿植株根部AM真菌的侵染率。CMNW: 接种AM菌且轻度机械损伤的供体植株; CMN: 接种AM菌无机械损伤的邻近植株; NCMNW: 未接菌且轻度机械损伤的主体植株; NCMN: 未接菌无机械损伤的邻近植株。以下图表同。
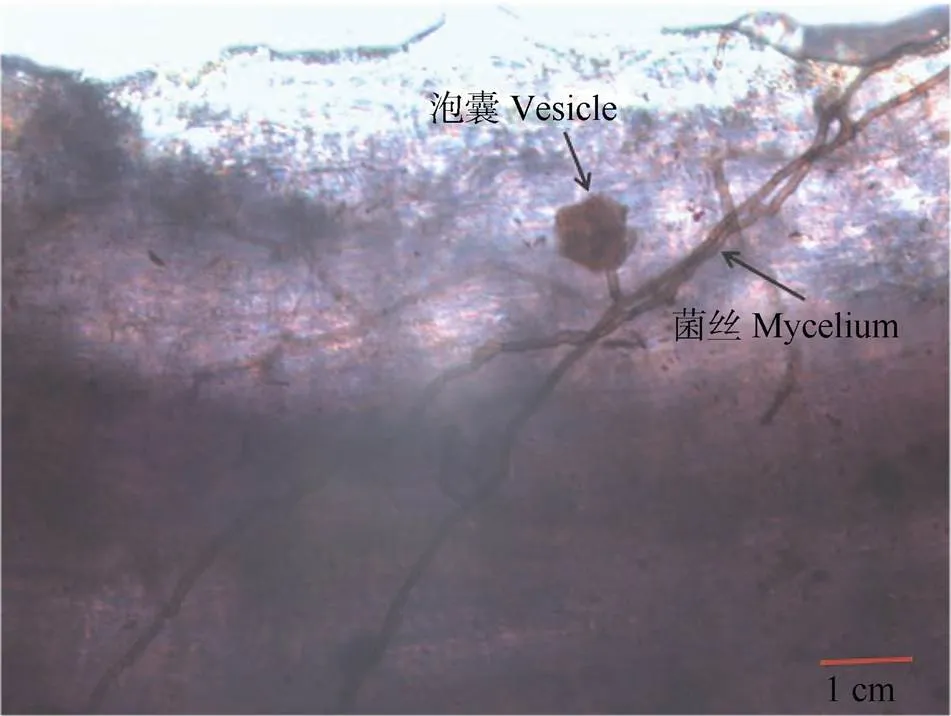
图3 醋酸墨水染色的苜蓿丛枝菌根
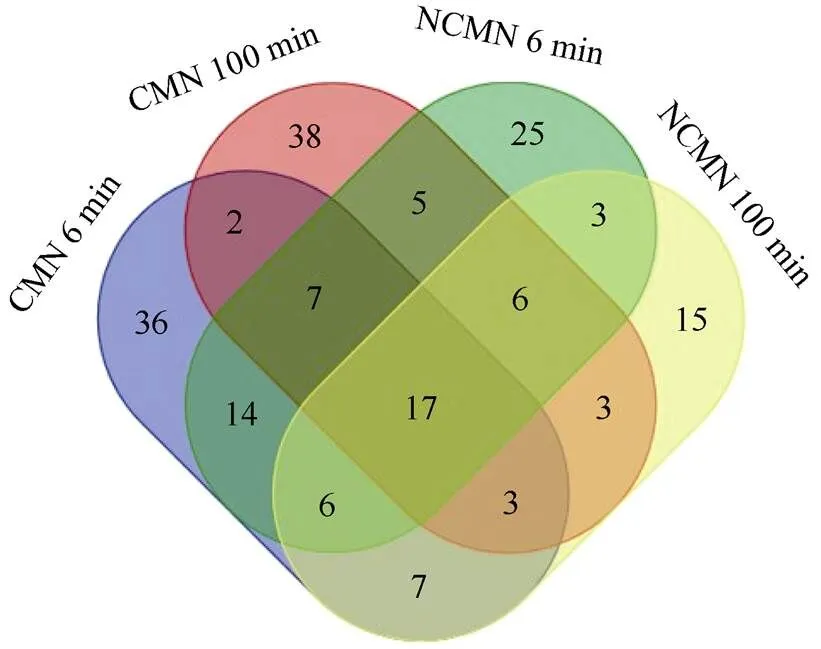
图4 不同处理间的挥发性物质
2.3 防御酶活性
从图5可见,未接菌供体植株机械损伤(NCMN)后,临近受体植株的超氧化物歧化酶(SOD)活性未表现升高的趋势;而接菌供体植株在机械损伤(CMN)后,临近受体植株的SOD活性显著升高, 100 min的SOD活性比6 min时升高了近2倍。NCMN临近受体植株的抗坏血酸过氧化物酶(APX)活性也未受影响,而CMN临近受体植株的则表现出先升高后降低的变化趋势。NCMN临近受体植株的脂氧合酶(LOX)活性也不受影响,而CMN临近受体植株的则急剧升高。NCMN和CMN临近受体植株的钙依赖性蛋白激酶(CPK11)和植物丝裂原活化蛋白激酶(MKK1)活性随时间延长而增加,6 min和100 min的活性差异显著。
3 结论和讨论
菌丝网络在参与植物地下资源的调节中起着非常重要的作用。有研究表明,CMNs会依据不同植物对养分的需求程度来进行分配[12],在植株间双向传递磷[13]和氮[14]。同时,CMNs还可以对水分[15]和化感物质[16]等进行传输,从而调节宿主植物间的竞争[17],增加群落和生态系统的稳定性和多样性[18]。
在抗病虫害信号传递方面,菌丝网络同样扮演着重要角色。有研究表明其可在相同或不同植物间进行抗病信号的传递。谢丽君等[19]和郭涛等[20]报道番茄和烟草()供体植物在受到病原菌侵染后,CMNs可将胁迫信号传递给受体植株,进而增强受体植株的抗病性。同样的,Song等[7]和Babikova等[15]报道了番茄和蚕豆() CMNs能够介导抗虫信号的传递。
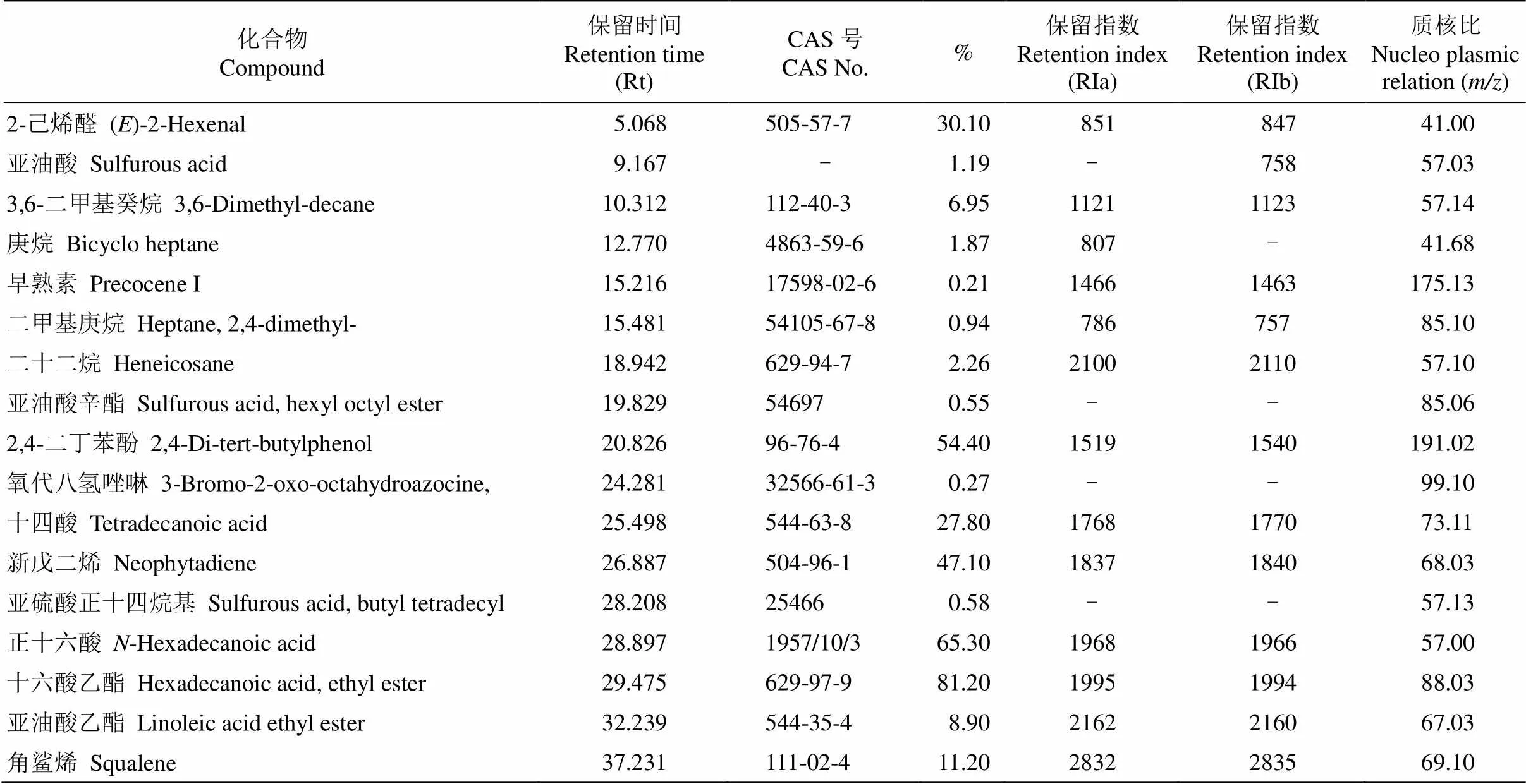
表1 CMN比NCMN增加的挥发性物质
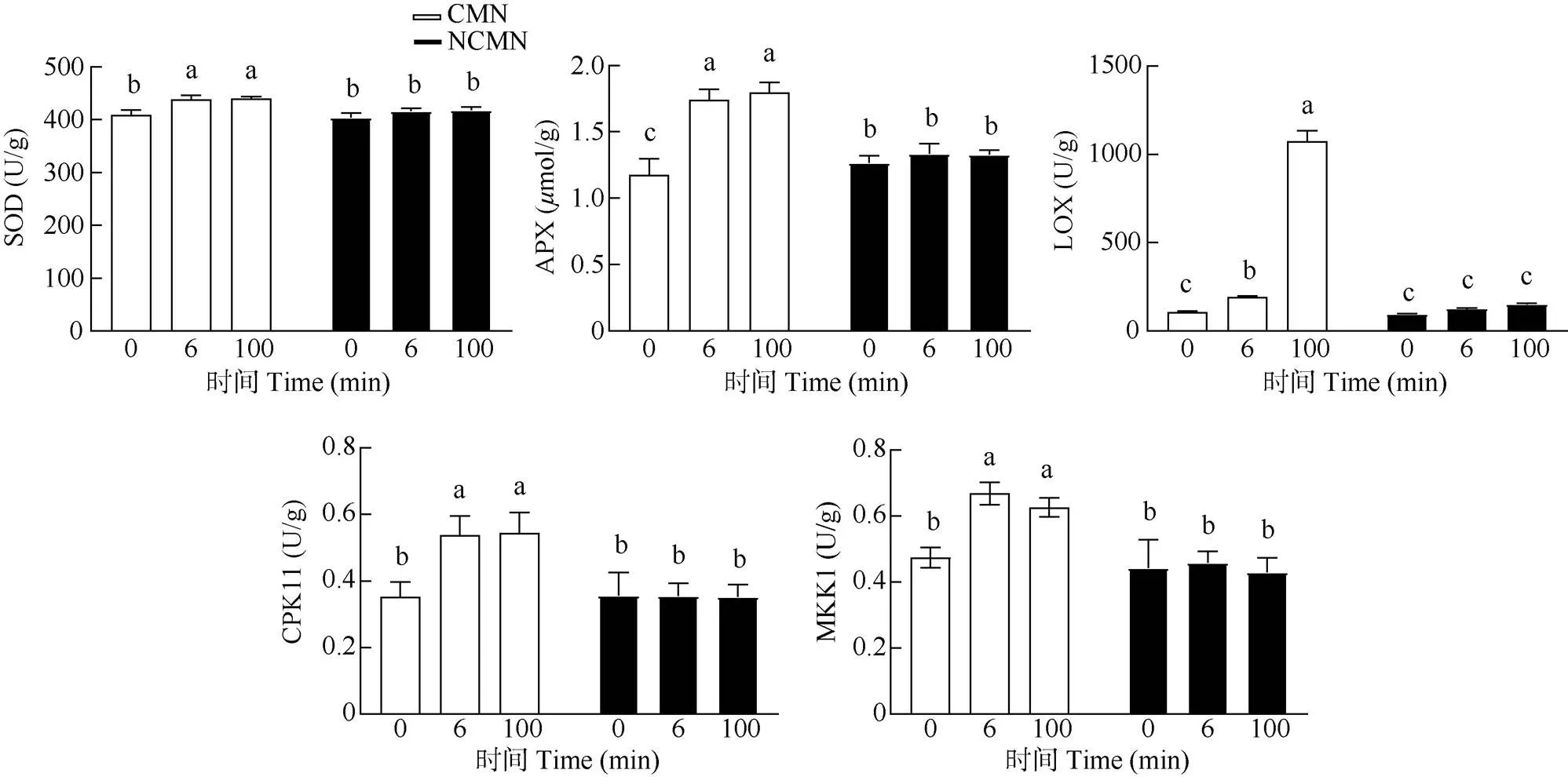
图5 苜蓿叶片的SOD、APX、LOX、CPK11和MKK1活性
仅廉法卓等[8]报道了CMNs介导植物间机械损伤信号的传导,供体番茄叶片损伤后,通过分析受体番茄抗逆酶活性的改变及抗逆基因的表达情况,证明机械损伤信号确实可以通过CMNs传递给邻近植物,从而使得周围健康植物提前做好防御准备。但对于这种传递信号是否会影响受体植株挥发性气体的改变以及是否在除番茄以外的植株上也具有此现象仍未知。
前人研究表明,醛类、酚类、烯类等物质能增加植物的抗虫性,减少蚜虫的取食[4]。本研究结果表明,对紫花苜蓿植株进行机械损伤后,防御信号物质可通过CMNs将防御信号快速的传递给邻近未机械损伤的植株。
另外,有CMNs连接的受体紫花苜蓿的SOD、LOX活性显著升高,而APX活性先急剧升高后下降;这种现象没有出现在有机械损伤但无CMNs连接的受体紫花苜蓿中;而CPK11、MKK1在不同处理间的差异并不显著。SOD是植物体内主要的抗氧化酶和活性氧清除剂,参与植物的防御反应过程中。刘萌萌等[21]的研究表明随机械损伤强度的增加,冷蒿()植株的抗氧化酶活性逐渐增强。脂氧合酶(LOX)是昆虫取食诱导的植物防御反应中的关键酶。已经证实各种胁迫因子包括机械损伤、昆虫取食和病原菌侵染都能诱导植物基因的表达[22]。利马豆()受到螨()取食危害后,和其他5种防卫基因的mRNA表达量增加, 从而使LOX活性增加; 当用被取食植株所产生的化合物处理未受侵袭的利马豆叶片时,同样能增加LOX活性及其基因的mRNA水平[23]。本研究中,有CMNs连接的受体紫花苜蓿的SOD、LOX活性显著升高,说明菌丝网络介导传递了损伤信号到受体植株,引起防御酶活性的升高。APX主要存在于质体,尤其是叶绿体中[24],其可将H2O2转化成H2O。本研究中APX活性先急剧升高后下降,推测受体苜蓿在接受损伤信号后100 min可能处于损伤修复阶段。
丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)级联途径作为最重要的信号转导途径,能将细胞膜表面受体感知到的信号通过磷酸化和去磷酸化作用逐级放大并传递到细胞内,靶向激活胞质或核内的其他激酶、酶或转录因子等效应蛋白,调节特定基因的表达,从而促使细胞、组织、器官、整个生物体做出相应的生理生化反应,进而适应环境和抵御逆境胁迫[25];钙依赖蛋白激酶是植物中研究较多的一类丝氨酸/苏氨酸蛋白激酶, 分布于植物和一些原生生物中[26],可以通过对钙的调节来稳定细胞膜结构, 维持细胞壁结构, 对植物代谢中产生的酸进行中和,消除过量有机酸对细胞的毒害, 提高植物的抗病害能力。本试验中这两种酶在NCMN处理中随着取样时间变化并未发生改变,而CMN处理中,两种酶活性随着时间延长逐渐升高,表明损伤信号在苜蓿植株间发生传递,说明菌丝网络可以介导机械损伤信号在植株间的传递。
本研究排除了苜蓿根系分泌物、地上部挥发物的影响,结果表明有菌丝连接的受体苜蓿植株的防御反应最强烈,证明了CMNs可介导苜蓿植物间机械损伤信号的通讯。由此可见,在接种菌根建立CMNs后,当供体紫花苜蓿植物受到机械损伤,其可将这种损伤信号通过CMNs传递给受体,并激活受体植株防御反应。CMNs在生态系统中起重要作用,CMNs可作为苜蓿植株间机械损伤信号传递的通道,丰富了我们对植物通过CMNs进行地下信号传递的认知,对菌根微生物学的发展和农业生产实践都具有重要的意义。
[1] BRAAM J. In touch: Plant responses to mechanical stimuli [J]. New Phytol, 2005, 165(2): 373–389. doi: 10.1111/j.1469-8137.2004.01263.x.
[2] ANTEN N P R, ALCALÁ-HERRERA R, SCHIEVING F, et al. Wind and mechanical stimuli differentially affect leaf traits in[J]. New Phytol, 2010, 188(2): 554–564. doi: 10.1111/j.1469- 8137.2010.03379.x.
[3] CHEHAB E W, YAO C, HENDERSON Z, et al.touch- induced morphogenesis is jasmonate mediated and protects against pests [J]. Curr Biol, 2012, 22: 701–706. doi: 10.1016/j.cub.2012.02.061.
[4] MARKOVIC D, COLZI I, TAITI C, et al. Airborne signals synchro- nize the defenses of neighboring plants in response to touch [J]. J Exp Bot, 2019, 70(2): 691–700. doi: 10.1093/jxb/ery375.
[5] MEIER A R, HUNTER M D. Mycorrhizae alter constitutive and herbivore-induced volatile emissions by Milkweeds [J]. J Chem Ecol, 2019, 45(7): 610–625. doi: 10.1007/s10886-019-01080-6.
[6] MEENTS A K, CHEN S P, REICHELT M, et al. Volatile DMNT syste- mically induces jasmonate-independent direct anti-herbivore defense in leaves of sweet potato () plants [J]. Sci Rep, 2019, 9 (1): 17431. doi: 10.1038/s41598-019-53946-0.
[7] SONG Y Y, ZENG R S, XU J F, et al. Interplant communication of tomato plants through underground common mycorrhizal networks [J]. PLoS One, 2010, 5(10): e13324. doi: 10.1371/journal.pone.0013324.
[8] LIAN F Z, LIN Y B, HU L, et al. Transfer of mechanical wounding signaling between tomato plants through common mycorrhizal net- works [J]. JFujian AgricFor Univ(Nat Sci), 2019, 48(1): 9–15. doi: 10. 13323/j.cnki.j.fafu(nat.sci.).2019.01.003.
廉法卓, 林熠斌, 胡林, 等. 菌根菌丝网络介导的番茄植株间机械损伤信号的传递 [J]. 福建农林大学学报(自然科学版), 2019, 48(1): 9–15. doi: 10.13323/j.cnki.j.fafu(nat.sci.).2019.01.003.
[9] SHENG P P, LIU R J, LI M. Methodological comparison of obser- vation and colonization measurement of arbuscular mycorrhizal fungi [J]. Mycosystema, 2011, 30(4): 519–525. doi: 10.13346/j.mycosystema. 2011.04.002.
盛萍萍, 刘润进, 李敏. 丛枝菌根观察与侵染率测定方法的比较 [J]. 菌物学报, 2011, 30(4): 519–525. doi: 10.13346/j.mycosystema. 2011.04.002.
[10] MAO H, CHEN H, LIU X X, et al. Effects offeeding and mechanical damage on defense enzyme activities in cotton leaves [J]. Chin Bull Entomol, 2011, 48(5): 1431–1436.
毛红, 陈瀚, 刘小侠, 等. 绿盲蝽取食与机械损伤对棉花叶片内防御性酶活性的影响 [J]. 应用昆虫学报, 2011, 48(5): 1431–1436.
[11] HIJAZ F, NEHELA Y, KILLINY N. Possible role of plant volatiles in tolerance against Huanglongbing in[J]. Plant Signal Behav, 2016, 11(3): e1138193. doi: 10.1080/15592324.2016.1138193.
[12] WALDER F, NIEMANN H, NATARAJAN M, et al. Mycorrhizal networks: Common goods of plants shared under unequal terms of trade [J]. Plant Physiol, 2012, 159(2): 789–797. doi: 10.1104/pp.112.195727.
[13] LEKBERG Y, HAMMER EC, OLSSON PA. Plants as resource islands and storage units-adopting the mycocentric view of arbuscular mycorrhizal networks [J]. FEMS Microbiol Ecol, 2010, 74(2): 336–345. doi: 10.1111/j.1574-6941.2010.00956.x.
[14] FREY B, SCHUEPP H. Transfer of symbiotically fixed nitrogen from berseem (L.) to maizevesicular-arbuscular mycorrhizal hyphae [J]. New Phytol,1992, 122(3): 447–454. doi: 10. 1111/j.1469-8137.1992.tb00072.x.
[15] EGERTON-WARBURTON LM, QUEREJETA JI, ALLEN MF. Common mycorrhizal networks provide a potential pathway for the transfer of hydraulically lifted water between plants [J]. J Exp Bot, 2007, 58(6): 1473–1483. doi: 10.1093/jxb/erm009.
[16] BABIKOVA Z, GILBERT L, BRUCE TJ A, et al. Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack [J]. Ecol Lett, 2013, 16(7): 835–843. doi: 10.1111/ele. 12115.
[17] VAN DER HEIJDENMGA, BARDGETT RD, VAN STRAALENN M. The unseen majority: Soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems [J]. Ecol Lett, 2008, 11(3): 296– 310. doi: 10.1111/j.1461-0248.2007.01139.x.
[18] SELOSSE MA, RICHARD F, HE X H, et al. Mycorrhizal networks:? [J]. Trends Ecol Evol, 2006, 21(11): 621– 628. doi: 10.1016/j.tree.2006.07.003.
[19] XIE L J, SONG Y Y, ZENG R S, et al. Disease resistance signal transfer between roots of different tomato plants through common arbuscular mycorrhiza networks [J]. Chin J Appl Ecol, 2012, 23(5): 1145–1152. doi: 10.13287/j.1001-9332.2012.0189.
谢丽君, 宋圆圆, 曾任森, 等. 丛枝菌根菌丝桥介导的番茄植株根系间抗病信号的传递 [J]. 应用生态学报, 2012, 23(5): 1145–1152. doi: 10.13287/j.1001-9332.2012.0189.
[20] GUO T, LIU X L, SHEN H. The effect of transfer between roots of different tobacco plants through common arbuscular mycorrhiza networks on enzyme activities related to disease resistance [J]. J Plant Protect, 2015, 42(3): 390–395. doi: 10.13802/j.cnki.zwbhxb.2015.03.016.
郭涛, 刘先良, 申鸿. 丛枝菌根菌丝桥传递作用对烟草抗病性相关酶活性的影响 [J]. 植物保护学报, 2015, 42(3): 390–395. doi: 10. 13802/j.cnki.zwbhxb.2015.03.016.
[21] LIU M M, JIA L, CHENG L Y, et al. Responses of phenolic acid and defensive enzyme activities to mechanical damage in[J]. Chin J Plant Ecol, 2017, 41(2): 219–230. doi: 10.17521/cjpe.2016. 0161.
刘萌萌, 贾丽, 程路芸, 等. 冷蒿酚酸及其抗氧化防御酶活性对机械损伤的响应 [J]. 植物生态学报, 2017, 41(2): 219–230. doi: 10. 17521/cjpe.2016.0161.
[22] ARIMURAG I, OZAWAR, HORIUCHI J I, et al. Plant-plant inter- actions mediated by volatiles emitted from plants infested by spider mites [J]. Biochem Syst Ecol, 2001, 29(10): 1049–1061. doi: 10.1016/ S0305-1978(01)00049-7.
[23] MARKOVIC D, NIKOLIC N, GLINWOOD R, et al. Plant responses to brief touching: A mechanism for early neighbour detection? [J].PLoS One, 2016, 11(11): e0165742. doi: 10.1371/journal.pone.0165742.
[24] HARMON A C, GRIBSKOV M, GUBRIUM E, et al. The CDPK superfamily of protein kinases [J]. New Phytol, 2001, 151(1): 175–183. doi: 10.1046/j.1469-8137.2001.00171.x.
[25] XU J, ZHANG S Q. Mitogen-activated protein kinase cascades in signaling plant growth and development [J]. Trends Plant Sci, 2015, 20(1): 56–64. doi: 10.1016/j.tplants.2014.10.001.
[26] ZHANG W, SHEN Y B, SHEN Y Y. Effect of mechanical wounding on the content of hydrogen peroxide in ashleaf maple seedlings [J]. For Res, 2007, 20(1): 125–129. doi: 10.3321/j.issn:1001-1498.2007.01.024.
张雯, 沈应柏, 沈瑗瑗. 机械损伤对复叶槭叶片过氧化氢含量的影响 [J]. 林业科学研究, 2007, 20(1): 125–129. doi: 10.3321/j.issn: 1001-1498.2007.01.024.
Defense Signal Transmission between Alfalfa Plants through Underground Mycorrhizal Network
LI Sha1, SINA Yong-zong2, XU Ruo1, ZI Shu-hui1, FAN Lin-yuan3*, LIU Tao1*
(1. College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China; 2. Agricultural Comprehensive Service Center of Shengping Town People’s Government of Deqin County, Diqin 674599, Yunnan, China; 3. Yunnan Forest Seedling Station, Kunming 650201, China)
In order to understand the function of common mycorrhizal networks (CMNs) among plants, its role in mechanical damage signal transduction ofwas studied. The results showed that analyzed whether the damage signal of donor plants could be transmitted to the neighboring recipient plants through CMNs. The number and kinds of volatile compounds in leaves of recipient plants connected with CMNs were significantly higher than those connected without CMNs. The activities of defense enzyme also increased significantly in recipient plants connected with CMNs. Therefore, it was suggested that the defense signals induced by mechanical damage could be transmitted to neighboring plants through CMNs, which activates the defense system of neighboring plants, so that the nearby alfalfa plants without mechanical damage changed the volatile gas and the defense enzyme activity, so as to repair the damage caused by the damage.
; Mycorrhizal network; Defense signal; Defense enzyme
10.11926/jtsb.4308
2020–09–10
2020–11–18
国家自然科学基金项目(81473310)资助
This work was supported by the National Natural Science Foundation of China (Grant No. 81473310).
李莎(1995~ ),女,在读硕士研究生,主要从事土壤微生物与滇重楼共生及促生长的机理研究。E-mail: 1786508690@qq.com
E-mail:52133490@qq.com
猜你喜欢
杂志排行
热带亚热带植物学报的其它文章
- 增温对鼎湖山混交林中4种优势树种生物量分配和养分积累的影响
- 粉叶小檗(小檗科)的形态变异式样及分类修订
- Pholidota advena (Par. & Rchb. f.) Hook. f., A Newly Recorded Species of Orchidaceae from China
- Agapetes nana, A Newly Recorded Species of Ericaceae from China
- Michelia taishanensis Y. H. Tong, X. E. Ye, X. H. Ye & Yu Q. Chen (Magnoliaceae), A New Species from Guangdong
- 基于热消散探针法的植物水分运输的研究进展
