四种乳酸菌发酵西梅浆的特性研究
2021-08-09戴志伟张玥伊力夏提艾热提严宏孟殷思思李芳孔令明
戴志伟,张玥,伊力夏提·艾热提,严宏孟,殷思思,李芳,孔令明*
1(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐,830000) 2(新疆轻工职业技术学院,新疆 乌鲁木齐,830000)
欧洲李(PrunusdomesticaL.),在国内常称其为西梅,是蔷薇科,李属果树的果实,富含纤维素、维生素A、钾、铁、叶酸等多种营养素及微量元素,被誉为“功能水果”。不同的西梅果实品种在感官特性等方面也有不同[1-2],“法兰西”西梅硬度小、风味浓甜,极适鲜食;“女神”西梅有机酸含量高、硬度大,但相较其他品种的西梅更便于运输保藏也有更强的抗氧化活性,适合进行深加工。相关研究已经证实西梅优良的抗氧化特性、辅助治疗骨质疏松的作用以及缓解便秘、抗结肠癌、保护心血管等功效[3-5]。新疆有野生种欧洲李的分布[6],是李属植物的发源地之一,开展西梅的深加工研究可以更好地提高西梅的经济价值。
西梅鲜果可加工成果脯、果汁、果酱等产品,但目前市场上西梅产品种类较为单一,除鲜食外多制成果干。近年来有关果蔬发酵的研究逐渐增多,益生菌发酵是维持或改善蔬菜、水果以及衍生食品贮藏特性及食用特性最简单和有价值的生物技术方法。利用乳酸菌发酵果蔬可以提升其抗氧化活性[7],分解大分子营养物质[8],有利于人体吸收消化,同时改善口感增加香气[9],提高产品的食用价值。VERN等[10]利用乳酸菌发酵仙人掌,发酵产物可以在保存原有营养物质及活性成分的基础上延长保存期,进一步证实乳酸菌发酵果蔬具有很好的研究价值。
本实验以新疆“女神”西梅为原料,分别用果蔬发酵常用的植物乳杆菌、研究与应用较为成熟的保加利亚乳杆菌和嗜热链球菌、筛分自与“女神”西梅同产区(喀什)的奶酪样品中的瑞士乳杆菌对西梅浆进行发酵,探究发酵过程中总酸、总糖、总酚和体外抗氧化活性等变化趋势,总结4种乳酸菌发酵西梅浆的不同特性及在发酵周期(96 h)内对物质变化的影响,以期为发酵果蔬制品的菌种选择及加工方向提供参考,对以西梅或李属植物果实为原料的发酵产品开发提供科学依据。
1 材料与方法
1.1 材料、菌株与试剂
1.1.1 材料与菌种
新疆“女神”西梅,新疆喀什地区伽师县;保加利亚乳杆菌(LactobacillusbulgaricusJYLB-19)、嗜热链球菌(StreptococcusthermophilusJYSR-26)、植物乳杆菌(LactobacillusplantarumJYLP-326),中科嘉亿生物有限公司;瑞士乳杆菌(LactobacillushelveticusA25)(分离自新疆伊犁地区奶酪样品),实验室保藏。
1.1.2 试剂
MRS培养基、MRS肉汤培养基,北京奥博星生物技术有限公司;福林酚试剂、蔗糖,北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苦肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS],上海源叶生物科技有限公司;H2SO4、水杨酸、FeCl3、K3[Fe(CN)6]等试剂,天津市北联精细化学品开发有限公司。
1.2 仪器与设备
VD-850型桌上式(垂直)送风净化工作台,苏州博莱尔净化设备有限公司;DHP-9162微生物恒温培养箱,上海一恒科技有限公司;UV-1200紫外分光光度计,北京普析通用有限责任公司;PHS-3C型雷磁pH计,上海仪电科学仪器股份有限公司。
1.3 实验方法
1.3.1 乳酸菌生长曲线的绘制
以体积分数2%的接种量将4种活化后的乳酸菌接入250 mL MRS液体培养基中,以未接种菌种的MRS液体培养基作为空白对照,37 ℃恒温培养,每隔2 h测定其在600 nm波长处的OD值,菌种进入稳定期后每隔4 h测定。横坐标为生长时间,纵坐标为吸光度,绘制4株乳酸菌的生长曲线。
1.3.2 发酵种子液的制备
乳酸菌的活化与扩大培养:将保存于斜面的乳酸菌分别接入MRS 固体培养基上,37 ℃恒温培养,连续传代活化培养3代,从MRS固体培养基上挑取单菌落菌体,接种至 MRS 液体培养基中,37 ℃ 恒温培养 24~36 h 后取出,振荡均匀后,按照体积分数2% 的接种量接种进行扩大培养(37 ℃,24~36 h),得到乳酸菌菌悬液(菌悬液浓度≥1×107CFU/mL)备用。
1.3.3 西梅浆的制备
挑选新鲜、硬度适中、新鲜的“女神”西梅,清水漂洗沥干、去核,为打浆彻底,按西梅与水1∶1 的质量比进行打浆,加入质量分数0.2%D-异抗坏血酸钠在打浆过程中进行护色;用 NaHCO3溶液和柠檬酸将西梅浆pH值调节至4.50~5.00,用蔗糖将西梅浆的糖度调节至12°Brix,为杀菌彻底和防止酶促褐变,将西梅浆煮沸3~5 min进行灭菌和灭酶处理,冷却后放入灭菌的取样瓶中。
1.3.4 西梅浆的接种和发酵
分别以5%的接种量接种4种乳酸菌,以未接种的西梅浆为空白对照。在37 ℃恒温培养箱静置发酵96 h,每24 h取样1次进行测定,接入菌液后的时间记为0 h。
1.3.5 理化指标的测定
1.3.5.1 pH值的测定
用PHS-3C型pH计直接测定。
1.3.5.2 总酸含量的测定
参考GB/T 12456—2008《食品中总酸的测定》酸碱滴定法[11]。
1.3.5.3 色差的测定
用手持式色差仪测定。其中L*值表示发酵西梅浆的亮度,a*值表示红色-绿色,b*值表示黄色-蓝色。ΔL*、Δa*、Δb*为西梅浆发酵后的L*、a*、b*与发酵0 h时L*、a*、b*的差值。
1.3.5.4 总糖含量的测定
参考曹建康[12]的蒽酮试剂法进行测定。
1.3.5.5 总酚含量的测定
采用福林-酚比色法测定[13],以没食子酸作为标准品制作标准曲线(y=0.628 9x+0.019 2,R2=0.997 9)。每 1 mL西梅浆发酵液中总多酚含量以没食子酸记,单位为mg/L,重复3次实验,取平均值。
1.3.6 体外抗氧化活性测定
1.3.6.1 DPPH自由基清除能力的测定
根据文献[14],稍做修改:取2 mL离心后的稀释发酵液加入新配制的0.2 mmol/L DPPH溶液2 mL,摇匀后在避光处静置30 min,后在波长517 nm处测定吸光值。平行测定3次,根据公式(1)计算DPPH自由基清除率:
(1)
式中:A1,为发酵液于DPPH溶液反应后的吸光度(样品组);A2,为发酵液及2 mL无水乙醇溶液的吸光度(空白组);A3,为2 mL DPPH溶液及2 mL蒸馏水的吸光度(对照组)。
1.3.6.2 ABTS阳离子自由基清除率的测定
根据文献[15],稍做修改:进行ABTS阳离子自由基清除率测定时用无水乙醇将ABTS工作液的吸光度处调节至(0.70±0.02),此时的液体为ABTS的测定液。以样品与测定液按1∶3的体积比充分混合,在室温避光的条件下静置30 min,在波长为734 nm处测定吸光值。平行测定3次,根据公式(2)计算ABTS阳离子自由基清除率:
(2)
式中:A1,以蒸馏水代替样品的样液吸光度(空白组);A2,样品为发酵液的样液吸光度(样品组)。
1.3.6.3 还原力的测定
根据文献[16],修改如下:将离心后的发酵液适当稀释后与2.5 mL质量分数为1%的K3[Fe(CN)6]溶液和2.5 mL 0.2 mol/L的磷酸盐缓冲液(pH 6.6)混合均匀后于50 ℃水浴20 min,后迅速在4 ℃冰水中冷却5 min,加入2.5 mL质量分数为10% 的三氯乙酸溶液,均匀混合后3 500 r/min离心10 min,取2.5 mL上清液加2.5 mL蒸馏水和0.5 mL质量分数为0.1%的FeCl3溶液,室温下静置10 min后在波长700 nm处测定吸光值。平行测定3次,样品的吸光值越高说明还原能力越强。
2 结果与分析
2.1 不同乳酸菌的生长曲线
由图1所示,保加利亚乳杆菌、嗜热链球菌、植物乳杆菌在MRS液体培养基中无明显滞后期,10 h内进入稳定期,从对数生长期进入稳定期的过渡时间较短。其中植物乳杆菌在测试时间内菌体数量最多,保加利亚乳杆菌次之;瑞士乳杆菌与其他3株菌相比,滞后期较长,在20 h才能逐渐进入稳定期,且从对数生长期到稳定期需要一定过渡,测试时间内菌体数量相对较少。因此,保加利亚乳杆菌、植物乳杆菌和嗜热链球菌相较于瑞士乳杆菌活力更高。

图1 不同乳酸菌的生长曲线
2.2 不同乳酸菌发酵对西梅浆pH值及总酸含量的影响
初始pH值会影响西梅浆的颜色,在最大限度保证色泽的同时,为给菌种提供合适的初始pH值,选择用NaHCO3溶液将初始西梅浆的pH值调整为4.5~5。由图2所示,4株乳酸菌在发酵过程中代谢产生乳酸等有机酸,pH值均降低。其中保加利亚乳杆菌和植物乳杆菌发酵的西梅浆在24 h内pH值显著下降,对照图1的生长曲线,这2株菌在24 h时的菌体数量相对较多。随着发酵时间的延长,较低的pH逐渐对菌种的活力及代谢能力产生抑制[17],保加利亚乳杆菌和植物乳杆菌发酵西梅浆的pH值分别在24和48 h后趋于平缓,但一直呈现稳定下降趋势且最终pH值降至3.6左右。嗜热链球菌和瑞士乳杆菌的发酵浆的pH值下降较为平缓,最终的pH值显著高于植物乳杆菌发酵组。这与黄艳[18]的研究一致,植物乳杆菌相比于其他乳酸菌可把环境pH值降至更低,相关研究报道,利用植物乳杆菌发酵果蔬时,存在苹果酸-乳酸发酵(malolactic fermentation,MLF)的降酸过程,但产酸降低pH为主要代谢过程[18]。
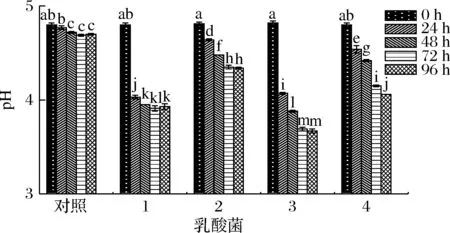
1-保加利亚乳杆菌;2-嗜热链球菌;3-植物乳杆菌;4-瑞士乳杆菌
总酸含量的增加是西梅浆发酵过程中,有机酸的逐渐溶出和乳酸菌发酵产酸的共同作用结果[19]。如图3所示,对照组在0~24 h内总酸含量的轻微增高可能是有机酸溶出的结果。保加利亚乳杆菌、植物乳杆菌和瑞士乳杆菌的总酸含量随发酵时间的延长都有所增加,保加利亚乳杆菌和植物乳杆菌发酵过程中,总酸含量达到10.68和12.11 g/L;瑞士乳杆菌在0~24 h内增长缓慢,与图1生长曲线中的滞后期相对应。嗜热链球菌发酵组和对照组的总酸在发酵过程中总酸含量差别不大,说明嗜热链球菌在以西梅浆为基质的发酵过程中产酸能力相对较弱。
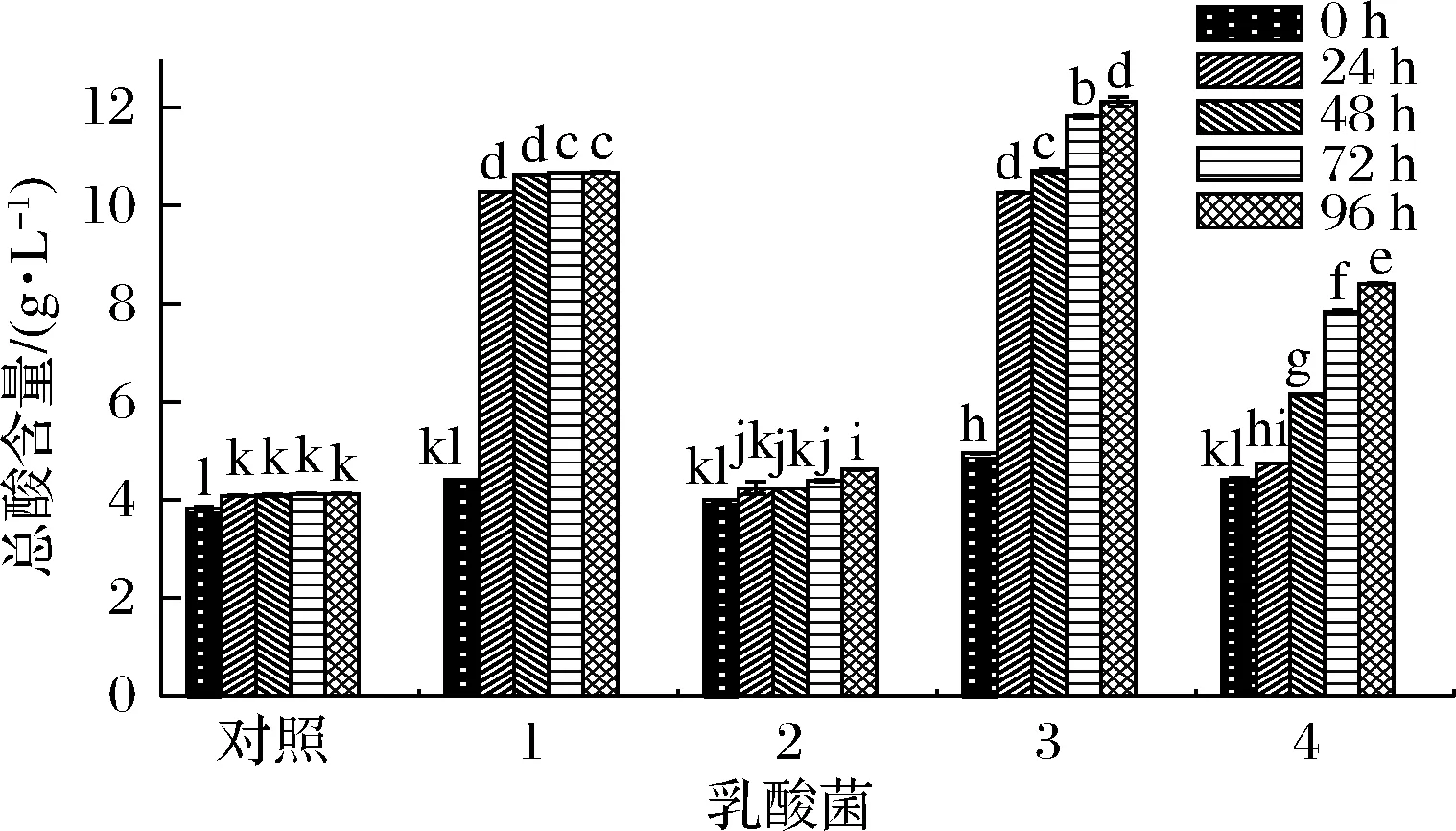
1-保加利亚乳杆菌;2-嗜热链球菌;3-植物乳杆菌;4-瑞士乳杆菌
2.3 不同乳酸菌发酵对西梅浆色差的影响
西梅浆的颜色受初始pH值的影响,同时也与发酵过程中pH值的变化及酚类物质的类型、含量有关[20-21]。花色苷是西梅果实中主要的呈色物质,溶液的pH值会使花色苷的结构发生转变,从而体现为颜色的差异,总体上说,花色苷在酸性条件下偏红,随着pH值的升高而呈现出无色或偏蓝的变化[22-23]。由图4所示,4株菌在发酵过程中的△L*均高于对照组,说明4种乳酸菌发酵均可提高西梅浆的亮度,保加利亚乳杆菌、嗜热链球菌、植物乳杆菌在提升亮度方面的作用较为显著。在发酵过程中,5个发酵组的△a*均升高,说明随着发酵时间的延长,5组发酵液的颜色均向红色偏移,植物乳杆菌发酵组在发酵终期的△a*最大,说明植物乳杆菌发酵组的颜色向红偏移最多,对照发酵浆的pH值变化,植物乳杆菌发酵组的pH值相对最低,说明色度的变化和溶液pH值有关,红度与菌种产酸性能呈正相关。对照组和4个发酵组的△b*均增加,其中嗜热链球菌发酵组在发酵过程中向黄色偏移较为显著(P>0.05)。
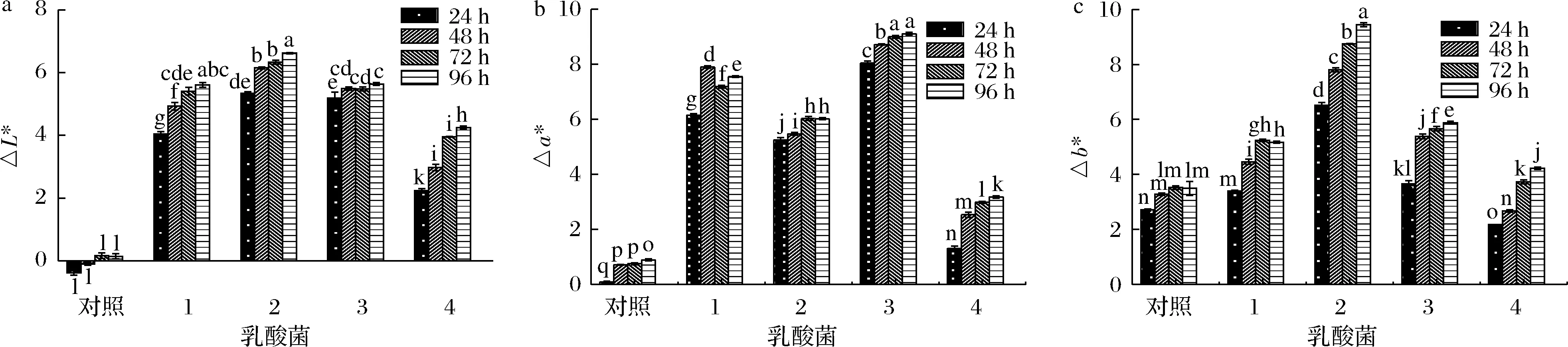
1-保加利亚乳杆菌;2-嗜热链球菌;3-植物乳杆菌;4-瑞士乳杆菌
2.4 不同乳酸菌发酵对西梅浆总糖含量的影响
如图5所示,在发酵过程中,对照组的总糖含量变化较小,除瑞士乳杆菌外,其他3个发酵组的总糖含量均在0~24 h内大幅下降,说明处于对数生长期的乳酸菌大量消耗糖类物质,48 h后总糖含量的变化趋于平稳,与菌种逐渐进入稳定期有关,也可能是较低的pH值限制了菌种的生长影响了对糖类的代谢。瑞士乳杆菌发酵组相较于图1的生长曲线,对于糖的消耗也体现出了明显的滞后期。

1-保加利亚乳杆菌;2-嗜热链球菌;3-植物乳杆菌;4-瑞士乳杆菌
结合图2,保加利亚乳杆菌、嗜热链球菌、植物乳杆菌和瑞士乳杆菌发酵组在48 h的pH值(3.95、4.48、3.88、4.42)也说明了4种乳酸菌对pH的耐受性不同,植物乳杆菌相较其他3株菌,可耐受更低pH值的环境,因此在终点的总糖含量最低(71.79 g/L)。且在此时间内植物乳杆菌发酵组的pH值依然在逐渐下降、总酸含量逐渐上升,说明植物乳杆菌仍处于分解代谢中,可进一步推断植物乳杆菌在较低的pH下进行MLF,在进行糖酵解产生丙酮酸的同时将苹果酸转换成乳酸[24],使发酵体系的pH值不断降低。
2.5 不同乳酸菌发酵对西梅浆中总酚含量的影响
如图6所示,5组样品的总酚含量在0~96 h内呈现下降趋势。
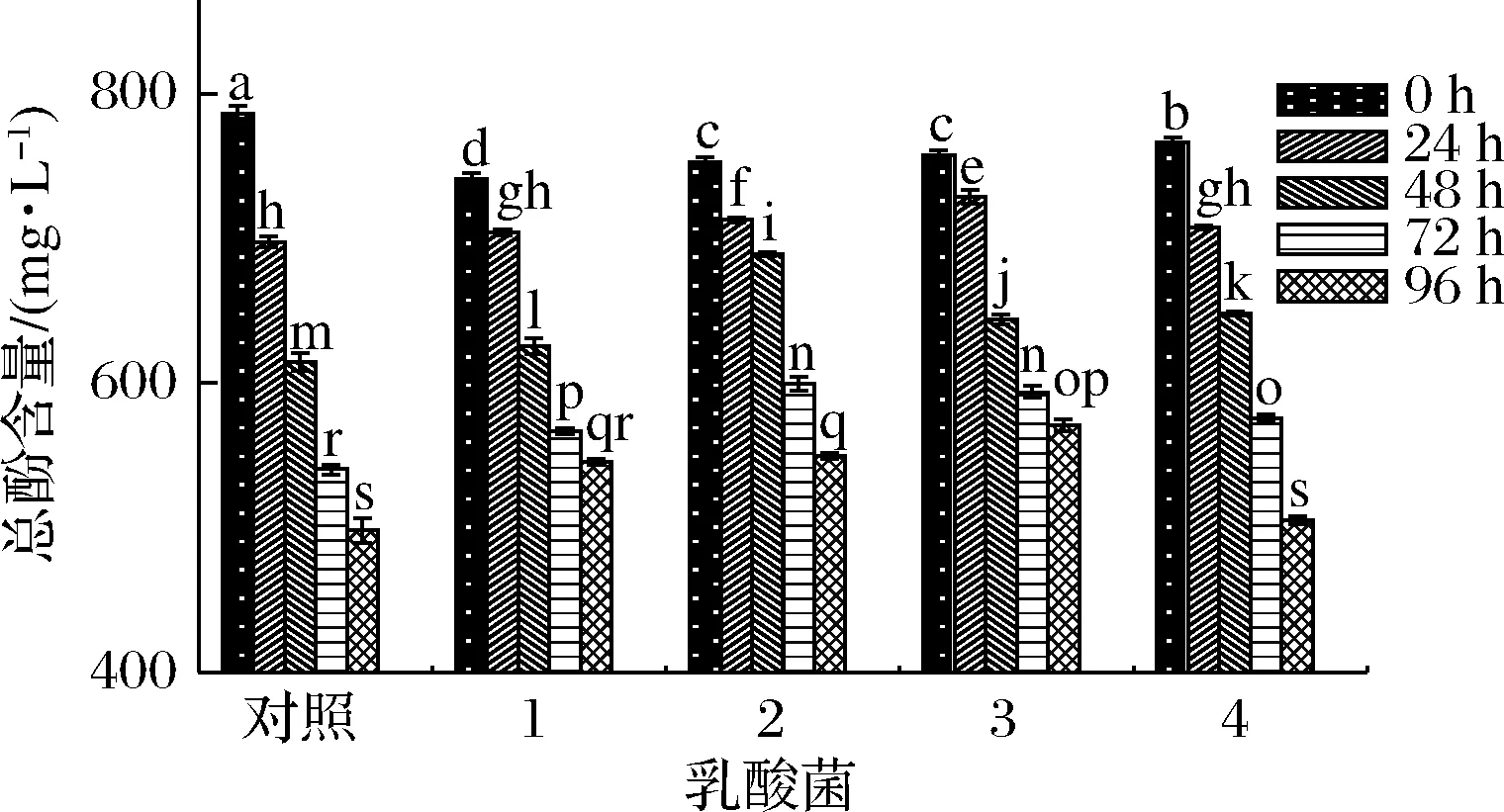
1-保加利亚乳杆菌;2-嗜热链球菌;3-植物乳杆菌;4-瑞士乳杆菌
瑞士乳杆菌发酵组与对照组在前24 h内总酚含量下降趋势近似且最快;嗜热链球菌发酵组在48 h总酚含量最高(688.95 mg/L),保加利亚乳杆菌和植物乳杆菌发酵组在48 h时总酚含量均低于嗜热链球菌发酵组,可能因为低pH值环境,产生代谢应激作用,代谢一些酚类物质增强菌种的耐酸性[25]。
在发酵终点(96 h),保加利乳杆菌、嗜热链球菌、植物乳杆菌的总酚含量均高于对照组与有明显滞后期的瑞士乳杆菌发酵组,说明乳酸菌在生长过程中一定程度减缓了总酚含量的下降,因为随着乳酸菌的发酵,低pH值的环境可以稳定部分酚类化合物,一些酶的产生可水解植物细胞壁[26],部分酚类物质释放,同时乳酸菌的发酵也会使植物组织中的结合态酚类化合物向游离态酚类化合物和水溶性酚类化合物转换[27],因此,乳酸菌发酵过程中,总酚含量是动态下降过程。图6总酚含量的趋势与发酵苹果[24,28]的趋势一致,但与发酵蓝莓[29]、柑橘[30]、草莓[24]的样品中总酚含量升高的趋势不符,这可能和前处理方式有一定关系,总酚含量升高的报道多为前处理温度较低或者直接打浆发酵不进行灭酶或者灭菌处理,细胞结构没有完全破坏,可溶性的酚类物质溶出不彻底,因此在乳酸菌的减缓总酚含量降低的同时不断溶出,导致总酚含量升高。也有研究指出,发酵过程中果蔬的不同会导致发酵过程中酚类含量的差异[24]。
2.6 不同乳酸菌发酵对西梅浆抗氧化活性的影响
由图7可知,4个发酵组在96 h内DPPH自由基清除能力整体呈下降趋势,在发酵终点(96 h),4个发酵组的DPPH自由基清除能力均高于对照组,其中嗜热链球菌和植物乳杆菌发酵组DPPH自由基清除能力仍处于较高的水平。保加利亚乳杆菌与植物乳杆菌分别在0~24 h和24~48 h内DPPH自由基清除率近似等同,嗜热链球菌和瑞士乳杆菌发酵组分别在72和24 h时DPPH自由基清除率有上升的趋势。

1-保加利亚乳杆菌;2-嗜热链球菌;3-植物乳杆菌;4-瑞士乳杆菌
如图8所示,ABTS阳离子自由基清除率整体趋势与DPPH自由基清除能力近似,整体呈下降趋势,对照组ABTS阳离子自由基清除率下降幅度较DPPH自由基下降幅度更加显著,在24 h内除瑞士乳杆菌发酵组外,ABTS阳离子自由基清除率仅有轻微下降。在发酵终点(96 h),4个发酵组的ABTS阳离子自由基清除率显著高于对照组,其中嗜热链球菌和植物乳杆菌发酵组的ABTS阳离子自由基清除率相对较高(70.0%,72.9%)。
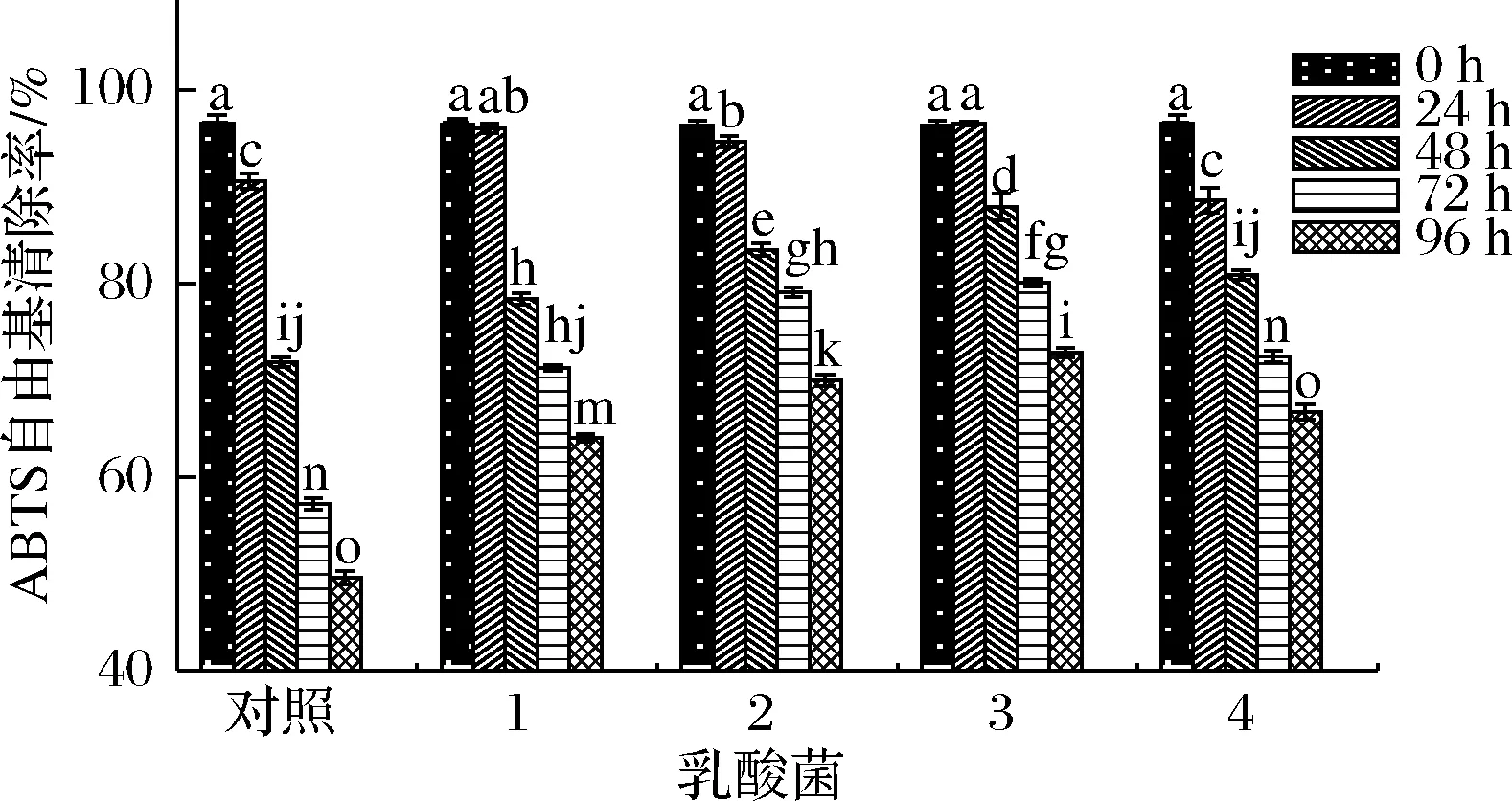
1-保加利亚乳杆菌;2-嗜热链球菌;3-植物乳杆菌;4-瑞士乳杆菌
如图9所示,发酵组与未发酵组的Fe3+还原能力整体上差异不显著(P>0.05),说明西梅浆在发酵过程中对于Fe3+还原能力无显著影响,此结果与钱籽霖[31]的研究结果相似。

1-保加利亚乳杆菌;2-嗜热链球菌;3-植物乳杆菌;4-瑞士乳杆菌
结合图6,总酚含量在96 h内持续下降,说明总酚含量对DPPH自由基清除能力和ABTS阳离子自由基清除能力有一定影响,根据KWAK等[32]的研究,酚类物质的化合物可作为还原剂,是自由基的清除剂和单线态氧的猝灭剂,多酚类物质在乳酸菌发酵的过程中可以提高具有质子供体特性的多酚类化合物的有效性,在以西梅浆为基质的发酵体系中,抗氧化能力与酚类物质的含量呈正相关,但抗氧化能力不完全由酚类物质的含量决定,抗氧化能力可能与乳酸菌生长代谢过程中超氧化物歧化酶、谷胱甘肽酶等抗氧化酶的产出也有一定关系[33]。
2.7 不同乳酸菌发酵西梅浆过程中各指标的相关性分析
利用 SPSS 23.0分别对4个发酵组的部分指标进行相关性分析(表1),可见4个发酵组的DPPH自由基清除率、ABTS阳离子自由基清除率均与总酚含量呈极显著相关(P<0.01),说明总酚含量对抗氧化活性的影响较大。4个发酵组的△a*、总糖、总酚、pH和抗氧化活性均有一定相关性,说明4株乳酸菌发酵时各指标存在较大的相关性及连锁性,其中花色苷有一定清除自由基的作用,初始较高的糖浓度对花色苷有一定的保护作用,因此抗氧化活性的改变可能是酚类物质含量、花色苷的含量及菌种自身产生的抗氧化物质综合作用的结果,pH值的降低和总酸含量的增加使体系环境偏酸,低pH值的环境使花色苷结构改变,△a*增加,体现的颜色偏红。
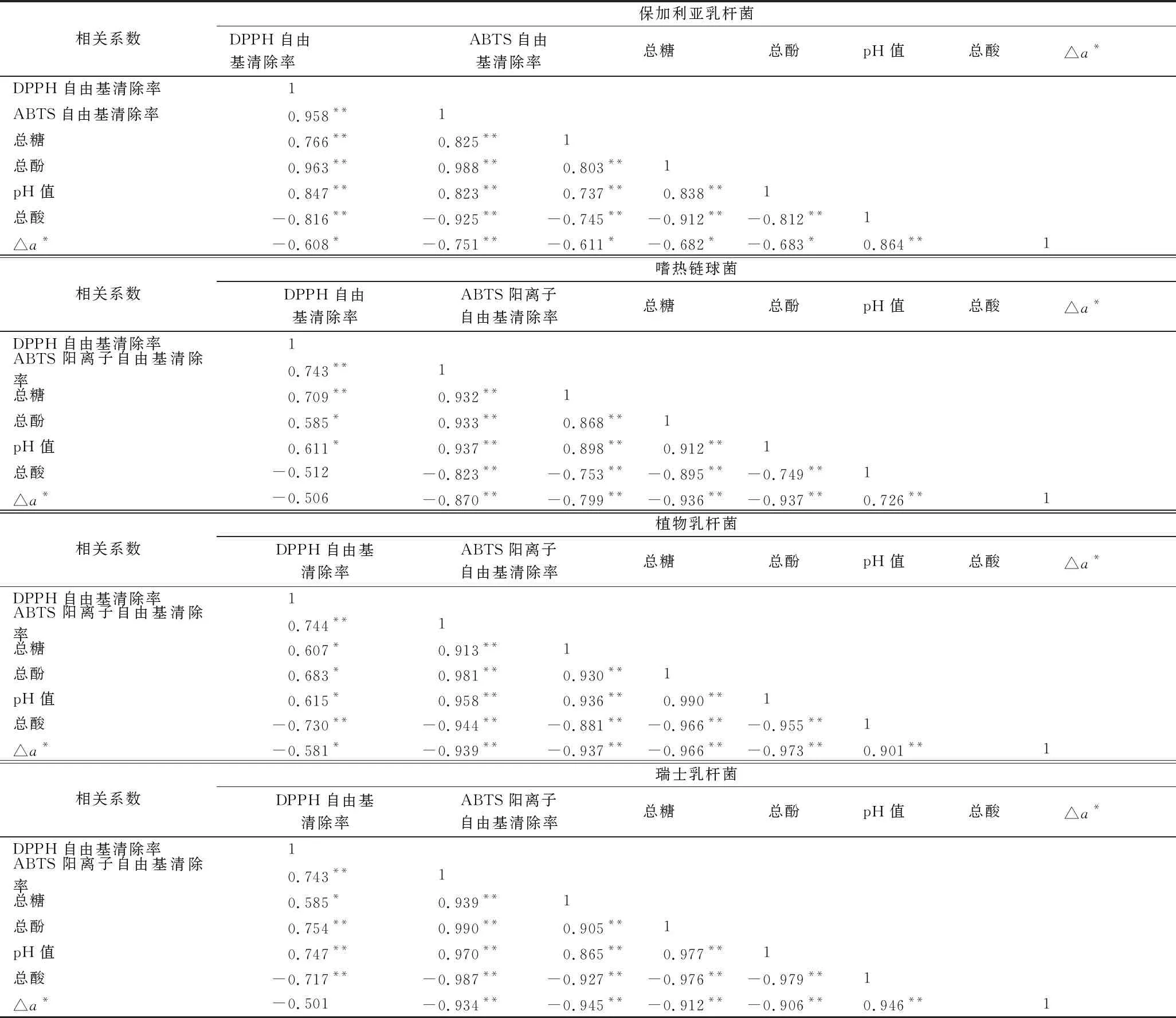
表1 不同乳酸菌在发酵西梅浆过程中各指标与抗氧化活性的相关性分析
综合上述,在西梅浆乳酸菌发酵过程中抗氧化能力由体系的综合环境决定;体系的颜色更多受环境pH值的影响。
3 结论
本研究以“女神”西梅为发酵基质,以保加利亚乳杆菌、嗜热链球菌、植物乳杆菌和瑞士乳杆菌在液体培养基的生长曲线为参考,研究了4种乳酸菌在发酵西梅浆过程中基本品质的变化及抗氧化活性的变化情况。结果显示,4株菌的产酸性能,对碳源的代谢能力与抗氧化能力均有所不同,植物乳杆菌和嗜热链球菌发酵西梅浆过程中有相对较强的抗氧化能力,植物乳杆菌和保加利亚乳杆菌在发酵西梅浆的过程中,产酸能力较强,可使体系pH值降至较低的水平,使体系的颜色偏红。通过发酵,4个发酵组在发酵过程中DPPH自由基清除率和ABTS阳离子自由基清除率呈下降趋势,相比于对照组仍可保持在较高的水平;乳酸菌发酵对Fe3+还原能力影响较小。
综上所述,乳酸菌发酵可降低西梅浆体系的pH值,产出酸性物质,分解利用碳源,提升西梅浆的色泽,辅助减缓活性物质的降低,辅助维持抗氧化活性,该研究结果可为西梅等李属植物的发酵提供依据,以期更好地将发酵技术应用到西梅产业。
