牦牛乳酪蛋白水解制备DPP-IV抑制肽的蛋白酶发掘及其酶解工艺优化
2021-08-09王玲丽刘同杰张兰威公丕民易华西
王玲丽,刘同杰,张兰威,公丕民,易华西
(中国海洋大学 食品科学与工程学院,山东 青岛,266000)
糖尿病为全球流行病[1],胰高血糖素样肽-1(GLP-1)通过竞争性抑制胰高血糖素的释放可起到降低血糖的效果,但二肽基肽酶-IV(dipeptidyl peptidase-IV,DPP-IV,EC3.4.14.5)可快速降解GLP-1,不利于其降血糖[2]。DPP-IV抑制肽可通过竞争性结合DPP-IV抑制其活性[3]。DPP-IV抑制肽通常含有脯氨酸,该结构特点为筛选或合成DPP-IV抑制肽提供了靶点。牦牛乳酪蛋白富含脯氨酸[4],牦牛乳酪蛋白的木瓜蛋白酶水解物DPP-IV抑制率可达53.95%[5]。传统方法对蛋白酶的筛选具有盲目性,借助生物信息学手段有望实现对利用牦牛乳酪蛋白制备DPP-IV抑制肽蛋白酶的快速筛选[6]。此外,酪蛋白的高级结构阻碍了其与酶的结合,不利于肽段释放。超声波频率高、波长短,可一定程度影响酪蛋白结构,使酪蛋白更易与蛋白酶结合,从而提高酶解效果[7]。超声波辅助单酶水解已应用于生物活性肽的制备,但与多酶水解的联合作用尚未见报道[8-9]。
本研究首先利用生物信息学方法对牦牛乳酪蛋白进行模拟酶切,筛选制备DPP-IV抑制肽的蛋白酶,并对单酶和多酶组合水解效果进行研究,确定最佳蛋白酶组合。进一步利用超声波预处理技术对组合酶水解过程进行优化,确定制备DPP-IV抑制肽的最佳工艺。本研究可为利用牦牛乳酪蛋白生产DPP-IV抑制肽,实现我国牦牛乳的高值化利用提供参考。
1 材料与方法
1.1 实验材料
1.1.1 主要实验原料与试剂
牦牛乳酪蛋白,甘肃华羚乳品股份有限公司;蛋白酶,丹麦Novozymes公司。
1.1.2 主要仪器与设备
Alpha1-4真空冷冻干燥机,德国Marin Christ公司;Multiskan FC酶标仪,赛默飞世尔(上海)仪器有限公司;SCIENTZ-IID超声波细胞破碎机,宁波新芝生物科技有限公司。
1.2 实验方法
1.2.1 生物信息学工具筛选蛋白酶
1.2.1.1 牦牛乳酪蛋白序列获取
在UniProt数据库(https://www.uniprot.org/)中选取编号分别为A0A344X7B7(αs1-casein)、A0A344X7B8(αs2-casein)、A0A344X7B9(β-casein)和A0A344X7C0(κ-casein)的牦牛乳酪蛋白主要氨基酸序列进行后续实验。
1.2.1.2 牦牛乳酪蛋白模拟酶切探究DPP-IV抑制肽释放情况
利用BIOPEP工具(http://www.uwm.edu.pl/biochemia/index.php/pl/biopep)对牦牛乳酪蛋白模拟酶切,统计不同酶水解释放的DPP-IV抑制肽数量,并以4条序列的相对含量比αs1-casein∶αs2-casein∶β-casein∶κ-casein=4.3∶1.2∶3.2∶1.3进行加权平均计算后排序[10]。
1.2.2 模拟酶切结果验证及蛋白酶筛选
1.2.2.1 牦牛乳酪蛋白酶解
将牦牛乳酪蛋白用蒸馏水湿润后添加5%(质量分数)Na2CO3,搅拌3 h至完全溶解。蛋白质溶液在不同蛋白酶的最适温度下(表1)预热30 min后开始酶解,反应过程中用1 mol/L HCl溶液或1 mol/L NaOH溶液稳定pH。酶解结束后,酶解液经沸水浴10 min灭酶,冰水浴迅速冷却,8 000 r/min,4 ℃离心15 min后取上清液,调节pH至8.0后冻干,保存于-20 ℃冰箱。
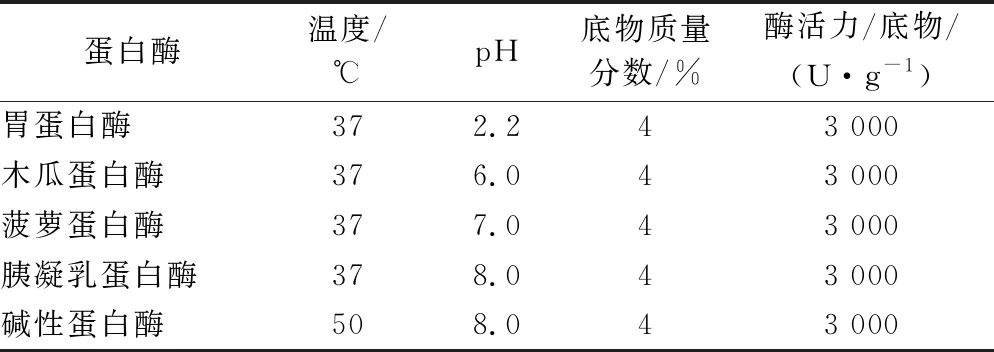
表1 各蛋白酶最适反应条件
1.2.2.2 酶解产物上清液蛋白含量测定
操作步骤按照碧云天公司的BCA蛋白浓度测定试剂盒说明书进行。
1.2.2.3 酶解产物上清液水解度测定
采用茚三酮比色法[11]。按公式(1)计算:
DH/%=
(1)
式中:DH,水解度,%;htot,每克原料蛋白质的肽键量,mmol/g。
1.2.2.4 酶解产物DPP-IV抑制率测定
利用发色底物法测定酶解产物离心上清液冻干粉的DPP-IV抑制率[6]。按公式(2)计算:
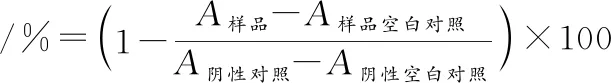
(2)
式中:A样品,样品吸光度;A样品空白对照,以缓冲液代替DPP-IV溶液所测吸光度;A阴性对照,以缓冲液代替样品所测吸光度;A阴性空白对照,以缓冲液代替DPP-IV溶液和样品所测吸光度。
1.2.3 组合酶优化水解工艺
双酶组合:以碱性蛋白酶酶解0.5 h后的样品为底物,调节pH和温度后分别加入胃蛋白酶、木瓜蛋白酶、菠萝蛋白酶和胰凝乳蛋白酶进行水解。
三酶组合:以依次用碱性蛋白酶、木瓜蛋白酶酶解0.5 h后的样品为底物,调节pH和温度后分别加入胃蛋白酶、菠萝蛋白酶和胰凝乳蛋白酶进行水解。
1.2.4 超声波预处理优化水解工艺
对牦牛乳酪蛋白溶液进行超声波预处理:超声波温度64 ℃、超声波功率460 W、超声波时间82 min[12]。
1.2.5 数据处理
使用SPSS 22.0进行单因素ANOVA方差分析,数据结果表示为平均值±标准偏差(SD),以不同字母表示显著性差异(P<0.05)。除模拟酶切外,所有实验均重复3次。
2 结果与分析
2.1 牦牛乳酪蛋白模拟酶切生成DPP-IV抑制肽的研究
检索统计发现,BIOPEP中有28种酶可对牦牛乳酪蛋白产生酶切作用,释放的DPP-IV抑制肽数量统计结果见表2。结合酶获取难易程度和DPP-IV抑制肽数量,选取胃蛋白酶、木瓜蛋白酶、菠萝蛋白酶、胰凝乳蛋白酶和碱性蛋白酶用于水解牦牛乳酪蛋白制备DPP-IV抑制肽。
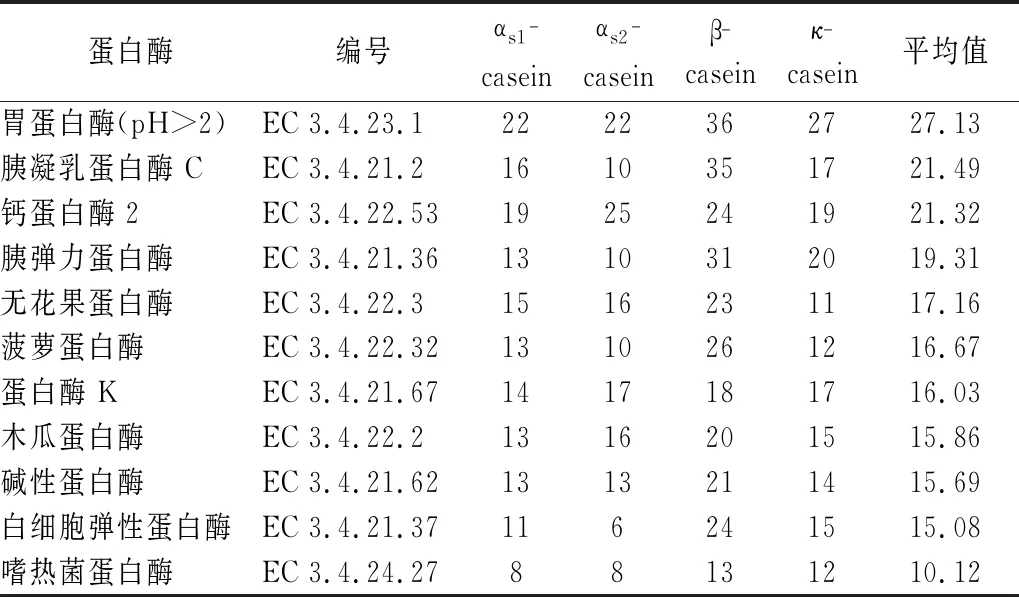
表2 BIOPEP对牦牛乳酪蛋白模拟酶切所产生的DPP-IV抑制肽数量*
2.2 单酶酶解生成DPP-IV抑制肽验证研究
对所筛选的5种蛋白酶酶解牦牛乳酪蛋白生成DPP-IV抑制肽的效果进行了验证,结果发现5种蛋白酶水解产物均具有DPP-IV抑制活性(图1-a)。木瓜蛋白酶产物的DPP-IV抑制率最高,为(20.35±0.47)%,碱性蛋白酶的水解度最高,为(58.20±0.57)%,3 h后各蛋白酶基本完成水解。水解度与产物DPP-IV抑制率之间无明显联系(图1-a和图1-b),水解度达最大值时DPP-IV抑制肽已基本释放完全,这与KARIMI等[13]的研究结果相同。
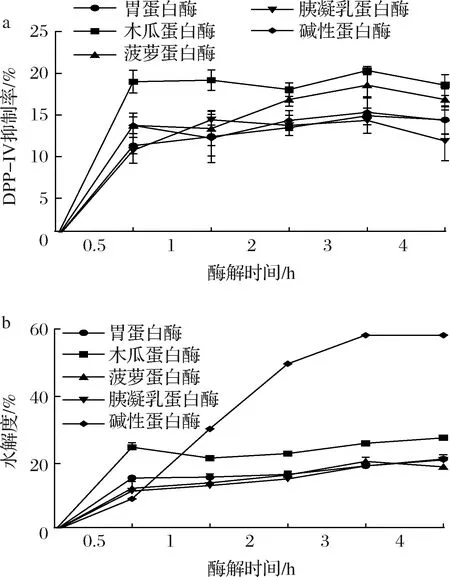
a-DPP-IV抑制率曲线;b-水解度曲线
同时研究发现,实际酶解与模拟酶切结果并不完全一致。这可能是酶解反应条件和底物特性等多种因素的影响,如酪蛋白凝乳不利于蛋白酶发挥作用[14]。此外,目前仅可统计模拟酶切产物的DPP-IV抑制肽数量,数据库中缺少单个肽的活性信息[15]。模拟酶切工具仅基于已报道过的酶解位点和DPP-IV抑制肽数量,而实际酶解过程更为复杂[16]。
2.3 多酶水解生成DPP-IV抑制肽的组合优化
2.3.1 双酶组合优化
对双酶组合水解牦牛乳酪蛋白制备DPP-IV抑制肽进行了研究。结果表明,木瓜蛋白酶与碱性蛋白酶组合的酶解产物DPP-IV抑制率最高(图2-a),为(19.77±2.14)%。双酶组合的水解度较碱性蛋白酶单独酶解时均有显著提高(图2-b)。双酶组合过程中,反应条件的变化和第2种蛋白酶的加入都可能会影响酪蛋白底物的结构,抑制碱性蛋白酶的进一步水解[17]。不同蛋白酶的特异性酶解位点有所差异,第2种蛋白酶会进一步释放碱性蛋白酶产物中的DPP-IV抑制肽[18]。
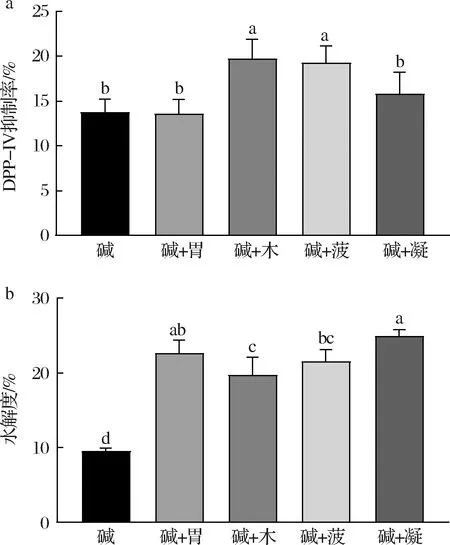
a-双酶产物DPP-IV抑制率;b-双酶产物水解度“碱”表示碱性蛋白酶;“胃”表示胃蛋白酶;“木”表示木瓜蛋白酶;“菠”表示菠萝蛋白酶;“凝”表示胰凝乳蛋白酶(下同)
2.3.2 三酶组合优化
对三酶组合水解牦牛乳酪蛋白制备DPP-IV抑制肽进行了研究。结果显示,“碱+木+菠”组合酶解产物DPP-IV抑制率显著提升,抑制率最高(25.29±3.55)%,但其水解度并未提高。在碱性蛋白酶、木瓜蛋白酶和菠萝蛋白酶组合的过程中,酶解产物的DPP-IV抑制率不断提升,三酶组合>双酶组合>单酶(图2-a和图3-a),但水解度依次为双酶组合>三酶组合>单酶(图2-b和图3-b),表明水解度与产物的DPP-IV抑制活性之间无必然联系。因此,在酶解法制备DPP-IV抑制肽的过程中,水解度仅可作为控制酶解程度的指标[19]。
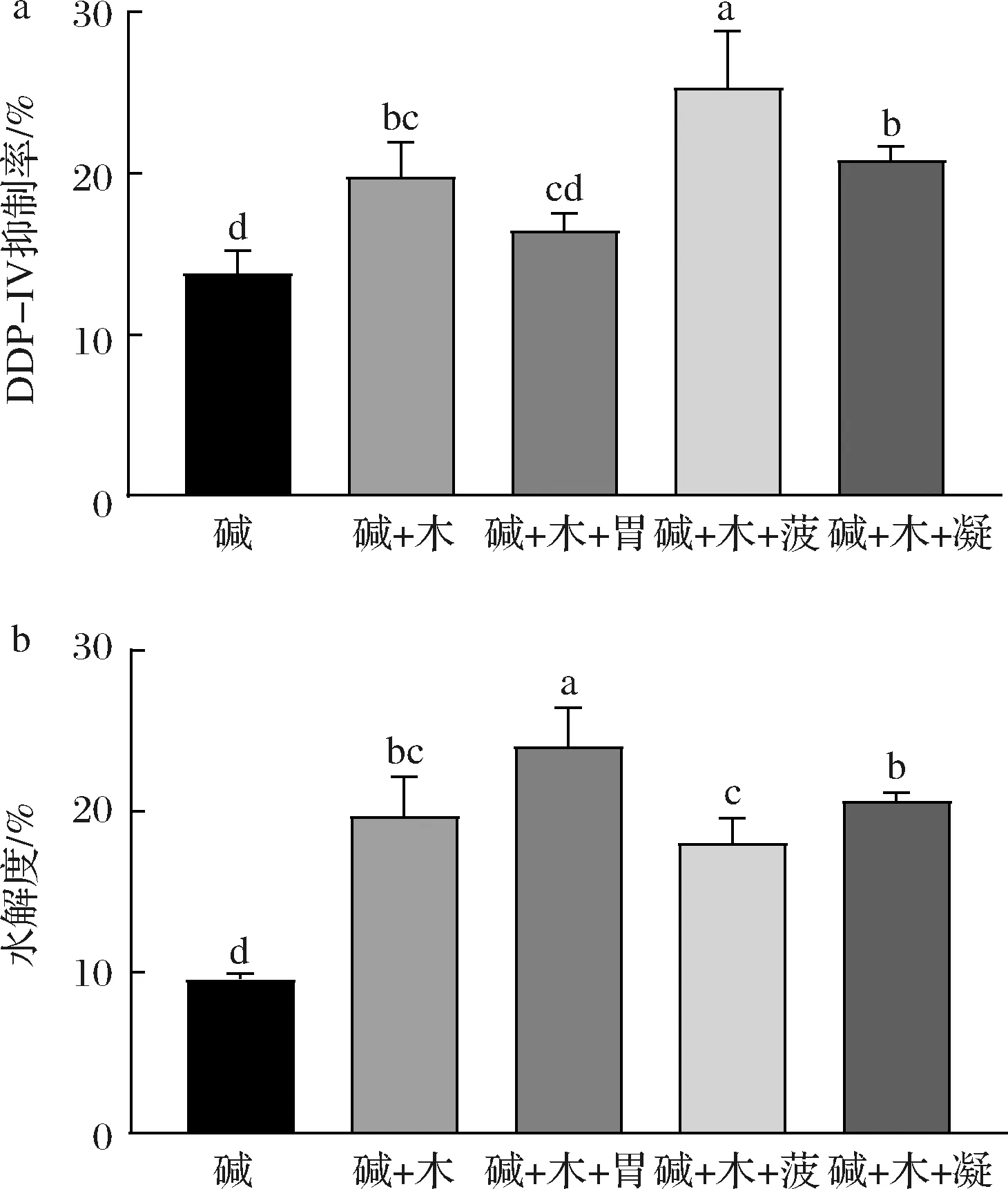
a-三酶产物DPP-IV抑制率;b-三酶产物水解度
2.4 超声波预处理结合三酶组合优化水解
牦牛乳酪蛋白以稳定的胶束状态存在,不利于与蛋白酶的结合[20]。超声波处理可对酪蛋白胶束的结构产生影响,增加酪蛋白溶解度并减小酪蛋白胶束尺寸[21]。预处理结果表明,超声波有助于牦牛乳酪蛋白制备DPP-IV抑制肽。结合超声波预处理牦牛乳酪蛋白,牦牛乳水解产物的DPP-IV抑制率为(67.05±0.79)%,水解度为(30.57±0.72)%,与未经超声波处理相比,抑制效果与水解度均显著提高(图4)。
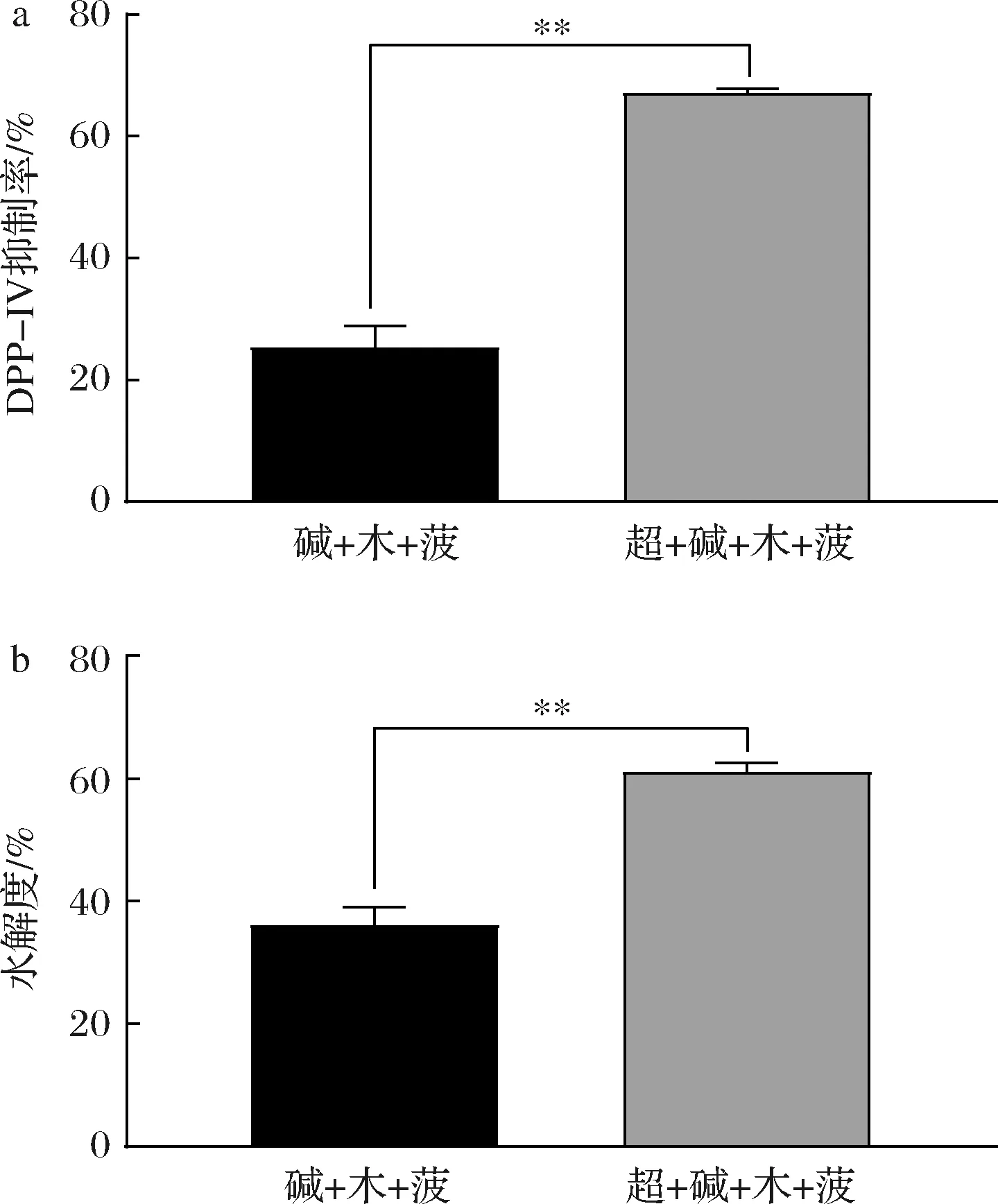
a-超声结合三酶产物DPP-IV抑制率;b-超声结合三酶产物水解度
3 结论
利用生物信息学工具模拟酶切,筛选获得了可用于水解牦牛乳酪蛋白制备DPP-IV抑制肽的胃蛋白酶、木瓜蛋白酶、菠萝蛋白酶、胰凝乳蛋白酶和碱性蛋白酶。多酶水解产物的DPP-IV抑制效果优于单酶水解产物,最佳酶组合为碱性蛋白酶、木瓜蛋白酶和菠萝蛋白酶。确定了组合酶水解牦牛乳酪蛋白制备DPP-IV抑制肽的最佳工艺为超声温度64 ℃、超声功率460 W、超声波时间82 min,碱性蛋白酶、木瓜蛋白酶和菠萝蛋白酶依次酶解0.5 h,加酶量3 000 U/g,酶解产物DPP-IV抑制率为(67.05±0.79)%,水解度为(30.57±0.72)%。本研究将组合酶水解方法应用于酶解牦牛乳酪蛋白制备DPP-IV抑制肽的研究,并利用超声预处理进行了工艺优化,明显提高了酶解效果。
