植物乳杆菌CGMCC8198 β-羟脂酰-ACP脱水酶启动子的克隆及其冷激调节作用分析
2021-08-09周成慧赵阳王德行席茂盛罗学刚
周成慧,赵阳,王德行,席茂盛,罗学刚*
1(天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室,天津,300457)2(天津市微生物代谢与发酵过程控制技术工程中心,天津,300457)
乳酸菌是目前最为公认的一大类益生菌,其食用安全,并可对人体发挥多种健康功能,在食品、医药、畜牧业等领域有着广阔的应用前景[1-2]。温度在乳酸菌的制备、储存、应用中有重要的影响。乳酸菌作为最理想的功能蛋白质多肽类药物的口服投递载体,在对外源基因进行重组表达时,低温诱导往往能有助于降低包涵体形成、减少重组蛋白的降解,提高重组蛋白的生物活性[3-5],且能够降低能耗、减少工业生产成本。
β-羟脂酰-ACP脱水酶(fabz)是Ⅱ型脂肪酸合成途径中的重要酶,它主要负责催化β-羟脂酰-ACP脱水生成反-2-烯酰-ACP,其编码基因是fabZ。如果fabZ被抑制,细菌的生长和繁殖过程中的重要生物合成途径将会受到阻断,细菌无法生长[6]。目前基于fabZ基因的研究大多在于其具体结构与功能[7-9],尚未有文献报道温度与其转录调控间的关系。本研究在分析植物乳杆菌(Lactobacillusplantarum)CGMCC8198在不同温度处理后的转录组测序结果时发现,fabZ基因在温度降低时表达量明显上调。为明确这一低温诱导特性,本研究首先使用生物信息学方法对基因的启动子区域进行了分析预测[10-13],再以绿色荧光蛋白为报告基因构建启动子报告分析质粒,验证了fabZ基因启动子的转录活性及其受温度影响的情况,以期为深入探究乳酸菌冷激应答与fabZ基因功能机理及构建乳酸菌低温诱导表达载体奠定一定的基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株和载体
植物乳杆菌TCCC11824(CGMCC No.8198)、EscherichiacoliDH5α、E.coliBL21(DE3)、质粒pENTR223-CGREF1-EGFP、质粒pET28a+,均为本实验室保存。
1.1.2 主要试剂和仪器
质粒小提试剂盒,北京索莱宝科技有限公司;限制性内切酶,Fermentas公司;T4DNA连接酶,Thermo Scientific公司;PfuDNA聚合酶和dNTPs,北京康为世纪生物科技公司。本实验选用PCR引物以及序列测序均由苏州金唯智生物科技有限公司完成(表1)。5020 Arktik Thermal Cycler,美国Thermo公司;M200PRO 型光栅型多功能酶标仪,瑞士帝肯有限公司;BX53F型正置荧光显微镜,日本OLYMPUS会社。

表1 引物名称与序列
1.2 实验方法
1.2.1 细菌RNA的提取与逆转录
细菌总RNA提取后进行逆转录,逆转录与实时荧光定量PCR体系及条件为:2.5 μg RNA,1 μg随机引物,2 μL 10 mmol/L的dNTPs,6.375 μL DEPC水;70 ℃放置5 min后,迅速冰浴2 min;依次加入5 μL的5×Buffer,5 μL 0.1 mol/L的dNTP,40 U/μL的RNA酶抑制剂0.625 μL,1 μL逆转录酶M-MLV(200 U/μL)混匀,37 ℃反应1 h;70 ℃放置15 min,-20 ℃保存。反应条件:95 ℃,5 min;95 ℃,30 s;退火温度50 ℃,30 s;72 ℃,30 s,30个循环;72 ℃延伸10 min。
1.2.2fabZ基因序列系统进化分析
将fabZ基因在美国国家技术信息中心网站(https://www.ncbi.nlm.nih.gov/)上进行BLAST同源性分析与查找,然后利用MEGA 7.0软件对所有fabZ基因进行分析,并构建系统进化树。
1.2.3 基因序列分析
利用BPROM(http://www.softberry.com/berry.phtml?topic=bprom&group=programs&subgroup=gfindb)和BDGP(https://www.fruitfly.org/seq_tools/promoter.html)数据库进行启动子及转录因子结合位点预测;利用IPSW(https://home.jbnu.ac.kr/NSCL/PseDNC-DL.htm)数据库鉴定启动子真伪及其强度。使用WebLogo 3.0(http://weblogo.threeplusone.com)对预测的启动子序列-10、-35区创建序列徽标图。
1.2.4 载体的构建与鉴定
以质粒pENTR223-CGREF1-EGFP为模板,F-E、F-R为引物,扩增得到基因EGFP,反应条件:95 ℃ 5 min;95 ℃ 45 s;56 ℃ 45 s;72 ℃ 1 min;循环30次,72 ℃ 10 min。将EGFP目的片段插入pET28a载体的EcoRI和NotI酶切位点构建载体pET28a-EGFP。以L.plantarumCGMCC8198的cDNA为模板,F-Z、R-Z为引物扩增fabZ基因的启动子区域,反应条件:95 ℃ 5 min;95 ℃ 45 s;55 ℃ 45 s;72 ℃ 45 s;循环35次,72 ℃,10 min。将启动子区域插入pET28a-EGFP载体的BglII与XbaI酶切位点之间构建载体pET28a-PfabZ-EGFP。
1.2.5 荧光显微镜的检测
提取构建成功的重组表达质粒pET28a-EGFP、pET28a-PfabZ-EGFP分别转化E.coliBL21(DE3)感受态细胞。同时转化空质粒pET28a+作为阴性对照。重组菌株接种于50 mL发酵培养基中,于37 ℃下,培养至OD600约为0.6~0.8时,将摇瓶置于14 ℃诱导培养6 h。离心收集菌体,PBS洗涤重悬,使用正置荧光显微镜检测细胞EGFP荧光表达情况。
1.2.6 酶标仪检测相对荧光强度
将含有重组表达质粒pET28a-EGFP、pET28a-PfabZ-EGFP的菌株接种于50 mL发酵培养基中,分别为T7-14、T7-37、fabZ-14、fabZ-37组。在37 ℃培养至OD600约为0.6~0.8时,将T7-14,fabZ-14组摇瓶放置于14 ℃低温培养20、40和60 min,收集不同时间的菌液。T7-37、fabZ-37组放置于37 ℃,同14 ℃组进行取样。PBS洗涤重悬菌体,使用荧光酶标仪检测EGFP荧光强度(激发波长488 nm,发射波长510 nm)[14],同时测其OD600值,以空质粒pET28a+转化E.coliBL21(DE3)诱导培养作为对照去除背景干扰,相对荧光强度(RFU/OD600)为荧光强度值比对应细胞密度OD600值。
2 结果与分析
2.1 低温刺激后乳酸菌的基因相对表达情况
采用琼脂糖凝胶电泳检测所选择的目的基因fabZ在乳酸菌接受冷刺激不同时间后的转录情况,结果如图1所示。fabZ基因在低温刺激后mRNA相对表达量上调,4 ℃低温刺激20 min时其表达量大约是在37 ℃时的3.7倍;40 min时其差异达到最大为6倍;1 h后4 ℃时的mRNA相对表达量大约是37 ℃时的4倍,表明fabZ基因有低温诱导转录上调的特点。

a-基因表达水平的电泳检测图;b-基因相对表达量
2.2 基于fabZ基因序列构建的分子进化树
使用MEGA 7.0软件,将L.plantarumCGMCC8198的fabZ基因与其他11个不同近缘物种的乳酸菌的fabZ基因进行聚类分析,建立其发育树。结果如图2所示,L.plantarumCGMCC8198fabZ基因与乳杆菌属fabZ基因的亲缘关系最近,同源性最高达到100%;与片球菌属接近,基因同源性为76%;乳酸菌属则聚为另一支为55%。同链球菌属的遗传距离相距较远,是单独的一个分支。而已有文献报道显示Lactococcusgarvieaestrain PAQ102015-99 A7X72的fabZ基因(ID:NZ_LXWL01000001.1)与促进冷加工有关[15],说明该基因可能更早起源于链球菌,且与低温应答有一定关系。

图2 fabZ基因的系统发育树
2.3 生物信息学方法对启动子主要元件的分析
生物信息学结果显示fabZ基因前500 bp区域内存在潜在的启动子。IPSW数据库鉴定fabZ是一个强启动子。其结果(图3-a)显示序列中有明显的-10、-35区域,转录因子结合位点(TFBS)序列显示与rpoD15转录因子的结合有关,WebLogo 3.0保守性鉴定(图3-b)显示-10区、-35区的6个核苷酸序列中的位置分别与经典的-10区(TATAAT)、-35区(TTGACA)相似。

a-fabZ基因启动子序列;b-fabZ基因启动子-10、-35区保守性鉴定
2.4 pET28a-PfabZ-EGFP重组表达载体的构建
图4-a中pET28a-EGFP重组质粒通过EcoRI、NotⅠ双酶切和PCR产物鉴定,pET28a-PfabZ-EGFP质粒通过BglII、XbaⅠ双酶切和PCR产物鉴定(图4-b),分别得到符合预期的目标条带,表明质粒构建成功,再进行测序后,将测序正确的转化子用于下一步试验。
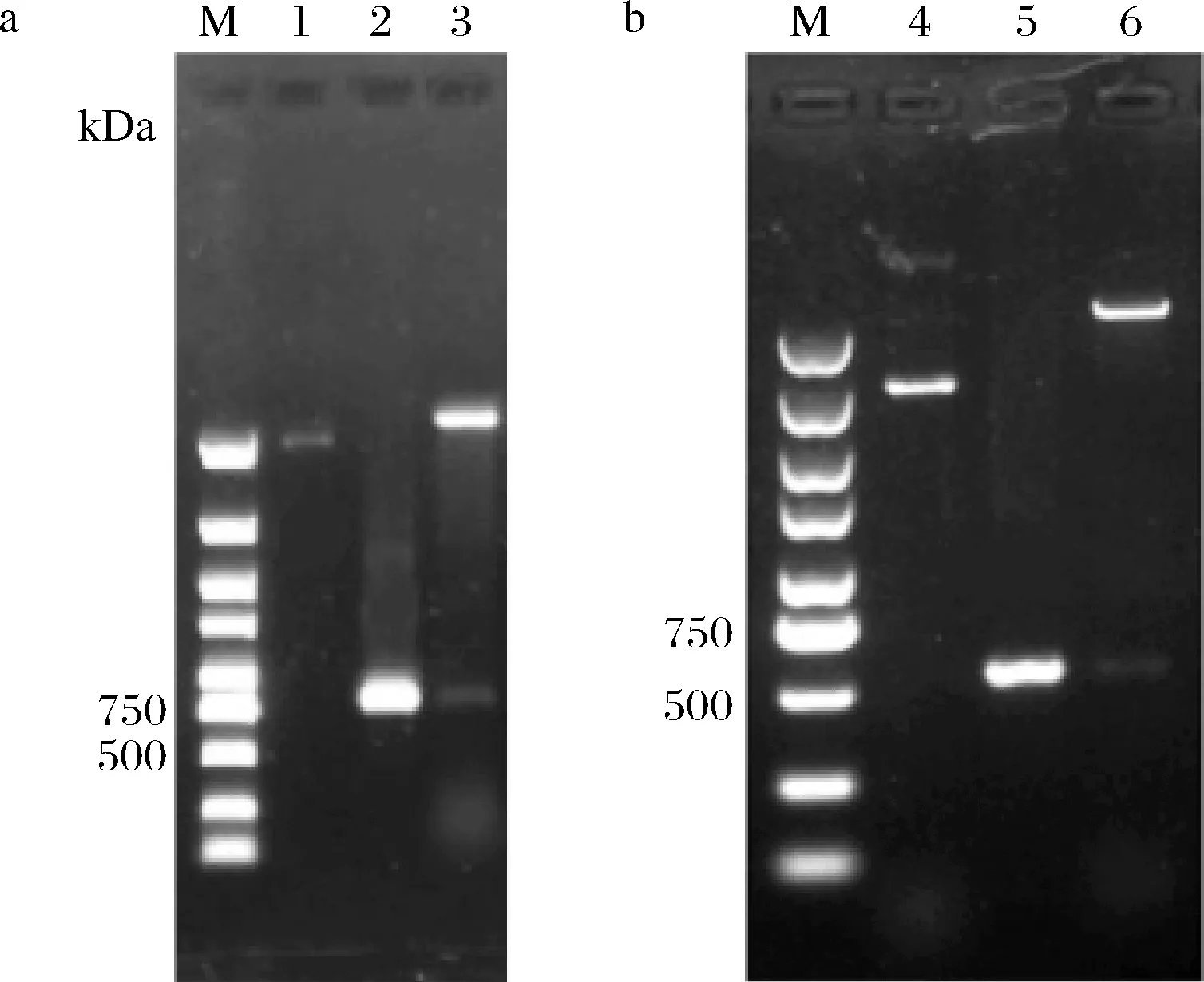
M-marker;1-pET28a+质粒;2-EGFP PCR产物;3-pET28a-EGFP采用EcoRI 和 NotI双酶切;4-pET28a-EGFP质粒;5-PfabZ PCR产物;6-pET28a-PfabZ-EGFP采用BglII 和 XbaI双酶切
2.5 绿色荧光蛋白检测启动子表达情况
使用荧光显微镜检测重组细胞EGFP表达情况,在重组菌细胞内观察到产生的荧光(图5),不含绿色荧光蛋白的载体未出现荧光,结果说明启动子PfabZ可调控绿色荧光蛋白的表达。确定插入的片段具有启动子功能,证明构建所得的启动子探针质粒成功分离并鉴定出fabZ基因的启动子。

图5 绿色荧光蛋白在重组菌株中表达
2.6 EGFP 荧光强度的定量检测
利用多功能酶标仪检测对数期含不同启动子菌株的菌体密度以及EGFP的荧光相对表达强度。菌体生长如图6-a所示,在14与37 ℃,2株菌生长趋势相似,说明启动子的改变未对菌株的生长造成影响。在14 ℃低温环境下,含T7启动子和fabZ启动子的菌株缓慢生长,但含有fabZ启动子的菌株的相对荧光强度却明显增加,说明启动子效应增强。
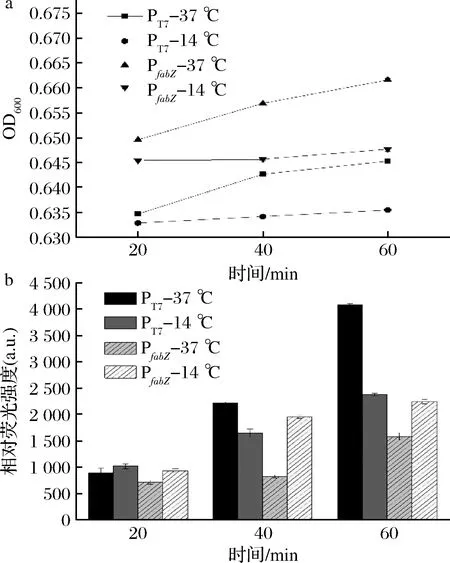
a-低温刺激1 h 重组菌的生长曲线;b-各启动子在不同温度下的相对荧光强度
被PfabZ启动子诱导表达绿色荧光蛋白的大肠杆菌在14 ℃的蛋白表达量明显高于37 ℃时的蛋白表达量,20 min时,是37 ℃的1.30倍;40 min时,差异最大达到2.38倍;1 h后差异变为1.42倍。且在14 ℃时的蛋白表达量与含PT7的重组菌的表达量相当(图6-b)。推测PfabZ启动子中可能含有与低温诱导表达相关的结合位点,在低温刺激后可启动EGFP的表达。而被PT7诱导的大肠杆菌在14 ℃的蛋白表达量与37 ℃时的蛋白表达量由在20 min时的1.13倍的差异变为0.74倍,最后变为0.58倍,推测其在低温下表达受到抑制。这些结果证实fabZ启动子可用于构建低温诱导型重组表达质粒。
3 结果与讨论
低温下诱导表达重组蛋白可以提高易凝集蛋白的可溶性,从而获得活性高的蛋白质或者多肽。一些重要的低温酶及功能性低温蛋白基因在常温下启动子无法正常转录,或者即使被转录表达,也可能因为低温蛋白的热稳定性差、常温下不正确折叠而失活。因此分离得到能在低温下高效表达的启动子具有重要意义。此前研究分别在低温菌[16]和深海细菌[17]中成功筛到低温启动子,并在大肠杆菌成功表达。本研究从乳酸菌转录组中筛选出了低温强启动子PfabZ,在大肠杆菌体内进行诱导表达,其低温诱导强度与T7启动子相当,可用于构建适于热不稳定蛋白质高效表达的低温外源蛋白质表达系统。同时,本研究构建的启动子报告分析质粒具有检测灵敏度高、结果直观、筛选过程简单、迅速等优点,亦可应用于其调节剂的筛选及转录调控机理研究等工作,为其深入研究打下基础。
乳酸菌低温胁迫应激机制的研究已经取得了一定进展,但仍有许多难点未解决。目前,大部分的研究主要停留在细胞水平,从分子水平上阐述乳酸菌环境胁迫机制的研究还不是很充分。另一方面,随着新一代测序技术的飞速发展,更多的生物基因组序列被逐步确定,但对大量涌现的基因功能的挖掘则远远不够,探究乳酸菌基因组中的功能序列元件为阐明其转录调控分子机制、提升其应用水平具有重要价值[18]。本研究首次发现植物乳杆菌的fabZ是一个低温上调基因,KEGG通路分析表明此基因参与脂肪酸的代谢及合成[19]。许多研究表明在各种不利环境下乳酸菌细胞膜脂肪酸含量与组成都会发生调整,从而使细胞膜能够在较差环境下保持流动性,以提高细胞膜的抗逆性[20]。本研究提示fabZ也可能通过影响细胞脂肪酸代谢,在乳酸菌抵御低温胁迫过程中发挥着重要作用,这些发现将为揭示乳酸菌在生产、储存等过程中受到温度影响下的应答机制及提升生产工艺,提供一些新的思路。
