白令海东陆架区生源硫化合物的时空特征变化
2021-08-09刘绚丽厉丞烜王保栋
刘绚丽,翟 星,孙 霞,陈 衎,厉丞烜,3*,王保栋,3
(1.自然资源部 第一海洋研究所海洋生态研究中心,山东 青岛266061;2.自然资源部 海洋生态环境科学与技术重点实验室,山东 青岛266061;3.青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛266237)
作为从海洋向大气排放的最主要的生源性硫化物,二甲基硫(Dimethylsulfide,DMS)在全球硫循环中占据重要地位。Land等[1]估算全球DMS的海-气净通量为19.6 Tg(S)·a-1,约占大气中由非人为因素排放的硫含量的30%[2]。更重要的是,DMS释放带来的负温室效应对全球气候和环境会产生重要影响。进入大气中的DMS被氧化生成具有吸湿特性的非海盐硫酸盐和气溶胶,它们会增加凝云结核(CNN)的数量或增大原结核颗粒,促进云的形成以提高云层对太阳光的反射,从而减少地球接收的太阳辐射量,在一定程度上能够缓解和抵消温室效应[3];而且DMS也是酸雨的主要贡献者,DMS被氧化后形成的硫氧化物能够影响大气沉降物的p H值,模拟研究发现由DMS转化而来的SO2和SO42-分别占大气中该物质总量的25%和27%[4]。
β-二甲基硫巯基丙酸内盐(Dimethylsulfoniopropionate,DMSP)是DMS的前体物质,海水中以溶解态(DMSPd)和颗粒态(DMSPp)形式存在。海洋中微型、大型藻类以及盐生高等植物都能产生DMSP,但产量具有种间差异性。甲藻纲和金藻纲是产DMSP的优势种,蓝藻纲、绿藻纲和裸藻纲等浮游植物体内DMSP含量较少[5]。植物细胞中的DMSP具有复杂生理作用,如调节渗透压[6]、防御摄食者[7]、防冻[8]、抗氧化[9]以及含硫氨基酸合成的硫源和碳源。海水DMSP消耗主要有2种方式:一种是在DMSP裂解酶的作用下降解为DMS和丙烯酸盐[10-11],DMS作为该过程中的副产物;另一种则是通过去甲基化作用生成甲硫醇,是DMSP降解的主要途径[12]。Kiene和Linn[13]通过35S标记DMSP发现只有2%~21%(平均占比为9%)的DMSP会转化成为DMS释放到水中,大部分会转化为含硫微粒以及溶解态非挥发性降解产物。
海水DMS主要来源有浮游植物细胞释放DMSPd至水体中被分解产生DMS[10-11],浮游植物直接产生DMS释放至水体[14],水体中的DMSO还原生成少量DMS[15]。海水DMS主要通过微生物降解[16]、海-气通量[17]和光化学氧化[18]三种途径进行去除。微生物消耗是海水中DMS消耗的主要途径,例如巴伦支海在浮游植物水华期间水体DMS大部分被微生物消耗[19],温带和亚热带水体中微生物可以消耗海水50%~80%的DMS[20]。
白令海是太平洋和北冰洋水体交换的唯一区域,具有复杂独特的环流结构、生态系统和环境效应。高温、高盐的太平洋与低温、低盐的北冰洋之间存在显著的海水温盐性质差异及水位差,海水等密度面向北冰洋倾斜,高盐、富营养盐的太平洋水自白令海向北通过低温、高营养盐的Anadyr流、白令陆坡流和Alaska沿岸流三支水体经白令海峡流入北冰洋最大边缘海楚科奇海。白令海处于世界大洋3个高生产力海区之一的亚北极海区,是海冰、水团、热量、营养盐等向北冰洋输送的关键环节,这种太平洋向北冰洋过渡水体独特的环流结构和生态特征对白令海DMS和DMSP的收支和迁移转化过程的产生独特影响。白令海是海洋DMS的重要源区[21],目前已有研究仅局限于白令海中心海盆区、陆坡区和北陆架区生源硫化合物浓度的时空变化特征和各种去除途径的重要性[22-24],认为海水变暖会引起浮游生物群落改变进而造成生源硫化合物浓度升高的趋势,DMS微生物消耗要快于光降解和海气释放,但白令海东陆架区水团等海水环境性质的年际变化对生源硫化合物生产和转化的影响仍需具体分析研究。鉴于此,我们根据2012年(第五次)和2014年(第六次)中国北极科学考察的现场调查数据,分析白令海东陆架区生源硫化合物浓度的空间分布和年际变化,探讨表层海水DMS和DMSPd的生物生产和消费速率的时空差异性,阐释生源硫化合物分布、产生和消耗的影响因素,评价DMS海-气通量水平及其变化趋势,对揭示白令海对生源硫化合物分布、来源和周转的区域特殊性及其气候效应具有重要意义。
1 样品采集与方法
1.1 样品采集
在第五次(2012年)、第六次(2014年)北极科学考察中,我们乘中国“雪龙号”极地科学考察船对白令海东部陆架区开展DMS和DMSP现场调查取样和分析测定。2012-09-10—11调查断面为BS断面(167°43′12″~175°31′48″W,60°52′12″~61°41′24″N),2014-07-22—24调查断面为NB断面(167°36′00″~175°31′48″W,60°52′12″~62°36′00″N)。2条采样断面位于同一海域,采样站位见图1。
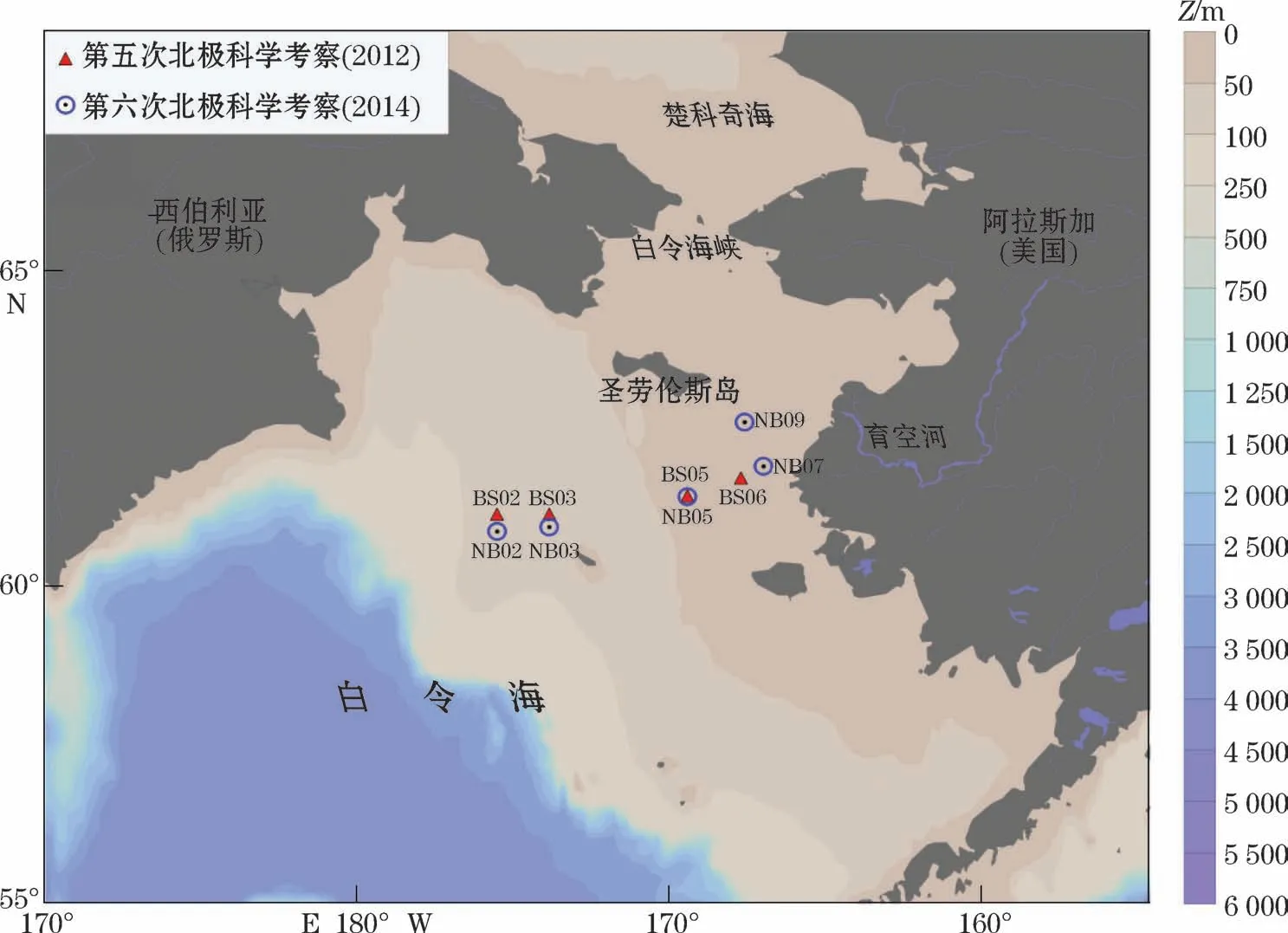
图1 白令海东陆架区调查站位示意图Fig.1 Locations of sampling stations in the eastern shelf of the Bering Sea
用Niskin采水器采集海水样品,通过硅胶管(充满海水且无气泡)转移至润洗2或3次的安瓿瓶中,将硅胶管深入瓶底并让海水迅速注入(无涡流产生),待水溢出瓶口且溢出体积约占瓶子体积的50%后,缓慢抽出硅胶管并立即将瓶盖盖紧,用于二甲基硫化物浓度分析。DMS样品于1~2 h内现场测定。海水水样通过0.45μm醋酸纤维滤膜过滤,滤液置于50 m L离心管,冷冻避光保存,用于营养盐浓度测定。
对于总态DMSP(DMSPt)样品,用移液枪取10 m L海水样品移至已加入1.2×102μL 50%(体积分数)H2SO4的离心管中,缓慢颠倒数次使其混合均匀。采用小体积重力过滤法采集DMSPd样品,取约30 m L海水样品在3 min内通过0.70μm滤膜(英国沃特曼公司生产GF/F型号,Φ=47 mm)进行重力过滤,收集3.5 m L初始滤液至已添加40μL 50%(体积分数)H2SO4的离心管中。过滤中保持过滤压力很小且滤膜润湿,以免浮游植物细胞破裂而造成DMSPd含量偏高[25]。
1.2 样品分析测定
采用气提-冷阱捕集气相色谱法[26]测定海水DMS浓度。经玻璃注射器取2.0 m L水样注入干燥玻璃瓶中,用高纯氮气(体积分数为99.999%)以40 m L·min-1的流速进行吹扫,吹扫出的气体通过Nafion干燥管除湿后经捕集状态下的六通阀富集至浸于液氮中的Teflon捕集管,吹扫2~10 min(视样品浓度而定)后将捕集管置于热水(t>70℃)中加热解析,解析后的DMS样品随载气进入气相色谱仪(日本Shimadzu公司生产的GC-2010 Plus型号)进行测定。进样体积2.0 m L时,检出限为0.50 nmol·L-1,精度低于5%。
对DMSPd和DMSPt样品的测定,酸化后的滤液室温避光保存24 h,保证滤液中DMS被完全酸化氧化移除。随后,向滤液中加入5.0 mol·L-1NaOH溶液3.0×102μL,碱解3~6 h,测定DMS来确定DMSP浓度。DMSPt与DMSPd的差值即等于DMSPp的浓度。
现场海水温度、盐度、深度和叶绿素(Chla)等环境参数由“雪龙号”调查船上的直读式温盐深仪CTD(Seabird 911 plus)同步测定,并在原国家海洋局第一海洋研究所对原始数据进行预处理和校准。5项营养盐(PO3-4、SiO2-3、NO-3、NO-2和NH+4)数据在原国家海洋局第二海洋研究所测定和修正。
1.3 DMS和DMSP生物生产和消费速率的测定
采用抑制剂法[27]测定DMS和DMSP的总生物生产和净生物生产速率,两者之差即为生物消费速率。现场测定DMS生物生产和消费速率时,添加二甲基二硫醚(DMDS)抑制剂,将6个1 L的聚乙烯塑料瓶中装满水样,其中3个瓶中各加入DMDS至浓度为200μmol·L-1[24]作为对照组,未加DMDS试剂的作为空白组。将空白组和对照组均置于黑暗处并在现场海水温度下培养,分别在0、2和4 h后各取2.0 m L培养液测定DMS的含量,分析cDMS与t的关系。空白组得到的斜率为DMS的净生产速率K1对照组的则是总生产速率K2,消费速率K消=K2-K1。DMSP采用甜菜碱(GBT)抑制剂,将水样装满6个2 L的聚乙烯塑料瓶中,其中3个瓶中加入GBT至5.0μmol·L-1作为对照组,采用与DMS同样的方式进行培养,并取样30 m L进行水样中DMSPd浓度的测定,计算生产和消费速率方法同DMS的。
1.4 DMS海-气通量
采用Liss和Slater提出的双层滞膜模型估算DMS海气通量(FDMS),公式[28]如下
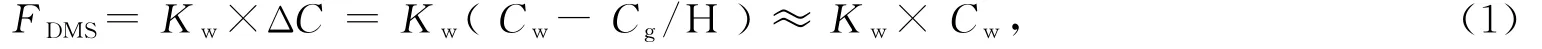
式中Kw是DMS气体的海气传输速率,Cw和Cg是水体和大气中DMS浓度,H是亨利常数。由于水体中DMS浓度高于大气浓度约3个数量级,可以忽略Cg,因此在本次调查中并未对大气中的DMS进行采样和浓度测定。Kw主要有LM86[29]、W92[30]和N2000[31]三种经验表达式来计算。其中LM86计算结果偏低,W92计算结果偏高,N2000所得Kw值处于二者之间,故我们采用的N2000经验式更为客观。
2 结果与讨论
2.1 环境特征
结合白令海陆架区水体结构[32-33],根据t-S点聚图(图2),白令海东陆架区大致包括4个水团:①高温的白令海陆架表层暖水,温度和盐度范围分别为5.0~10.0℃和30.00~33.00;②高温低盐的阿拉斯加沿岸流水,温度和盐度范围分别为0~4.0℃和30.80~31.50;③高盐的白令海陆坡流水,温度和盐度范围分别为-0.3~2.7℃和31.40~32.80;④低温的白令海陆架冷水,温度和盐度范围分别为-1.6~-0.5℃和31.20~32.50。
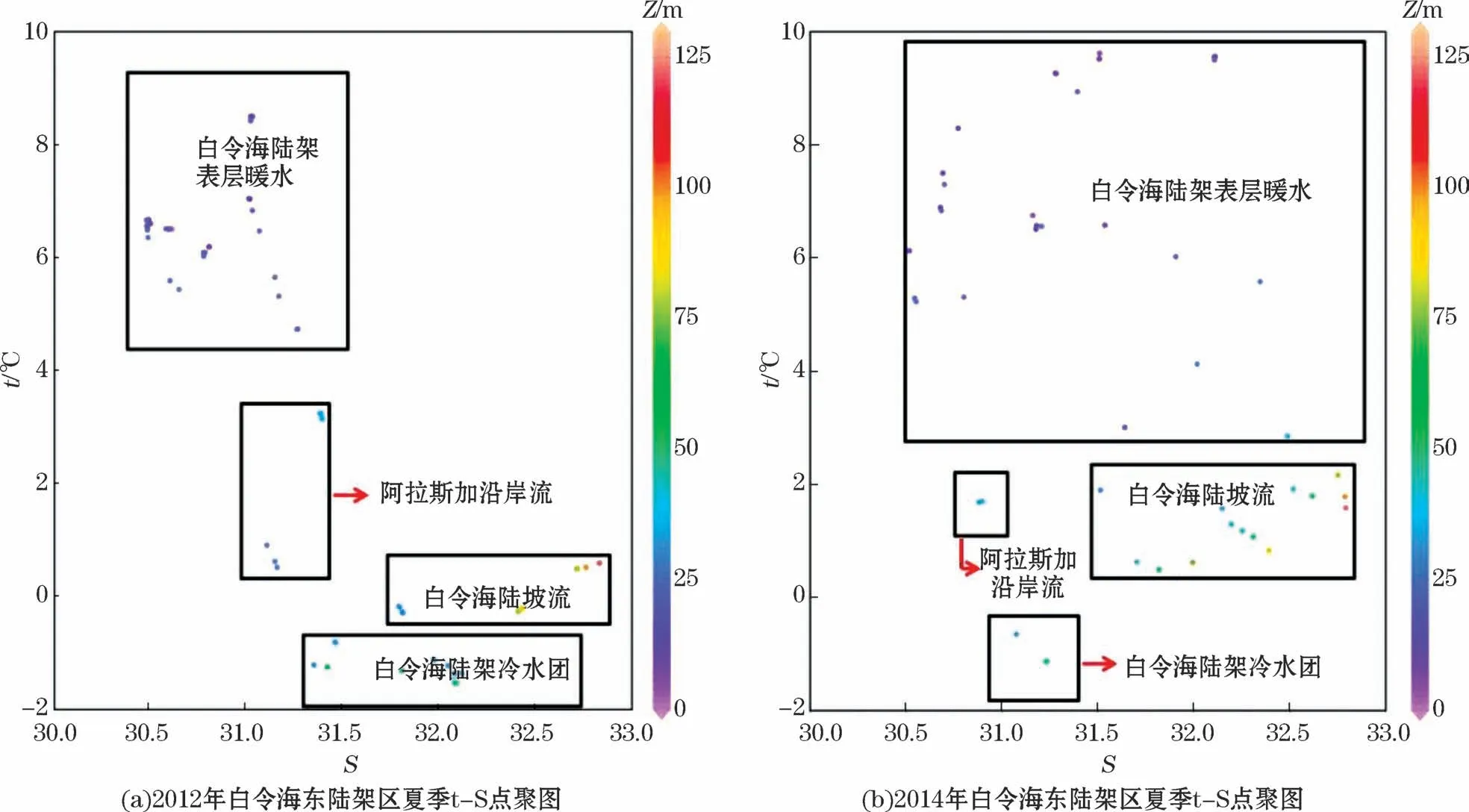
图2 2012年和2014年白令海东陆架区夏季t-S点聚图Fig.2 t-S Diagram in the eastern shelf of the Bering Sea in the summers of 2012 and 2014
垂直分布上白令海东陆架区盐度随水深持续增大而温度却不断降低,水深25 m附近出现明显的温跃层(图3)。2012年170°30′00″~178°00′00″W海域内的白令海陆架冷水团位于水深25~100 m,将阿拉斯加沿岸流和白令海陆坡流分隔开,其最低温度为-1.5℃,盐度范围为31.25~32.43;168°24′00″W以东为温度高值区。2014年白令海陆架冷水团明显缩小,仅位于170°00′00″~174°54′00″W海域内水深25~75 m的水层,最低温度为-1.1℃,盐度为31.00~31.25。2012—2014年冷水团向东明显退缩,高盐的白令海陆坡流由175°00′00″W向东扩展至173°00′00″W、由水深50 m以下水体向上扩展至水深25 m附近的温跃层。
2012年和2014年Chla质量浓度变化范围分别为1.50~13.00μg·L-1和0.09~9.20μg·L-1,平均值分别为3.20μg·L-1和1.40μg·L-1(图3e和图3f)。水平分布上2012年表层Chla呈现东部(166°00′00″~171°00′00″W,ρChla>3.50μg·L-1)高于西部(171°00′00″~178°00′00″W,ρChla<2.50μg·L-1)的分布特征,而2014年表层水中的Chla分布较为均匀(ρChla<1.00μg·L-1)。垂直分布上2012年和2014年高值区位于断面西部(174°00′00″~176°00′00″W)温盐跃层以下(水深30~40 m),该区域浮游植物丰度较高,这与水团的分布密切相关。除该高值区外,Chla垂直变化较均匀且质量浓度较低,2012年和2014年分别低于4.00μg·L-1和1.00μg·L-1。一方面,与上层寡营养盐水体(2012年cDIN<0.02μmol·L-1,cSiO2-3<10.00 μmol·L-1;2014年cDIN<0.20μmol·L-1,cSiO2-3<6.00μmol·L-1)相比,温盐跃层以下的水体中营养盐充足(2012年cDIN>3.00μmol·L-1,cSiO2-3>15.00μmol·L-1;2014年cDIN>7.00μmol·L-1,cSiO2-3>14.00 μmol·L-1),且较低的水温(t<3.0℃)限制了浮游动物对于浮游植物的摄食活动,便于浮游植物的大量增殖。另一方面,白令海东陆架区阿拉斯加沿岸附近存在着大量的冷水种(诺登海链藻、柱状拟脆杆藻和海洋拟脆杆藻)[34-35],温盐跃层下存在的冷水团为其提供了合适的温盐环境,因而冷水团近温盐跃层区域内出现了ρChla高值。2012年ρChla峰值(13.00μg·L-1)位于BS02站位(175°31′48″W,60°52′12″N)水深39 m处,而2014年ρChla峰值(9.20μg·L-1)位于NB02站位(175°31′48″W,60°52′12″N)水深32 m处。2012—2014年ρChla峰值降低,高值区出现上移和东移,这与白令海陆架冷水团向东缩减的趋势相似。
2.2 DMS和DMSP的时空变化
2012年和2014年白令海东陆架区DMS,DMSPd和DMSPp垂直分布如图3所示。为较全面分析断面温盐状态,我们补充图3a和图3c中的BS01和BS04站位以及图3b和图3d中的NB01、NB04和NB06站位的温盐数据。NB09站位因与其它站位不在一个断面上,故未标其温盐数据,只对其生源硫化物数据进行分析。DMS浓度变化范围分别为0.11~2.30 nmol·L-1和0.07~4.50 nmol·L-1,表层平均值分别为1.50 nmol·L-1和2.80 nmol·L-1,与全球表层海水DMS浓度数据库(http:∥saga.pmel.noaa.gov/dms/)中相同研究海域(165°00′00″~175°00′00″W,60°00′00″~63°00′00″N)夏季变化范围(0.50~2.50 nmol·L-1,平均值为1.20 nmol·L-1)相近。纬度相近的大西洋亚北极地区冰岛西南部海域(55°00′00″~62°00′00″N)的cDMS平均为8.60 nmol·L-1[36],北海海域的表层海水cDMS为(4.1±2.2)nmol·L-1[37],与前两者相比白令海东陆架区的DMS浓度处于较低水平。
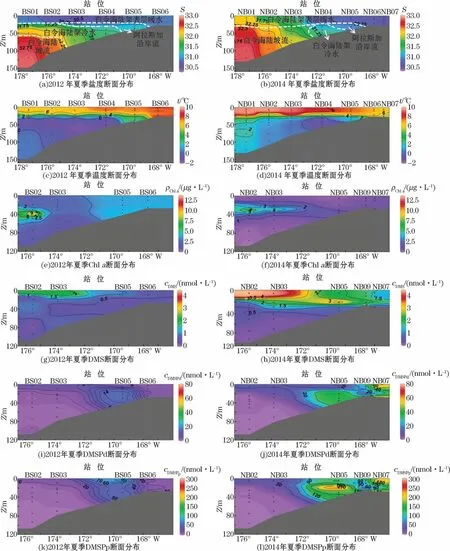
图3 2012年(左)和2014年(右)夏季白令海东陆架区盐度、温度、Chl a、DMS、DMSPd和DMSPp断面分布Fig.3 Profiles of salinity,temperature,Chl a,DMS,DMSPd and DMSPp of the eastern shelf of the Bering Sea in the summers of 2012(left)and 2014(right)
2012年和2014年DMS浓度在水平分布上总体呈现明显的西高东低、表层高底层低的特点,这可能与浮游植物分布有关。白令海东陆架区表层浮游植物优势种同样呈现出西高东低的分布特征[35],其中西式新细齿状藻、柔弱伪菱形藻和丹麦细柱藻在白令海东陆架区西部和东部表层水中的平均丰度分别为2.665×103个·L-1和0.217×103个·L-1、7.865×103个·L-1和0.140×103个·L-1以及33.276×103个·L-1和5.265×103个·L-1。这3种微藻属于硅藻门,虽然硅藻细胞内DMSP含量不高,但是当其在海域内大量存在且为优势藻种时,释放DMSP进而生成DMS的量是相当可观的。相似情况还出现在如硅藻为优势藻的南极罗斯海北部,DMS浓度高值位于浮游植物聚集区[38];孟加拉湾DMS浓度与优势藻种硅藻的丰度密切相关[39]。垂直分布上DMS浓度随水深递减。2012年和2014年DMS浓度高值分别位于BS02和NB02站位表层,主要受白令海陆架表层暖水的影响。DMS和Chla的垂直变化不一致,Chla质量浓度峰值位于次表层,而DMS浓度高值位于表层,这可能是受水温影响。浮游植物细胞内产生和释放到水体中的DMSP主要在DMSP裂解酶的作用下被分解为DMS,而温度是影响DMSP裂解酶活性的重要因素[40]。释放到水体中的DMSP大部分被以细菌为主体的异养微生物作为硫源和碳源分解利用,细菌的丰度和活性会受水温影响[40-42]。2012年与2014年表层平均水温分别为7.2℃和7.8℃,与水深30 m以深水温急剧下降至零度以下的白令海陆架冷水相比,温度较高的表层水更有利于DMSP的降解。尽管下层冷水中出现Chla高值,但低温限制了水体DMSP裂解,不利于DMS释放。
2012年夏季白令海东陆架区DMSPd和DMSPp浓度变化范围分别为1.00~16.71 nmol·L-1和1.51~89.99 nmol·L-1,表层平均值分别为4.38 nmol·L-1和30.22 nmol·L-1。2014年DMSPd和DMSPp浓度变化范围分别为0.15~76.96 nmol·L-1与1.09~214.79 nmol·L-1,表层平均值分别为21.79 nmol·L-1和75.62 nmol·L-1。相较于东海和东黄海等中国近海表层DMSPd(7.00 nmol·L-1)和DMSPp(19.00 nmol·L-1)的平均浓度[43],白令海东陆架区的含量均较高,这可能是由水体中的浮游植物生物量差异所致。2009年夏季东海水体中浮游植物细胞丰度平均值为58.031×103个·L-1[44],2009年和2011年夏季南黄海的分别为15.941×103个·L-1和8.878×103个·L-1[45-46],均小于夏季白令海陆架区的(147.060×103个·L-1[35])。2012年和2014年白令海东陆架区DMSPd和DMSPp浓度分布规律相似。水平分布上以172°00′00″W为界,整体呈现出东高西低的分布特征。垂直方向上断面西部(172°00′00″~176°00′00″W)DMSPd和DMSPp自表层向底层递减,断面东部(166°00′00″~172°00′00″W)大体呈现出随水深先增加后降低的分布特征,高值区位于阿拉斯加附近海域。2012年DMSPd和DMSPp浓度高值范围分别为14.29~16.71 nmol·L-1和52.14~89.99 nmol·L-1,2014年的浓度范围分别为35.02~76.96 nmol·L-1和103.34~214.79 nmol·L-1,然而2012年和2014年DMSP浓度高值区域内Chla的质量浓度仅分别为3.67~3.79 μg·L-1和0.22~1.06μg·L-1,这主要由于藻种的区域差异性。白令海陆架区水体中浮游植物主要以诺登海链藻、叉尖角毛藻、聚生角毛藻、丹麦细柱藻和旋链角毛藻等硅藻门藻种为主[34-35]。其中旋链角毛藻的单细胞DMSPt产量仅1.30×10-4nmol·个-1[47],在硅藻为优势藻种的海域中DMSP会得到大量积累。整个水体DMSPd和DMSPp与DMS的空间变化并不相似,这可能受阿拉斯加近海区域河流输入的有色溶解有机物(CDOM)影响,促进了该区域DMS的光化学去除[48];也可能是由于DMS高值区域出现与该区域水体的DMS生产速率显著高于消费速率有关,致使该区域DMS量呈积累态势(表2)。对于NB02和NB05站位,虽然NB02站位的DMS生产速率与消费速率的差值(3.70 nmol·L-1·d-1)低于NB05站位(5.40 nmol·L-1·d-1),但NB05站位DMS海气通量(11.0μmol·d-1·m-2)却达到NB02站位(5.0μmol·d-1·m-2)的2.2倍,进而可能造成表层DMS在NB02站位(4.49 nmol·L-1)的积累高于NB05站位(2.11 nmol·L-1)。
2012年和2014年白令海东陆架区的DMS和DMSP浓度具有明显的年际差异。对比温跃层上层水体,2012年和2014年DMS浓度范围分别为0.26~2.27 nmol·L-1(平均0.93 nmol·L-1)和0.61~4.49 nmol·L-1(平均2.34 nmol·L-1),2014年DMS平均浓度比2012年的高1.5倍。2012年和2014年DMSPd和DMSPp在温盐跃层上层水体中的平均浓度分别为6.08 nmol·L-1和26.14 nmol·L-1、25.12 nmol·L-1和84.93 nmol·L-1。2014年DMSPd和DMSPp浓度分别是2012年的4.1和3.2倍。而Chla质量浓度年际变化相反,2012年Chla平均质量浓度为3.21μg·L-1,是2014年(1.39μg·L-1)的2.3倍。这种DMS和DMSP同Chla年际变化不同步现象可能是由于浮游植物群落结构的变化导致的,特别是浮游植物中DMSP优势藻种的变化。cDMS/ρChla和cDMSPp/ρChla比值能够在一定程度上反映DMS和DMSP生产者占浮游植物生物量的比重。以同一经纬度(169°25′48″W,61°24′36″N)上2012年BS05站位和2014年NB05站位为例,BS05站位温盐跃层以上水体Chla质量浓度(3.66μg·L-1)是NB05站位(0.26μg·L-1)的14.1倍,而cDMS/ρChla和cDMSPp/ρChla比值平均值(0.29 mmol·g-1和17.30 mmol·g-1)分别仅为NB05站位(10.37 mmol·g-1和617.83 mmol·g-1)的0.03倍。虽然NB05站位温盐跃层上层水体Chla质量浓度低于BS05站位,但DMS和DMSP生产者的比重远远高于BS05站,进而造成2014年NB05站位温盐跃层上层水体中DMS和DMSPd浓度比2012年的分别升高了163%和167%。
2.3 DMS和DMSP与环境因子的相关分析
浮游植物种类和丰度对海水DMS和DMSP生产具有重要影响,但本次调查中未发现Chla质量浓度与海水DMS以及DMSP浓度的相关关系(表1),这也与先前的一些研究结果[49-50]一致,说明浮游植物群落结构可能是重要的影响因素。Ditullio和Smith研究[38]表明cDMS/ρChla比值范围为58~78 mmol·g-1时,水体中生产DMS的藻种以棕囊藻(甲藻门)为主;而其比值范围为2~12 mmol·g-1时,则以硅藻为主。根据cDMS/ρChla和cDMSPp/ρChla比值垂直变化(图4),2012年cDMS/ρChla比值范围是0.06~0.99 mmol·g-1(平均值0.31 mmol·g-1),cDMSPp/ρChla比值范围为0.25 mmol·g-1~24.65 mmol·g-1(平均值5.12 mmol·g-1);2014年其比值分别为0.02~13.27 mmol·g-1(平均值为2.74 mmol·g-1),0.14~701.95 mmol·g-1(平均值为94.09 mmol·g-1)。显然,2014年DMS和DMSP生产者在浮游植物中所占比重远高于2012年的,且水体中浮游植物的优势藻类以硅藻为主。2010年夏季白令海小型浮游植物的研究[34-35]表明,白令海陆架区的浮游植物主要是近岸冷水种诺登海链藻(硅藻门)和叉尖角毛藻(硅藻门)、广温广盐种丹麦细柱藻(硅藻门)和旋链角毛藻(硅藻门),与2014年水体硅藻为优势藻种这一情况相吻合。虽然硅藻并非DMS高产藻种,但当硅藻成为该海域的优势藻种并大量存在时,产生的生源硫的量也是相当可观的。
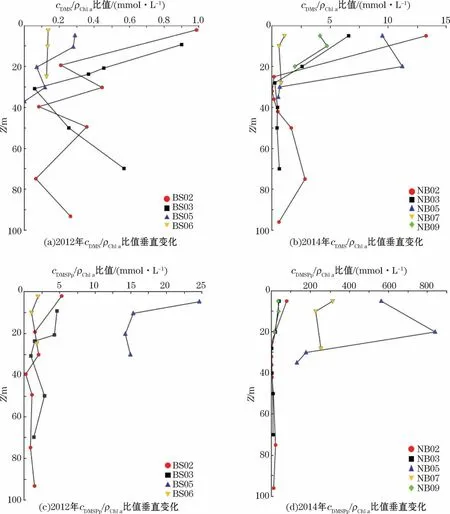
图4 2012年和2014年夏季白令海东陆架区c DMS/ρChl a和c DMSPp/ρChl a比值垂直变化Fig.4 Vertical profiles of c DMS/ρChl a and c DMSPp/ρChl a in the eastern shelf of the Bering Sea in the summers of 2012 and 2014
温度会通过影响浮游植物的群落结构而间接影响海水DMS和DMSP浓度[38]。白令海东部陆架区DMS和DMSP浓度与水温相关性分析表明,海水DMS浓度与温度呈显著正相关(R=0.71,n=24,P<0.01),而DMSPd与DMSPp均与温度无显著相关性。这可能因为温度会影响生产DMSP的浮游植物的种类、数量及其在海域内的分布。而且被微生物裂解成为DMS的DMSP仅占其总量的极少数,温度作为影响酶活性的关键环境因子会对区域内微生物的代谢活动产生重要影响。另外,本研究中盐度与DMS、DMSPd和DMSPp浓度均存在正相关关系(表1)。这是因为DMSP在浮游植物细胞内有调节渗透压的作用[6],当水体中盐度升高时,藻类细胞会合成DMSP以维持渗透压平衡。
营养盐对浮游植物的生长繁殖有重要影响,浮游植物的响应反映了调查区域DMS和DMSP浓度时空变化。2014年NB05、NB07、NB09站位cNO-3(平均值为0.01 nmol·L-1)和cSiO2-3(平均值为4.90 nmol·L-1)明显低于2012年同为断面东部的BS05与BS06站位(平均浓度分别为0.13 nmol·L-1和6.50 nmol·L-1)。3种生源硫化合物均与DIN含量呈负相关关系(表1)。这是因为当水体中的氮盐浓度有限时,浮游植物细胞会倾向于产生DMSP来控制细胞内半胱氨酸和甲硫氨酸的浓度以减少对氮盐的依赖[51],Andreae等[5]也发现硝酸盐的缺乏有助于合成DMSP。此外,硅元素是硅藻生长所必须的元素,大量存在的硅藻会合成并释放出相应的生源硫,这也是白令海陆架区DMS和DMSP含量2014年较2012年明显升高的原因之一。
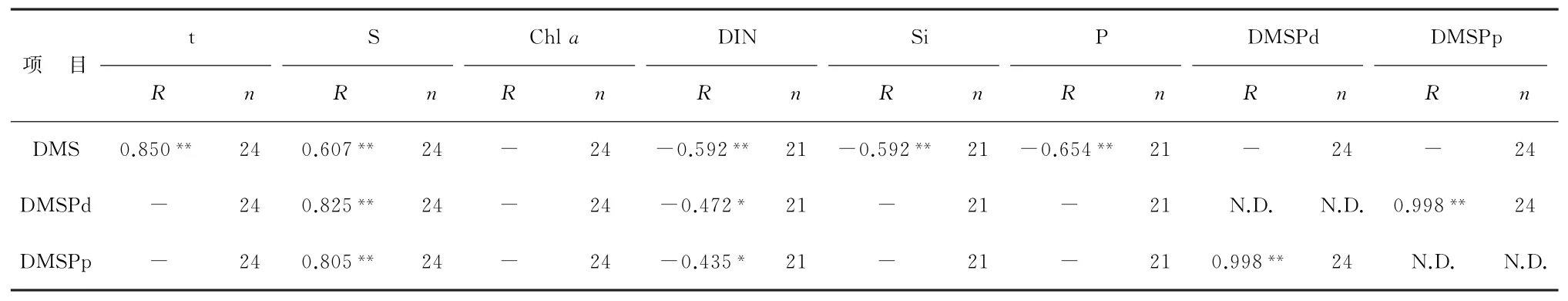
表1 2012年和2014年夏季白令海东陆架区DMS和DMSP与环境因子间的关系Table 1 Relationships between dimethyl sulfur compounds and environmental factors in the eastern shelf of the Bering Sea in the summers of 2012 and 2014
2.4 DMS与DMSPd的生物生产与消费
2012和2014年夏季白令海东陆架区表层海水DMS和DMSPd生物生产和消费速率见表2所示。整体上不同站位DMS和DMSPd生物生产速率均高于其微生物消费速率,消费速率平均约是生产速率的75%,表明生物消费是其周转的主要途径。DMSPd生物消费速率高于相应的DMS生产速率,说明除DMS外DMSPd的降解过程还有其他产物。2012年和2014年研究断面表层海水DMS的平均生物生产和消费速率分别为18.66 nmol·L-1·d-1和13.66 nmol·L-1·d-1,37.80 nmol·L-1·d-1和30.53 nmol·L-1·d-1;DMSPd的生物生产与消费速率分别为40.49 nmol·L-1·d-1和26.24 nmol·L-1·d-1,82.57 nmol·L-1·d-1和70.80 nmol·L-1·d-1。本研究中DMS生物生产与消费速率与研究区域以北的白令海峡处生产速率(28.30 nmol·L-1·d-1)和消费速率(26.20 nmol·L-1·d-1)[52]相当,而显著高于其他陆架海域DMS生物生产和消费速率[53-55]。表明夏季白令海陆架区尽管整体水温较低,但微生物活动较为旺盛。Asher等[55]在南大洋罗斯海也发现了类似现象,海冰融水DMS生物生产和消费速率均很高,部分站位高于1.0×102nmol·L-1·d-1,说明两极海域DMS具有较快的周转与循环过程。对比2 a DMS与DMSPd生物生产与消费速率,2014年4种速率明显高于2012年的。2012—2014年DMS和DMSPd的生物生产速率均升高了100%,这同DMS和DMSPd生产者比重的显著升高密切相关。2014年表层海水cDMS/ρChla和cDMSPp/ρChla比值平均值分别为6.93 mmol·g-1和172.55 mmol·g-1,比2012年(cDMS/ρChla比值为0.58 mmol·g-1,cDMSPp/ρChla比值为9.14 mmol·g-1)提高12和19倍,表明2014年白令海东陆架区生源硫化合物的生产能力高于2012年的。2012—2014年,表层水温平均值从7.2℃升高至为7.8℃,表层DMS和DMSPd浓度平均值分别由1.51 nmol·L-1和4.38 nmol·L-1增长至2.82 nmol·L-1和21.79 nmol·L-1,表层海水变暖增强裂解酶的活性,促使表层海水中高浓度DMS和DMSPd的快速降解,致使DMS和DMSPd的生物消费速率分别升高0.4和1.7倍。
空间变化上2012年DMS和DMSPd生物生产和消费速率的变化趋势相似,高值区位于阿拉斯加近岸BS05和BS06站位,而低值区则在白令海陆架区中部BS02和BS03站位,表现出从近海到远海逐渐降低的趋势。阿拉斯加近岸处表层海水温度较高,但DMS浓度较低,这可能是由于较高的温度为参与DMS周转的微生物的代谢活动提供了良好的条件,促进了DMS的生物消费。2014年DMS和DMSPd生物生产消费速率的空间变化与2012年的大致相似,总体呈现出东高西低的趋势。但值得注意的是,DMS生产速率最低值(20.44 nmol·L-1·d-1)在阿拉斯加沿岸NB09站位,此处温度较高(6.6℃),但DMSPd浓度仅为4.80 nmol·L-1,远低于整个断面表层水体DMSPd的平均浓度(21.79 nmol·L-1),因此该区域对应的DMS浓度和周转速率以及DMSPd消费速率都很低(表2)。NB05站位和NB07站位分别对应着DMS和DMSPd消费速率的最高值,2站位均位于NB断面东侧,受陆架表层暖水影响,温度较高、盐度较低,DMSPd和DMSPp浓度较高,从而具有较高的DMSPd消费速率。总体上DMSPd生物消费速率高于相应的DMS生产速率,说明除DMS外DMSPd的降解过程还有其他产物。
2.5 DMS海-气通量
白令海是DMS高值区,浮游植物产生的大量生源硫排放势必会对该海区乃至全球的气候环境带来深远影响。因此,估算白令海东陆架区DMS海气通量(表2)评价冷水团变化对白令海区DMS释放量的影响具有十分重要的意义。
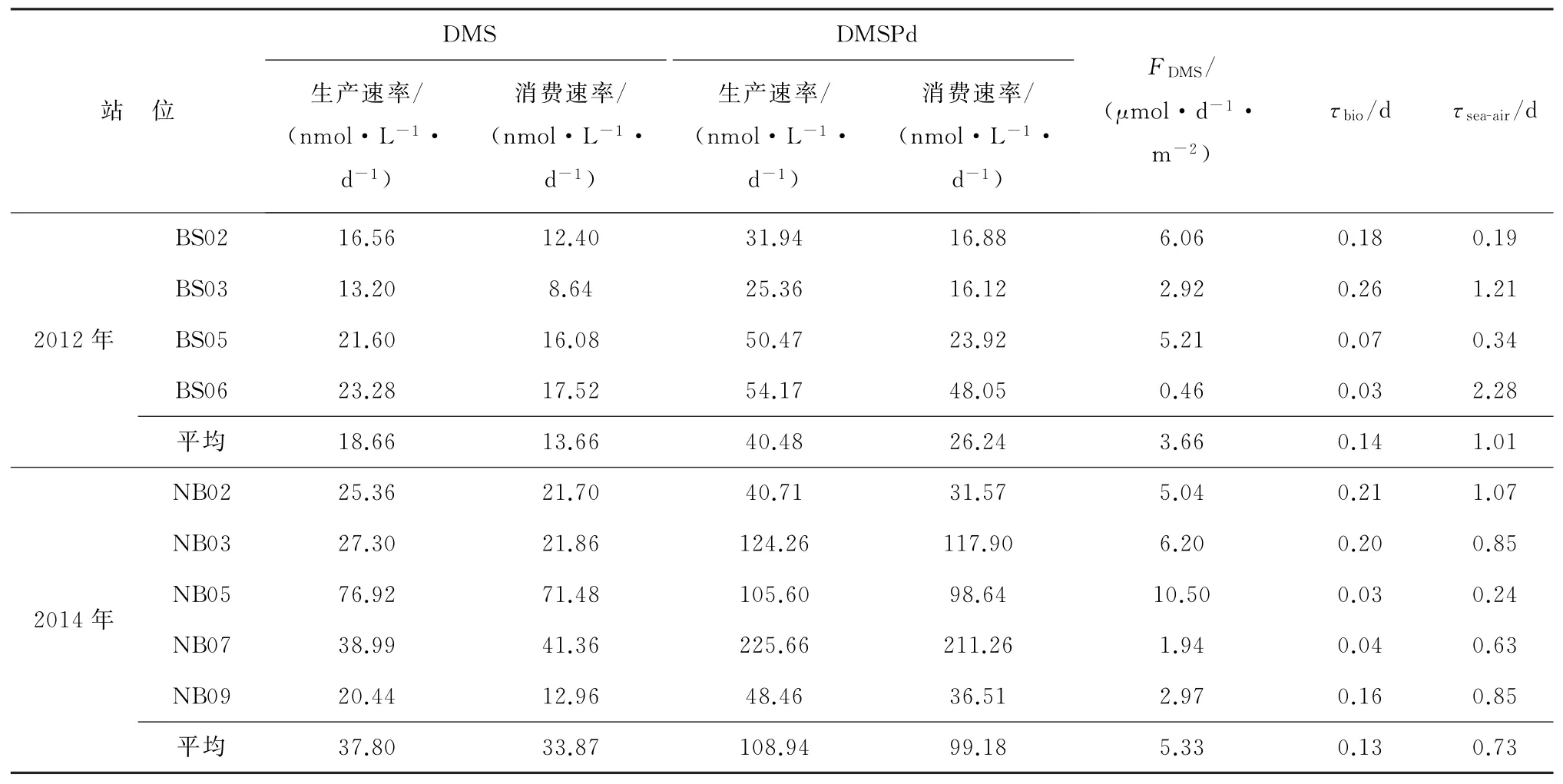
表2 2012年和2014年夏季白令海东陆架区DMS和DMSPd的生产和消费速率、DMS海-气通量及周转时间Table 2 The production rates,consumption rates of DMS and DMSPd,sea-to-air flux and turnover time of DMS in the eastern shelf of the Bering Sea in the summers of 2012 and 2014
2012年和2014年夏季白令海东部陆架区DMS海-气通量范围分别为0.46~6.06μmol·m-2·d-1和1.94~10.50μmol·m-2·d-1,平均值分别为3.66和5.33μmol·m-2·d-1。本研究中DMS海-气通量低于陆架海域的,秋季东海DMS平均通量为12.97μmol·m-2·d-1[56],东海DMS海气通量为13.7μmol·m-2·d-1[57]。DMS海气交换通量是由温度、风速、表层DMS浓度共同确定的(图5)。FDMS同风速存在明显的相关性(R=0.678,n=9,P<0.05),说明风速对DMS海气通量影响显著。风速峰值(12 m·s-1)出现在经纬度相同的BS05和NB05站位。风速相同的情况下,2012年BS05站位海气通量仅为2014年NB06站位的50%,表层水温相差仅0.44℃,但2014年表层DMS浓度是2012年的2倍,说明表层DMS浓度也是影响其海气通量的关键因素。
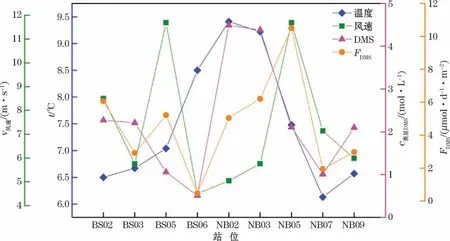
图5 2012年和2014年夏季白令海东陆架区DMS海-气通量、温度、风速、表层DMS浓度Fig.5 Variations of the sea-to-air flux of DMS,emperature,wind speed,surface DMS concentration in the eastern shelf of the Bering Sea in the summers of 2012 and 2014
海水DMS最主要的3种去除方式为微生物消费、海-气扩散和光化学氧化。我们针对前2种去除途径的周转时间进行分析。表层水中的DMS通过微生物消费途径去除的周转时间(τbio/d)等于DMS的浓度除以微生物消费速率,通过海气扩散去除的周转时间(τsea-air/d)则等于表层水DMS浓度乘以采样深度、再除以海-气交换通量。2012年白令海东部陆架区表层海水τbio和τsea-air分别为0.14 d和1.01 d,2014年对应的周转时间分别为0.13 d和0.73 d。2012年和2014年表层海水DMS的τsea-air分别是τbio的7.4和5.7倍,表明微生物消费是比海气扩散更重要的表层海水DMS去除途径,这也与先前的研究结果[20]一致。
3 结 论
根据中国北极科学考察航次的现场调查数据,我们分析了2012年和2014年白令海东陆架区夏季生源硫化合物的分布状况及其转化情况。结合水团及浮游植物的分布,探讨了影响生源硫化合物时空特征变化的影响因素,得出了以下3点结论:
①白令海东部陆架区DMS浓度呈自西向东递减的趋势,主要受近岸阿拉斯加沿岸流以及育空河淡水输入的影响。DMSP浓度的空间变化与DMS的不一致,高值区位于白令海东陆架区东部。2012—2014年,DMSPd和DMSPp分别提高了2.6倍和2.0倍,主要受冷水团范围缩减以及浮游植物群落变化影响。温度、盐度和营养盐对DMS和DMSP浓度产生重要影响。
②白令海东陆架区表层海水DMS和DMSPd生物生产速率均高于消费速率,且呈现出东高西低的趋势,主要是因温度调控了DMS和DMSPd的微生物消费过程。年际变化上,2014年的生产和消费速率均高于2012年的,这主要受表层海水水温、表层DMS和DMSPd浓度升高、DMS和DMSPd生产者比重变化的影响。
③2012—2014年,白令海东陆架区平均DMS海-气通量由3.66μmol·m-2·d-1提高至5.33μmol·m-2·d-1,增加了47%,风速是主要的影响因素,表层DMS浓度次之。表层海水中微生物消费是比海气扩散更为重要的DMS去除途径。
