儿童眼阵挛-肌阵挛综合征临床特点分析及文献复习
2021-08-09朱海霞陈文雄吴汶霖侯池田杨彭炳蔚李小晶
朱海霞 陈文雄 吴汶霖 侯池 田杨 彭炳蔚 李小晶
眼阵挛-肌阵挛综合征(opsoclonus-myoclonus syndrome,OMS)是一种罕见的神经系统疾病,儿童OMS的发病率为0.18/100万[1],儿童发病年龄中位数为18个月。该病典型临床特点是急性或亚急性发作的共济失调、眼阵挛、肌阵挛、激惹、睡眠障碍和其他行为改变。由于这些经典特征表现可能在疾病初期并未全部存在,因此诊断可以被延迟数周或数月。与成人不同,约有一半的OMS儿童合并神经母细胞瘤。OMS作为副肿瘤综合征发生,占所有神经母细胞瘤[2]儿童的2%~3%。其余的病例可能与多种前驱感染后的自身免疫过程有关。OMS易误诊为急性感染后小脑共济失调,但二者治疗及预后差别较大。约70%的OMS患儿存在运动、认知及语言功能障碍等后遗症,因此早期诊断和及时治疗尤为重要。
为提高医务人员对本病的认识和诊疗水平,现将作者单位2017年6月至2020年1月诊断的儿童OMS患者的临床特点,治疗及预后进行总结,现报告如下,期望有助于提高医务人员对本病的认识和诊疗水平。
1 对象和方法
1.1 诊断标准选择作者单位小儿神经内科病房2017年6月至2020年1月收治的OMS患儿6例。OMS患儿诊断符合以下4条中的3条:(1)眼球阵挛;(2)肌阵挛或共济失调;(3)行为改变和(或)睡眠障碍;(4)神经母细胞瘤(其中第1条眼球阵挛为本病必备诊断条件)[3]。
1.2 方法收集6例患儿前驱感染病史、预防接种史、临床表现、实验室资料、治疗反应和预后等资料。OMS症状严重程度评分按Genoa方案执行[3]。
患者神经母细胞瘤采用国际神经母细胞瘤INSS分期标准及美国儿童肿瘤协作组神经母细胞瘤风险分组标准,进行神经母细胞瘤的分期和风险分级。
OMS一线治疗为静脉用人免疫球蛋白(IVIG)联合甲泼尼龙冲击治疗,如合并神经母细胞瘤,则尽早切除肿瘤;二线治疗为利妥昔单抗治疗。
通过小儿神经内科专科门诊复诊及电话随访,获取出院患儿随访资料。从患儿首次病情缓解出院日开始随访,最后1次随访时间为2020年1月。病情反复的患儿,每个月门诊或住院随访1次;病情稳定患儿,每3个月门诊随访1次,评估及记录患儿的临床表现,完善OMS症状严重程度评分。
1.3 统计学处理使用SPSS19.0统计学软件建立数据库并进行统计学描述。计数资料以例数(%)表示,计量资料以中位数(范围)表示。
2 结果
2.1 临床资料本研究6例OMS患儿,其中男2例,女4例。发病年龄11~20个月,中位数16个月,发病均在2岁前(100%)。诊断年龄13~35个月,中位数19个月。发病至诊断的时间为4~70周,中位数14周。除患儿6,其余5例患儿均有前驱感染病史,其中患儿2为胃肠炎,余4例为呼吸道感染。1例(患儿2)起病前有乙型脑炎疫苗接种史。临床表现:6例(100%)患儿均存在共济失调、眼球阵挛、肌阵挛、运动障碍及睡眠障碍,激惹5例(83.3%),语言障碍3例(50%)。具体见表1。
2.2 实验室检查,头颅影像学及脑电图6例患儿血常规、生化及遗传代谢病相关检查(血乳酸/丙酮酸、血氨、尿有机酸、血氨基酸、血酰基肉碱),脑脊液常规、生化、病原学、脑电图检查均未见异常,脑脊液自身免疫性脑炎抗体检测阴性。除患儿1头颅MRI提示侧脑室稍丰满外,余5例患儿头颅MRI均未见异常。6例患儿均行胸腹部CT检查,4例患儿胸腹CT异常,其中3例OMS患儿(患儿1、4、6)胸腹CT发现纵隔占位,遂行骨髓穿刺、24 h尿香草扁桃酸、血清神经元烯醇化酶、甲胎蛋白等检查,其中血清神经元烯醇化酶轻度增高(分别为28.35、22.66、27.22 ng/mL,正常参考值0~16.3 ng/mL),其他结果均未见异常,MYCN基因无扩增;患儿5发现右侧肾上腺区肿物(神经源性肿瘤待排),其家人未同意进一步肿瘤相关检查。
2.3 治疗本组患者中,3例胸腹CT发现纵隔占位的OMS患儿(患儿1、4、6),在作者医院外科行手术治疗,结合病理诊断为神经母细胞瘤(表1),参照国际神经母细胞瘤临床分期标准INSS及美国儿童肿瘤协作组神经母细胞瘤风险分组,均为低危组。其中2例患儿(1、6)术前予IVIG联合甲泼尼龙冲击治疗1个疗程〔1个疗程为IVIG 1 g/(kg·d)×2 d联合甲泼尼龙15 mg/(kg·d)×3 d,静脉滴注〕,经手术联合化疗治疗后临床症状减轻,未再接受进一步免疫调节治疗;1例(患儿4)术前予IVIG联合甲泼尼龙冲击治疗1个疗程,手术联合化疗后OMS症状持续存在,病情无改善,予静脉用人免疫球蛋白(IVIG)联合甲泼尼龙冲击治疗1个疗程〔1个疗程为IVIG 1 g/(kg·d)×2 d联合甲泼尼龙15 mg/(kg·d)×3 d〕后,症状明显减轻。患儿5胸腹CT发现右侧肾上腺区肿物,神经源性肿瘤待排,其家人不同意手术治疗,同意IVIG治疗〔共1个疗程,IVIG 1g/(kg·d)×2 d,静脉滴注〕,症状减轻,至末次随访,该患儿无复发。
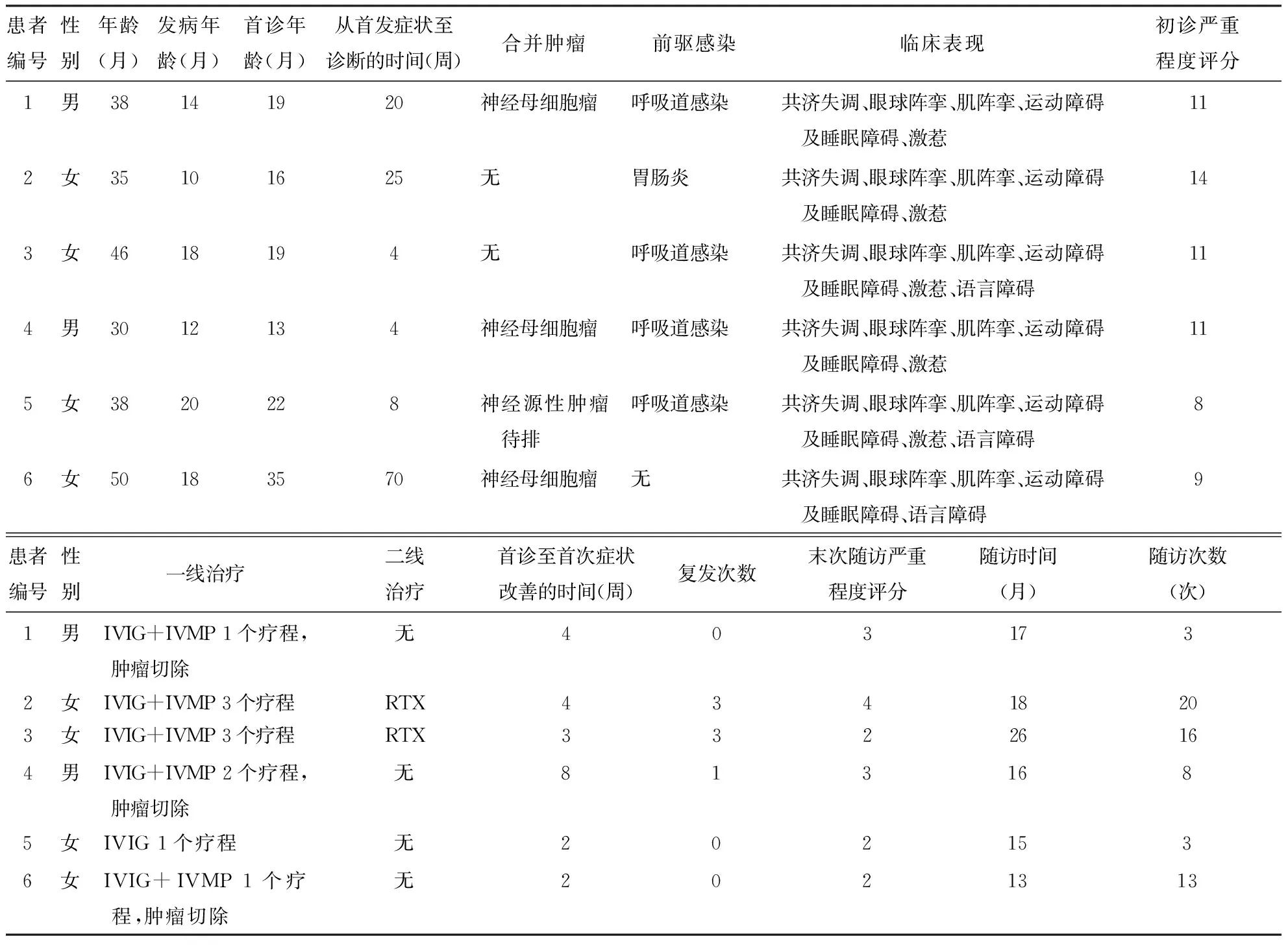
表1 OMS患儿的临床特征、治疗及预后
两例(患儿2、3)未合并神经母细胞瘤患儿确诊后,予IVIG治疗及甲泼尼龙冲击治疗3个疗程,之后改用醋酸泼尼松片口服〔2 mg/(kg·d)〕渐减量(计划糖皮质激素总疗程6个月)。糖皮质激素减量过程中,此两例患儿均每1~3个月复发1次,共复发3次,之后采用利妥昔单抗治疗,具体用法为375 mg/(m2·次)静脉滴注,每周1次,共4次,患儿病情明显改善。其中,患儿2利妥昔单抗治疗后至末次随访,共14个月未见复发;患儿3利妥昔单抗治疗后至末次随访,共19个月无复发(表1)。
2.4 随访至2020年1月,本研究对6例患儿进行了13~26个月的随访,无失访患儿。6例(100%)均有语言发育落后,2例(33.3%)存在有轻微的共济失调,2例(33.3%)存在轻微眼阵挛,3例(50%)存在行为障碍,表现为激惹、易怒、多动、睡眠不安等。所有神经母细胞瘤患儿随访期内均未发现肿瘤复发。
3 讨论
1962年,Kinsbourne首次描述了OMS。常见感染可引发OMS,少数神经母细胞瘤患儿可出现OMS。然而,OMS的发病机制至今仍不十分清楚。大量证据显示该病由自身免疫过程引起。研究发现OMS患者体内可检出抗神经元和树突表面抗原的自身抗体,包括抗N-甲基-D-天冬氨酸(NMDA)受体抗体、抗谷氨酸脱羧酶(GAD)抗体、抗hu抗体、抗γ氨基丁酸B型(GABA-B)受体抗体及脑脊液多种细胞因子,如B细胞活化因子(B cell activating factor,BAFF)等的水平升高[4-5]。Krasenbrink等[6]发现15.8% OMS儿童的父母患有自身免疫性疾病,包括自身免疫性甲状腺疾病、类风湿关节炎、系统性红斑狼疮和胰岛素依赖型糖尿病。OMS患者对糖皮质激素、IVIG、利妥昔单抗或其他免疫抑制治疗的较好治疗反应亦支持OMS的发病机制与患者免疫因素相关。
本文回顾性研究6例患儿,发病年龄11~20个月,这与其他报道中所见的趋势相似。OMS的经典临床表现是眼球阵挛(共轭、多向、混乱的眼球运动)、肌阵挛(非癫痫性肢体抽搐)、共济失调、睡眠障碍、认知功能障碍和行为异常等。研究表明至少20%的OMS病例有不典型表现,眼球阵挛可以在起病后1~18个月才出现,因此诊断时间经常被延迟数周或数个月[1]。患儿可被误诊为急性小脑共济失调、吉兰-巴雷综合征和癫痫发作等。在现有条件下,因仍缺乏该病的诊断性生物标志物,因此提高对儿童OMS临床症状的识别尤为重要。
部分OMS与恶性肿瘤相关。成人OMS主要与乳腺癌和肺癌(小细胞癌)相关。而约50%的OMS患儿可合并神经母细胞瘤。也有个案报道,儿童OMS伴发卵巢畸胎瘤或肝母细胞瘤[7-8]。虽然儿童神经母细胞瘤的死亡率高,但与无OMS症状的神经母细胞瘤相比,伴有OMS症状的神经母细胞瘤ISSN临床分期较早(Ⅰ、Ⅱ期)MYCN癌基因无扩增,往往预后较好[9],风险评级多为低危组,其神经母细胞瘤通常新陈代谢不活跃,很难通过神经母细胞瘤的生化肿瘤标记物-尿儿茶酚胺代谢产物尿香草扁桃酸检测来发现肿瘤。约90%神经母细胞瘤患儿的尿香草扁桃酸升高,而仅约24%患神经母细胞瘤的OMS患儿,可检出尿香草扁桃酸的增高。本研究3例确诊神经母细胞瘤的OMS患儿,其尿香草扁桃酸均未见增高,且术后肿瘤组织MYCN癌基因均无扩增。这与Brunklaus等[10]报道的结果类似。因此,对于未检出尿香草扁桃酸增高的OMS患儿,不能排除神经母细胞瘤的可能。完善肿瘤相关检查,特别是胸腹CT,对于排查OMS患儿是否合并肿瘤,尤为重要。
治疗方面,OMS可采用IVIG、糖皮质激素、促肾上腺皮质激素等免疫调节剂、手术和/或化疗等治疗方法,其中IVIG和甲泼尼龙冲击治疗是OMS的主要一线治疗方案。免疫调节治疗的最佳组合和持续时间仍然没有定论。由于糖皮质激素的毒副作用及次优的疗效,促使人们探索其他更优化的治疗手段。有研究表明,多模式免疫调节治疗可改善OMS患者的运动和发育预后[11]。迄今为止惟一一项针对儿童神经母细胞瘤相关OMS的随机前瞻性治疗临床试验研究显示,对于儿童神经母细胞瘤相关OMS,在使用风险适应性化疗联合泼尼松治疗基础上添加IVIG,OMS的缓解率高于无IVIG组[12]。此外,利妥昔单抗也越来越受到关注。Wilbur等[13]的研究显示OMS患儿诊断后6个月内接受利妥昔单抗治疗,可以减少糖皮质激素的使用时间(中位数时间减少17个月),缩短IVIG的治疗疗程(中位数疗程减少6个),而不会对OMS结局产生不利影响。另外,虽然血浆置换用于治疗OMS患儿仅见于个案报道,但亦提示其在难治性OMS病例中的疗效[14]。本研究有两例患儿尽管使用IVIG联合甲泼尼龙冲击治疗,仍有多次复发,之后使用利妥昔单抗治疗,症状缓解,至末次随访未出现复发表现。因此早期使用利妥昔单抗的综合免疫调节治疗方案(包括糖皮质激素、IVIG和/或血浆置换及早期联合利妥昔单抗)很可能成为OMS患儿的优化治疗方案,这有待更多的循证医学依据支持。
OMS的远期预后不佳。OMS患儿的复发率约81%,其中多次复发占32%,不良预后的危险因素可能为发病年龄偏小和严重的初始症状[15]。本研究6例患儿,目前3例有复发情况(50%)。至末次随访,罹患神经母细胞瘤或无神经母细胞瘤的OMS患儿的神经系统预后无明显差异。这与现有大多数研究结果一致。但Singhi等[16]报道罹患神经母细胞瘤的OMS患儿神经系统预后更差。这需要更大规模的对照研究及长期随访进一步明确。现有研究显示,超过70%的OMS患者有神经后遗症,尤其是智力障碍和语言发育落后[17]。本研究6例患儿均出现语言发育落后,这迫切需要积极的早期治疗及语言训练。更积极的免疫调节治疗可改善预后[18]。
总之,OMS是一种罕见的神经系统疾病。合并OMS的神经母细胞瘤患儿,其肿瘤预后较好。OMS患儿需要早期诊断、早期治疗,以改善不良神经预后。未来有待多学科的国际合作,以确定OMS免疫调节治疗的最佳方案。
