一株改善木薯酒糟发酵蛋白饲料品质的酵母菌株筛选、鉴定和应用
2021-08-09高素芹王晓伟赵孟孟荆学金荆忠平张明俊赵志强武传菊
高素芹, 王晓伟,2*, 赵孟孟, 荆学金, 荆忠平, 张明俊,2, 赵志强,2, 武传菊
(1.山东益昊生物科技有限公司,山东潍坊262400;2.青岛诺森生物技术有限责任公司,山东青岛266706;3.平度市同和动物卫生与产品质量监督站,山东青岛266706)
当前我国酒精发酵生产主要以玉米、稻谷、小麦等粮食作物为原料,但粮食作物原料价格较高,会造成酒精发酵成本增加,限制酒精发酵行业的发展。而我国南方盛产木薯,其淀粉含量高,且易种植、耐干旱贫瘠,不与粮食作物争耕地,价格相对便宜,因此可作为生产生物酒精的首选原料之一(刘振等,2005)。
酒糟是酒精发酵生产主要的副产物,其含有丰富的粗蛋白质、粗脂肪、粗纤维、矿物质、粗淀粉和维生素等营养物质,生产1 t酒精类产品的同时会产生数吨的酒糟,但酒糟中营养物质未被利用,不仅会造成资源的严重浪费,而且长时间堆积不处理,还会造成环境污染,因此,如何充分利用酒糟的营养价值对提高酿酒工业循环经济效益具有关键性的作用(张银等,2019)。
酒糟传统的处理方式主要是先沉降,然后离心脱水,最后直接用作饲料,而酒糟上清液大多直接排放,但其化学需氧量(COD)很高,会造成环境污染。针对上述问题,本研究旨在降低酒糟上清液的COD含量,并得到单细胞蛋白,提高固体酒糟的蛋白含量,变废为宝,既能减少环境污染,又能缓解蛋白饲料的短缺现状(蔡俊,2001),降低饲料成本,提高饲料营养物质含量。
1 材料与方法
1.1 试验材料 从大曲酒醅等发酵基质中采集样品,置于无菌封口袋中,用于菌种的分离和筛选。
1.2 主要试剂和仪器
1.2.1 主要试剂D-果糖、L-山梨糖、D(+)木糖、纤维二糖、D-半乳糖、D-海藻糖、L-阿拉伯糖、L-鼠李糖、菊糖、D-阿拉伯糖、棉籽糖、葡萄糖、蔗糖,购自上海国药集团化学试剂有限公司;提取酵母菌基因组试剂盒和Taq酶,购自大连宝生物工程有限公司。
1.2.2 试验仪器 电子显微镜(日本NIKON公司)、恒温水浴锅(武汉市琴台医疗器械厂)、恒温培养箱(上海精宏实验设备厂)、超净工作台(上海智成分析仪器制造有限公司)、恒温振荡器(上海智成分析仪器制造有限公司)、全自动灭菌锅(上海博讯有限公司)。
1.3 培养基 酵母膏葡萄糖蛋白胨培养基(GYP培养基):酵母粉5 g,葡萄糖20 g,蛋白胨10 g,琼脂20 g,水1000 mL,酸碱度自然;酒醅汁培养基:酒醅50 g,加入250 mL水,煮沸20 min,纱布过滤,调pH到7.0,定容至250 mL,加5 g琼脂;酒精耐受培养基:蛋白胨10 g,葡萄糖20 g,琼脂20 g,水1000 mL,调pH至7.0,灭菌后冷却至50℃加入10%的乙醇;单糖发酵培养基:将D-果糖、L-山梨糖、D(+)木糖、纤维二糖、D-半乳糖、D-海藻糖、L-阿拉伯糖、L-鼠李糖、菊糖、D-阿拉伯糖、棉籽糖、葡萄糖、蔗糖按2%加入无碳源的基础培养基中;牛肉膏蛋白胨培养基;PDA培养基。
1.4 木薯酒糟的制备
1.4.1 酿酒酵母的活化 取100 mL纯净水,加入250 mL三角瓶中,煮沸后冷却,加入1.6 g酿酒酵母,2.0 g蔗糖,混匀,38℃水浴锅中保温15 min,之后33℃水浴锅中保温2 h。
1.4.2 培养基的制备 称取91.36 g木薯粉放入500 mL三角瓶中,量取208.64 mL水注入,混匀。放入90~95℃水浴锅中保温,加液化酶0.045 mL,作用90 min,然后用稀硫酸调pH至4.0~4.5,放入65℃水浴锅中保温,加液化酶0.09 mL,作用30 min,加(NH4)2SO40.6 g,90℃巴氏消毒20 min。
1.4.3 接种 将活化的酿酒酵母按5%的接种量接入发酵培养基,33℃温箱中培养3 d。
1.4.4 蒸馏酒精 根据处理酒糟上清液的需要,加入100 mL水,在不少于半个小时的时间内蒸出100 mL液体,剩余的固液混合物即木薯酒糟。
1.4.5 离心 将酒糟经过4000 r/min离心,取上清,即酒糟上清液。
1.5 黑曲霉发酵制备
1.5.1 黑曲霉液态发酵 将配制好的PDA液体培养基100 mL加入250 mL三角瓶中,115℃灭菌30 min。冷却后接入已活化的黑曲霉,于32℃,180 r/min培养3 d,4000 r/min离心10 min,得到黑曲霉上清液。
1.5.2 黑曲霉固体发酵 将含水量约60%的麸皮培养基100 g装入250 mL三角瓶中,121℃灭菌30 min,冷却后接入已活化的黑曲霉,于32℃温箱中培养3 d。
1.6 菌株的分离纯化 称取10 g酒醅加入到90 mL无菌水中,分别于牛肉膏培养基,PDA培养基,GYP培养基,酒醅汁培养基,酒精耐受培养基上稀释平板分离。挑取平板上具有典型酵母形态的单菌落进行划线分离纯化,获得的单菌株分别编号保存备用。
1.7 菌株的发酵与筛选
1.7.1 单菌木薯酒糟上清液液体发酵 将分离纯化得到的菌株分别接种到100 mL木薯酒糟上清液中,35℃、180 r/min摇床培养2 d,上清液中补加(NH4)2SO40.2 g,KH2PO40.1 g,CaCl20.2 g,Mg-SO40.05 g,最后取样测菌量、COD值。
1.7.2 复合菌木薯酒糟上清液液体发酵 将筛选到的菌株分别与黑曲霉、10%黑曲霉上清液分成三个组别处理,处理组一:将筛选到的菌株直接接入100 mL木薯酒糟上清液中;处理组二:在100 mL木薯酒糟上清液中先接入10%的黑曲霉上清液,再接入筛选到的菌株;处理组三:将黑曲霉与筛选到的菌株混合后一起接入100 mL木薯酒糟上清液中,在相同条件下,35℃、180 r/min摇床发酵2 d,最后取样测菌量、COD值。
1.7.3 单菌木薯酒糟固体发酵 称取木薯酒糟85 g,糖蜜15 g,尿素2 g,KH2PO40.1 g,MgSO40.1 g,加入60%的水混合均匀,常压蒸煮30 min,冷却后将筛选到的菌株按5%的接种量接入,37℃恒温箱内培养40 h,最后取样测菌量、粗蛋白质、真蛋白含量。
1.7.4 复合菌木薯酒糟固体发酵
1.7.4.1 黑曲霉糖化木薯酒糟 将木薯酒糟100 g加水调至含水量65%,常压蒸煮10 min,降温至65℃,拌入10%黑曲霉发酵料块,55℃恒温培养30 h,取样检测还原糖含量。
1.7.4.2 复合菌木薯酒糟固体发酵 在经过黑曲霉 处 理 后 的 木 薯 酒 糟 中 添 加 (NH4)2SO42 g,KH2PO40.1 g,MgSO40.1 g,尿素1 g,将筛选到的菌株按5%的接种量接入,37℃恒温培养40 h,最后取样测菌量、粗蛋白质含量。
1.8 检测方法 粗蛋白质测定:凯氏定氮法(马丹,2008);真蛋白测定(胡艳丽等,2007);水分测定:恒重法(天津轻工业学院,1980);还原糖测定:斐林试剂法(李正智,1965);活菌菌量的测定:稀释平板计数法(赵斌等,2002);COD的测定:微波消解法(刘华,2009)。
1.9 菌株鉴定
1.9.1 生理生化试验 酵母的糖同化试验按照《酵母菌的特征与鉴定手册》(巴尼特,1991)中生长图谱法鉴定。
1.9.2 18S rRNA序列扩增及分析 提取待测菌株总DNA作为模板,采用通用引物(正向引物NS1:5/-GTAGTCATATGCTTGTCTC-3/;反向引物NS4:5/-CTTCCGTCAATTCCTTTAAG-3/)进 行18S rRNA的PCR扩增,PCR扩增条件为:预变性(94℃1 min)、变性(94℃1 min)、复性(50℃1 min)、延伸(72℃1 min),30个 循 环;最 后 延 长(72℃5 min),保存(4℃)。
由测序公司完成测定18S rRNA全长约1000 bp DNA序列,将所测得的序列提交到GenBank,应用Blast程序与数据库中已有的酵母18S rRNA序列进行相似性比较分析,序列的比较分析及系统发育分析采用MEGA 3.1软件进行。
2 结果与分析
2.1 菌株的分离 采用稀释平板涂布分离法,从酒醅中共分离得4株典型酵母形态的菌株。其中,从酒醅汁培养基中分离出两株菌株,分别编号为JP-1,JP-2,从酒精耐受培养基中分离出两株菌株,分别编号为JJ-1,JJ-2。
2.2 菌株的发酵与筛选
2.2.1 单菌木薯酒糟上清液液体发酵 如表1所示,相同条件下,JJ-2在木薯酒糟发酵上清液发酵后菌量增加了36.5倍,而JJ-1、JP-1和JP-2发酵后菌量分别增加1.25倍、4倍、2.75倍,且JJ-2可将酒糟上清液的COD值降低17.17%,而JJ-1,JP-1,JP-2分别只能将COD值降低7.15%、8.58%、7.71%,说明这四株菌株中,JJ-2在木薯酒糟上清液中生长繁殖最好,降低木薯酒糟上清液的COD值幅度最大,且该菌筛选自酒精耐受培养基,具有酒精耐受性,因此,选取该菌株进行后续试验。
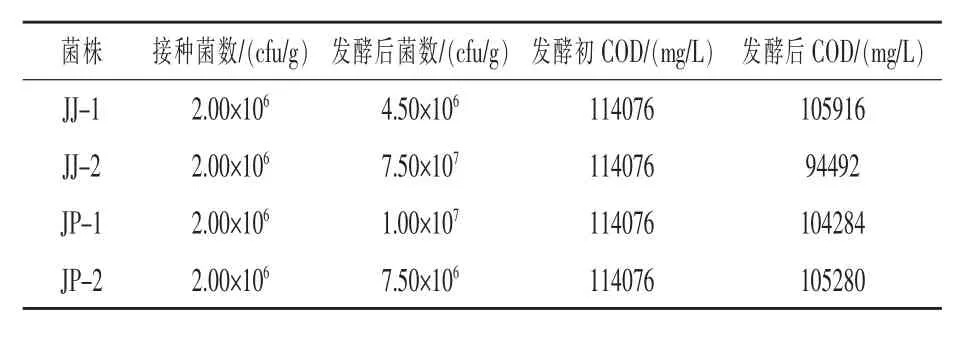
表1 单菌木薯酒糟上清液液体发酵
2.2.2 复合菌木薯酒糟上清液液体发酵 如表2所示,在三组处理中,处理组二发酵后菌量增加121.5倍,木薯酒糟上清液COD值降低33.91%,均优于其他两个组别。
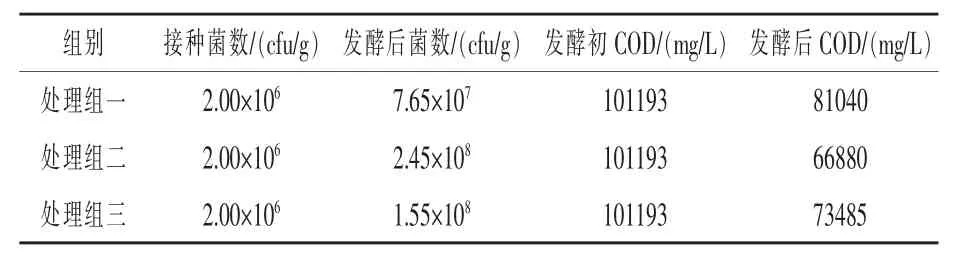
表2 复合菌木薯酒糟上清液液体发酵
2.2.3 单菌木薯酒糟固体发酵 如表3所示,菌株JJ-2在木薯固体酒糟中发酵后菌量达到3.20×109cfu/g,菌量增加约3200倍,粗蛋白质含量增长9.29个百分点,真蛋白含量增加6.83个百分点。

表3 单菌木薯酒糟固体发酵
2.2.4 黑曲霉糖化木薯酒糟 如表4所示,经过黑曲霉处理后木薯酒糟的还原糖含量可达8.2%,达到了添加糖蜜后木薯酒糟中还原糖含量,因此,可以直接添加菌株进行固体发酵。

表4 黑曲霉糖化固体酒糟不同时间段还原糖含量%
2.2.5复合菌木薯酒糟固体发酵 如表5所示,JJ-2可以在经过黑曲霉处理且未添加糖蜜作为碳源的木薯酒糟上较好的发酵生长,经过发酵活菌数可达2.61×109cfu/g,粗蛋白质含量增至22.69%,表明能较好的改善木薯酒糟品质。
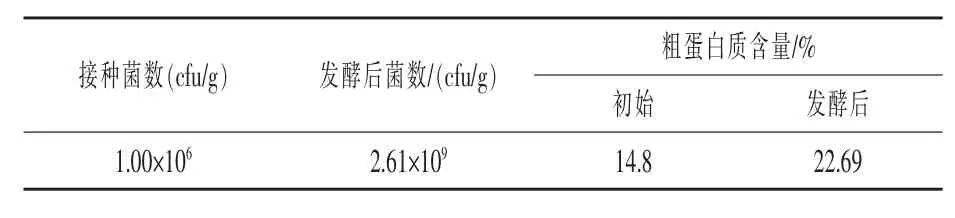
表5 复合菌木薯酒糟固体发酵
2.3 生理生化特征 生理生化特征鉴定结果见表6。

表6 生理生化特征鉴定结果
2.4 分子生物学鉴定 由图1可知,JJ-2的18S rRNA基因核酸序列,与GenBank中Pichia kudriavzevii的核苷酸序列同源性达到100%。因此,确定JJ-2菌株为Pichia kudriavzevii。
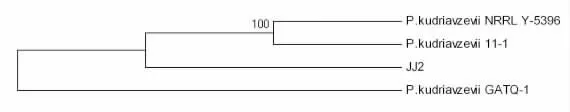
图1 基于JJ-2的18S rRNA序列同源性构建的系统发育树
3 结论
本研究从酒醅中有针对性的筛选到耐酒精且在木薯酒糟中发酵良好的酵母菌株JJ-2,经过生理生化研究和分子生物学鉴定,确定为库德里阿兹威毕赤酵母(Pichia kudriavzevii)。
酵母菌株JJ-2在木薯酒糟上清液液体发酵过程中可以有效降低上清液的COD值,在经过10%黑曲霉上清液处理后的木薯酒糟上清液中也可以得到良好的发酵,并且COD值得到了更大程度的降低(COD含量降低了33.91%),说明木薯酒糟经过10%黑曲霉上清液处理后,有利于木薯酒糟上清液的液体发酵。
酵母菌株JJ-2在木薯酒糟固体发酵过程中,可以良好的生长发酵,粗蛋白质含量提高9.29个百分点,真蛋白含量提高6.83个百分点。在实际生产过程木薯酒糟通常需要添加糖蜜作为碳源进行固体发酵生产,未能充分利用木薯酒糟中碳源,本试验通过添加黑曲霉对木薯酒糟进行糖化处理,可达到添加糖蜜后还原糖的含量水平,并且酵母菌株JJ-2在经黑曲霉糖化后的木薯酒糟发酵过程中,也可以良好的生长发酵,并且粗蛋白质含量也得到了很大程度的提高(增长7.89个百分点)。
综上可知,本研究筛选的酵母菌株JJ-2可适用于木薯酒糟的工业发酵生产,在降低木薯酒糟上清液COD、提高木薯酒糟蛋白含量方面有着很大改善作用,不仅缓解了木薯酒糟上清液排放对环境造成的污染压力,而且还提升了木薯酒糟的饲料应用营养价值和饲料蛋白品质,增大了木薯酒糟的应用领域。
