基于Arduino及其外围传感器控制高压脉冲发生器用于细胞不可逆电穿孔实验
2021-08-07张科王杰
张科,王杰
1 南京医科大学,南京市,210029
2 江苏省人民医院 介入科,南京市,210029
0 引言
不可逆电穿孔(irreversible electroporation,IRE)是利用高压脉冲电场使细胞膜出现不可逆性的穿孔造成细胞内外稳态失衡的现象,从而导致细胞凋亡[1]。2011年,美国Angio Dynamics公司利用这一原理研发出了商业化的IRE系统NanoKnife®(纳米刀)用于肿瘤消融。IRE消融不同于射频和微波利用连续的高频电流产生的热量消融,而是利用上千伏的微秒级间断高压脉冲电场消融,不会导致大量的热量积累,被称为非热消融。常被应用于胰腺癌、前列腺癌、脑肿瘤等热消融禁区,展示出不可替代的优势和良好的疗效[2]。
目前国内重庆、上海、天津等地相继研发出相对成熟的IRE设备和控制系统[3-5],但出于知识产权的保护暂不对外提供相关硬件和技术支持,而美国IRE设备价格又过于高昂。面向临床设计的IRE系统功率大、体积大、不便携且参数专为人体特定肿瘤设计,往往不适合应用于实验室和小动物等临床前实验。为此常需要自主研发实验用机[6-7],无疑增加了研发难度、研发成本和周期。为了满足现阶段拟开展IRE基础研究工作人员的需求[8-9],提出了一种过渡性的、可快速实现、简易有效、低成本便携式小型IRE测试和控制系统方案。该方案硬件系统包括一台市售的成品小型脉冲高压发生器、一块Arduino开发板和一个外围脉搏及温度传感器模块。软件平台通过对Arduino编程实现心电触发和温度反馈功能,控制高压脉冲按照IRE算法进行发放。进行了人肺癌细胞学体外测试,验证了非热IRE的发生,达到了实验要求。
1 高压脉冲发生器选型
实验所用成品高压脉冲发生器定制购自于大江方波科技公司,型号:IGBT-897G,价格只需400元左右。具体参数:功率800 W,输入电压:12 V DC,脉冲输出电压:600~1 200 V可调,最大输出电流65 A,脉宽20 μs~2 ms可调,释放频率50~300 Hz可调。脉冲释放方式:轻触开关手动触发。该机型前级采用高频PWM驱动芯片将输入的直流电逆变为交流电,经变压器升压后再整流滤波电容储能,后级采用IGBT驱动芯片驱动IGBT管释放高压方波脉冲。具有过流保护、短路保护、过热保护、稳压输出等功能。这种结构的高压脉冲发生与商业化IRE设备结构和原理类似,方波输出效率高、机器质量轻、功率和电流储备充足。接实验负载,示波器波形验证,电压输出稳定在设定值,方波波形规则,如图1所示。频率和脉宽参数均符合出厂预设值。
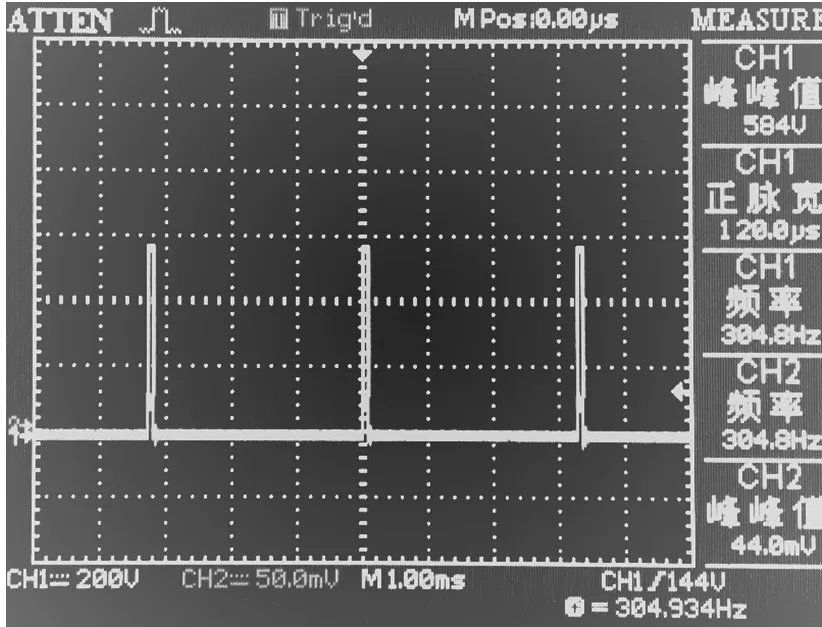
图1 高压方波脉冲波形Fig.1 High voltage square wave pulse waveform
2 脉冲释放的控制
由于定制的高压脉冲发生器和市售大部分该类小功率高压脉冲发生器一样,只能手按开关在出厂预设固定频率内连续释放脉冲串,不仅导致产生的热量不可控,也不符合IRE算法临床治疗中一个心电周期在R波有效安全不应期内释放一个脉冲的要求[10]。因此,需要对这台高压脉冲源加装热反馈和心电触发控制系统。使其能够按照IRE算法进行释放脉冲,同时增加温度闭环反馈,监测目标区温度实现超温停止释放脉冲。通过这种方式,可以根据需求对市面带有手动释放开关的、不同功率参数的成品高压脉冲发生器实现控制。该控制系统的程序设计流程,如图2所示。
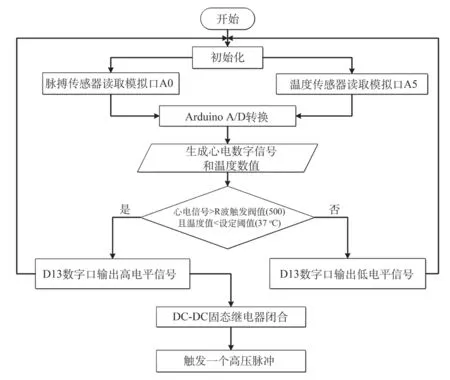
图2 脉冲控制程序流程Fig.2 Programme flow diagram of pulse control
选择Arduino UNO R3开发板作为控制单元是因为其开源化的硬件和软件平台[11-12]。硬件内置A/D转换,支持丰富的外围传感器。Arduino IDE软件支持相关库文件调用和例程参考,在此基础上进行二次开发,大大缩短了研发周期。
实验选用的脉搏传感器模块型号为PulseSensor XD-58C。实物如图3所示。其本质是一种反射式光电信号传感器。其原理是通过检测绿色LED发出的光随血管容积的变化,光的吸收量也发生变化,从而得到了脉搏波[13],输出波形如图4所示。模块为三线制,分别为模拟信号输入端、5 V供电端和GND端。模拟口采集到的光电模拟信号经A/D转换成0~1 024之间的数值,以模块推荐的550作为R波触发条件,兼顾灵敏和准确性。但实际上大于550的触发时间长达数十毫秒,在此时间范围内,会造成多个脉冲的发放。为了精准发放一个脉冲,采用Delay延时函数控制Arduino数字口触发电平高低时间继电高压脉冲控制开关时间。例如,在高压脉冲发生器释放频率300 Hz的条件下,即一个周期约为3.33 ms。将有效高电平时间控制在3.33 ms内即可实现每次触发释放一个脉冲。将Arduino D13 I/O口作为高电平信号触发输出端,可以通过板载LED的闪烁频率和时间长短观察搏动周期和触发时间,与高压脉冲发生器受控端口通过3~50 V DC-DC固态继电器相连,即可实现心电信号控制一个脉冲的发放。

图3 光电式脉搏传感器实物图Fig.3 Figure of photoelectric pulse sensor

图4 脉搏传感器串口输出波形Fig.4 Serial output waveform of pulse sensor
实验选用的温度传感器模块型号为YL-38,如图5(a)所示。原理是利用一个10 kΩ NTC热敏电阻和10 kΩ电阻串联后利用热敏电阻探头上的分压模拟量转换为数字量,再通过 Steinhart-Hart方程转换为温度数值。该模块有四个端口,分别为模拟量输入口、数字量输入口、5 V供电端和GND端,数字量输入口通过模块上LM393比较器超温可触发其LED点亮,可以不接。目前IRE热效应检测主要采用光纤测温设备[14],因光纤探头不导电,可以避免电磁干扰,但设备价格过于高昂。该方案温度传感器为防止电磁干扰造成温度测量不准和电场不均匀,需替换原有10 kΩ热敏探头,更换为直径0.8 mm珠型高灵敏环氧塑封绝缘探头(上海领技公司,R=10 kΩ,B=3 950,精度1%),如图5(b)所示。引线延长加绝缘处理,如图5(c)所示。

图5 温度传感器及其替换探头Fig.5 Temperature sensor and replacement of probe
接入Arduino写入测温程序,用4~100oC之间的水溶液多次测试,温度响应迅速,和热电偶、电导率仪以及水银温度计测得的温度误差在0.5oC以内。脉冲释放中工作稳定,温度随脉冲的发放呈锯齿状上升。脉冲按心率释放时测试液温度曲线,如图6所示。温度传感器将实时采集的温度数据反馈给Arduino,协同脉搏传感器一同控制脉冲发放。未达温度阈值上限时,满足脉搏传感器触发条件时D13口置高电平触发脉冲释放。超过温度上限时,置低电平停止触发,待温度降至阈值以下时再次触发。该实验在常温下28oC下进行,可选择37~40oC之间作为温度上限,从而保证细胞不会因为热效应致死,便于评估IRE的杀伤效应。

图6 脉冲按心率释放时测试液温度曲线Fig.6 Temperature curve of test fluid when pulse releasedaccording to heart rate
3 细胞学体外测试验证
将体外培养的人肺癌细胞A549培养基和磷酸盐缓冲液等比例混合制成细胞悬液,测得混悬液电导率为0.8 S/m。取400 μL混悬液加样至48孔细胞培养板中,采用5 mm间距电极针放入各孔连接高压脉冲发生器输出端,输入触发电平控制端接入Arduino开发板和脉搏、温度传感器,各硬件之间连接,如图7所示。

图7 硬件连接示意图Fig.7 Hardware connection diagram
上电后高压脉冲发生器按照心电触发和温度反馈控制程序释放脉冲,记录电压、脉宽、脉冲个数等数据。脉冲电场处理后的细胞继续培养24 h排除部分细胞可逆性的穿孔,然后进行台盼蓝染色和活死细胞计数筛选最佳参数条件。台盼蓝活死细胞染色原理:活细胞细胞膜完整,台盼蓝染料拒染;死细胞细胞膜穿孔,染料进入细胞内将细胞染成蓝色。应用Countstar IC1000型自动细胞计数仪实现对活死细胞的计数,重复测试20孔,计算细胞穿孔率的平均值。在Arduino及其传感器控制和反馈下,高压脉冲发生器在电压600 V、场强1 200 V/cm,释放100个脉宽100 μs的脉冲的参数下,95%以上的细胞出现非热性的IRE,如图8所示,(a)为处理前活细胞拒染,(b)为处理后大部分细胞穿孔被染色。

图8 脉冲电场处理前后的细胞染色Fig.8 Cell staining before and after pulsed electric field treatment
4 结语
本实验提出的Arduino联合其外围传感器控制高压脉冲发生器并用于IRE实验的方案实现简单,所需硬件皆为成品,易于购得,成本低廉。控制反馈程序简单,无需额外开发上位机软件。经体外实验测试,系统运行平稳,按照目前应用于临床的IRE算法实现了非热IRE。本小型系统具有轻便可移动、开源易实现、算法可调便于二次开发等优点,尤其适用于资源和资金缺乏的高校医学及生物医学工程专业研究生IRE研究入门和改进。在方案基础上进一步完善和优化,使其不但能够应用于不同细胞IRE参数筛选和优化、三维细胞组织胶IRE电场量效关系研究、电化学、电热效应、电诱导免疫学、组织病理学、组织阻抗和电导率等IRE相关体外实验,也能进一步安全有效地应用于动物体内小病灶IRE组织消融方面的实验研究。
