棉田恶性杂草香附子的研究概况
2021-08-06徐小燕张卓亚李冬梅吴靖涛张钟炎郭世俭
徐小燕 张卓亚 李冬梅 吴靖涛 张钟炎 郭世俭
摘要:香附子是世界性的恶性杂草,严重影响全球多个地区的农业生态系统,也是我国十大难防恶性杂草之一,严重影响棉花、玉米、甘蔗和许多蔬菜作物生产。作为棉田难防杂草之一,它具有生长旺盛、繁殖力强、适应性广等特性,与多种作物竞争,可造成作物产量的巨大损失。本文从香附子的起源与分布、生境和氣候要求、生活史等方面概述其生态学特性,从形态特征、繁殖特征、生长特性、休眠特性、传播方式等方面概述其生物学特性。简要阐述了香附子的危害,并结合现有的防除技术,提出香附子在棉田的防除对策及今后的研究展望,即坚持预防为主、综合防治的方针,建立以农业防治为基础,以化学除草为核心,以物理、生物等多项措施相互配合、补充的综合防除体系。
关键词:棉花;杂草;香附子;特性;危害;防除策略
中图分类号:S451 文献标志码:A 文章编号:1003-935X(2021)01-0001-11
Abstract:Cyperus rotundus is a worldwide noxious weed that seriously affects the agricultural ecosystems in many regions. It is also one of the ten most difficult-to-prevent malignant weeds in our country and seriously affects the production of cotton,corn,sugarcane and many vegetable crops. As one of the hard-to-control weeds in cotton fields,the interference of C. rotunduscan cause significant economic losses due to its vigorous aggressive growth,prolific seed production,and strong adaptability. This article summarizes the ecological characteristics of C. rotundus from its origin and distribution,habitat and climate requirements,and life history. It also outlines C. rotundus biological traits including morphological,reproductive,growth and dormancy characteristics,propagation methods,and briefly explains its agricultural hazards. In addition,combined with existing technologies,some control strategies in cotton fields and future research prospects of C. rotundus are discussed. We must adhere to the principle of prevention first and establish a comprehensive prevention and control system with chemical weeding as the core but aiming to an integrated management system in which multiple tactics such as physical and biological are combined and complement each other.
Key words:cotton;weed;Cyperus rotundus;properties;interference;control strategy
香附子(Cyperus rotundus L.)为莎草科莎草属多年生草本植物,国内不同地区又俗称三棱草、回头青、雷公头、草头香、梭草、胡子草、胡子青、香胡子、地贡子、野韭菜[1];原产于印度次生大陆,现除北纬35 ℃以北的低寒区不适于生存外,已广泛分布于92个热带及亚热带国家,造成50多种作物减产23%~89%[2]。香附子位居世界十大恶性杂草之首,严重影响全球多个地区的农业生态系统,也是我国十大难防恶性杂草之一,在我国大部分地区有分布,主要危害棉花、花生、蔬菜、甘薯、玉米、大豆、果树、小麦、水稻等作物[1]。香附子是C4植物,可以在高温和强光条件下吸收更多的二氧化碳,比C3作物棉花和其他杂草更具有竞争力[3]。它在棉田中的发生数量和危害程度较重,已经成为棉田中最难防杂草之一。本文通过对近年来有关香附子的生物学和生态学特性、竞争危害、化感作用及防除技术等方面的研究进行综述,旨在进一步研究香附子在棉田的发生危害特点及其对棉花的竞争危害,为制定科学合理的防控指标和综合防除策略奠定基础。
1 生态学特性
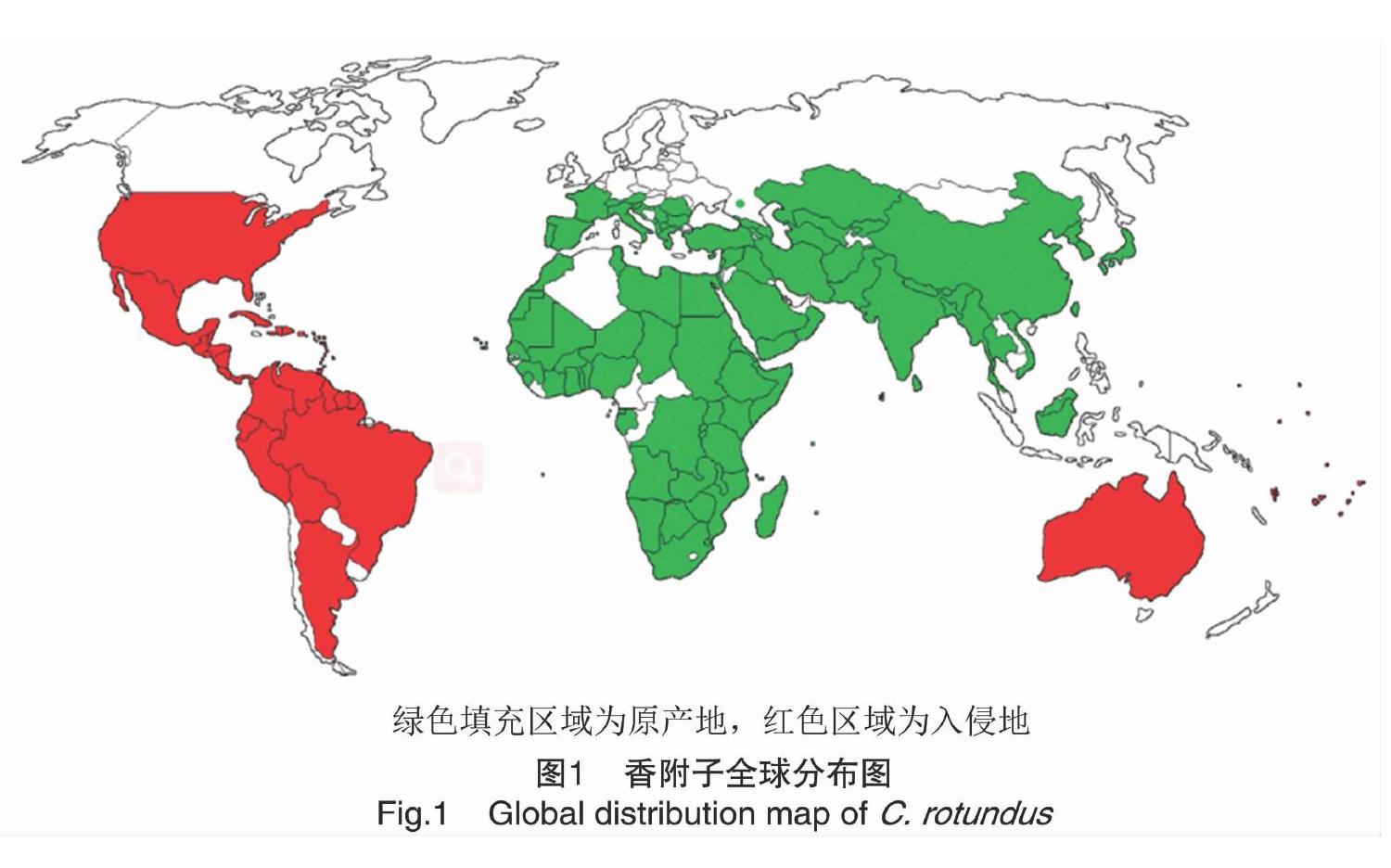
1.1 起源和分布
香附子原产于印度,广泛分布在非洲、美洲、南亚、南欧和中欧国家,对全球热带和亚热带农业生态系统产生了严重影响[4]。早期香附子的块茎被用来泡茶、食用、当作药材和观赏。香附子可以忍耐恶劣的气候条件并快速建立种群[5]。香附子主要分布区域见图1。
1.2 生境和气候要求
香附子常发于耕地、路旁、草坪、公园和荒地,喜欢潮湿肥沃的土壤和温暖的气候。据报道湿度和温度是影响其生长繁殖的最重要因素[2]。在较寒冷地区,进入霜冻前香附子可以不断产生新的块茎和植株,进入霜冻后植株叶子会脱落,其块茎进入休眠状态,块茎对盐碱、低温和阴暗较敏感。在较温暖地区,因其生长快速,可以产生大量块茎,多年生等特性导致其难以防控。此外,大量的地下块茎和根状茎系统增加了植物对极端条件的耐受性,如干旱、高温和洪水[6-7]。
1.3 生活史
香附子地上植株基本由土壤中的块茎或基部鳞茎发芽而来,其蔓延是从植株基部膨大形成新的鳞茎,新鳞茎又长出根茎,纵向发展。新根茎长到一定结数(5~8节,多为6节)便停止生长[8],在根茎尖端2~3 cm处膨大,形成新的块茎。根茎顶端成为块茎顶芽,部分块莖发芽长成植株,不发芽的块茎转入休眠。新生的块茎,已长植株的块茎和鳞茎均可发生新的根茎,从而又产生新的块茎和植株,如此循环地生长和蔓延,构成了由根茎连接起来的块茎、基部鳞茎和地上植株的复杂体系[9]。地下块茎通常会表现出顶端优势,在一个块茎生长时会抑制其他块茎的生长。平均日长和温度被认为是影响香附子生长发育的关键因素,决定了块茎的大小和干物质的产生[10]。春季香附子越冬的块茎发芽长成植株,开花的茎在晚春形成,植株在夏末完成其生命周期。植株在3~6周内就能成熟,地上部分在秋季全部死亡,种子基本不能存活[11-12]。我国棉田中香附子通常于4月中旬开始发生,5月上旬出现第1个发生高峰,6月上旬出现第2个高峰,以后迅速下降,8月中旬以后基本不再发生,危害主要集中在5—6月[8]。
2 生物学特性
2.1 形态特征
香附子是一种直立、无毛、须根的多年生莎草,可长至7~40 cm,由地下茎、根茎、基部鳞茎、地上植株4个部分组成[13-14]。它具有丰富的根状茎和块茎,从一个块茎的1~3 cm处可以长出许多块茎,形成一个分布广泛的地下块茎网络[15]。块茎呈椭圆形或纺锤形,三角状、长圆形、卵形,宽12 mm、长10~35 mm,黄色,褐色,成熟时呈黑色,块茎坚硬,有香味。香附子叶较多,短于杆,宽2~5 mm,深绿色,光亮,线形,上表面有凹槽,没有叶舌或叶耳,叶背中脉突出,基部有短鞘,紫红色;侧聚伞形花序,花序通常有2~4个苞片,苞片由小的暗红色或紫褐色有壳的花组成,有3个雄蕊和3个柱头;具3~10条长短不等的辐射枝,每枝具 2~12条小穗,小穗条形,长1~3 mm,宽约 2 mm,含6~26花;心皮附着在不分枝直立的三角形横截面的深绿色、无毛的秆上。香附子通常在夏天开花,秋天结实。种子长圆形,具三棱,长1.5~2 mm,宽约1 mm,暗褐色,有细点。实生苗当年只长叶不抽茎[14,16-17]。
2.2 繁殖特性
香附子块茎和种子均能繁殖,主要通过根状茎、块茎和基部鳞茎繁殖,种子繁殖较少[12]。香附子具有惊人的繁殖能力,在生长季节种植单个块茎,1周左右即可长出香附子苗,约20 d即产生新的块茎,不仅块茎是这样,鳞茎也可以[18],90 d以后能产生100个以上植株、150个块茎,其质量要比原质量增加250倍。单个块茎,埋入6 cm深土层,6个月后能长出1 165个植株,2 324个块茎。如用1.1 g块茎埋入土层,每隔30 d调查1次,60、120、210 d能分别长出6、144、274.6个块茎,120 d后香附子扩展面积达1 m2,180 d后可扩大到 4 m2,总株数1 168株[9]。在一个生殖季节内,1 hm2 香附子可以产生1 000万~3 000万个块茎,每个块茎又可以产生600个植株。块茎萌发 4~6周后内开始形成新的块茎,1个块茎可以产生100个新的块茎,这些块茎呈链条装连接[13,15,19]。土壤翻动会导致块茎链断裂,打破其顶端优势,使块茎快速生长繁殖[20]。在实验室和田间条件下,单个块茎在3~4个月内可以产生550~1 200个块茎芽,存活时间为17个月[21]。有研究记录,0.66 m2的块茎经过2个生长季节增加到880 m2[22]。
香附子种子繁殖较少,因种子形成的幼苗缺乏生存环境所需的活力,因此种子在香附子繁殖中不具有重要性。通常香附子种群不会开花和形成种子,即使开花,有时也不会产生种子,一般在幼嫩的、蓬勃生长的种群中比较容易产生种子。如果植株从种子长成的幼苗中发育成熟,且种子产量也较高,但其活力一般低于5%。老化、热处理和化学处理可以提高种子发芽率,光照不能促进种子萌发[19]。
2.3 生长特性及其影响因素
块茎和基部鳞茎在香附子的繁殖和传播中起着重要作用[23]。香附子的块茎发芽率高达98%,每个块茎有多个芽眼,受顶端优势控制,当侧芽萌发受到伤害时,其他芽眼迅速长出新株。影响块茎萌发的主要因素为光照、温度、水分、含氧量和土层位置[5]。
光照不能促进香附子块茎萌发,但影响地下部分(块茎)和地上部分(芽)生物量的分配[5,8],但也有研究认为光照可以影响块茎萌发[24]。
香附子块茎对温度适应范围较广,王鸿等研究认为,0~43 ℃之间的温度对其块茎活性没有影响,高温更有利于发芽,可发芽温度为19~39 ℃,最适温度为30~35 ℃;当温度在15~35 ℃范围内,块茎出芽速度、出芽率与温度呈正相关;温度在20 ℃以下时,香附子地上部分开始生长缓慢,也不能产生新的块茎[9]。 Wallace等认为香附子置于28 ℃的恒温下出芽率增加[25]。Iqbal等认为在 (42±3) ℃ 的高温下暴露13 d,块茎的发芽延迟,块茎的生长能力也下降[26]。钱益新等研究发现,在 5 ℃ 冰箱中存放5个月的块茎,取出后仍有76.6%的块茎能出芽,仅3.6%的不出芽;1~3 ℃与5 ℃时的影响差异不大,0 ℃下6 h出芽率明显降低,-10 ℃下6 h块茎不发芽[8]。王鸿等认为,冬季气温低于2 ℃且持续3个月,仅有20%的块茎可存活;-2 ℃处理4 h,有50%块茎死亡;-5、-10 ℃能使块茎全部死亡[9]。Iqbal等也发现,块茎在冷冻温度下暴露3 h会降低块茎的活力,导致其不能发芽[26]。然而,也有人研究认为,块茎暴露在4 ℃环境中4 d可以刺激其块茎发芽。变温处理有利于块茎发芽,Webster认为土壤温度的每日波动导致块茎发芽,而短期暴露于高温(45 ℃)可使块茎发芽增加100%[27]。Travlos等认为,温度日波动从0 ℃到12 ℃的变化显著增加了不同深度下块茎的发芽率[28]。可见,香附子块茎喜温、怕冻,不耐低温,0 ℃以下低温会影响其发芽,而变温处理有利于块茎发芽。香附子可随温度的升高和昼夜温度变化来打破块茎的休眠,实际生产中我们可根据每天土壤温度的变化来预估香附子萌发时间,掌握最佳防除窗口期。
香附子怕旱喜湿,潮湿的土壤环境有利于香附子的生长和繁殖。块茎含水量与其发芽率密切相关,块茎存活的临界水份含量为11%~16%,当水份低于上述指标块茎便丧失发芽率。把块茎暴晒3 d,有50%以上丧失发芽率,14 d全部不能发芽。块茎在湿润条件下35 ℃温箱培养,10 d后块茎出芽率达90%,但如将块茎淹人水中1 cm,同上述条件培养则不出芽,且已出的芽也不再伸长;但浸泡于水中100 d的块茎,将水放干并保持湿润,多数块茎仍能发芽[9]。
香附子块茎的发芽与所处土层位置有关,块茎出芽随土层深度的增加而减少。通常块茎在土壤中的分布深度因土壤条件而异,一般在沙土中比黏土中分布深,据钱益新等调查发现,块茎最深可达50 cm,而50%~70%的块茎集中在0~10 cm 土层中,在土壤上层5 cm处生长的块茎的出芽率始终高于在5~15 cm处生长的块茎,可见,分布于这一土层中的块茎是香附子防除的关键。
香附子块茎发芽率与环境中氧气含量成正比,含氧量高则生长植株多[9]。土壤质地不同会影响含氧量高低,据调查,黏质土壤质地黏重,通气条件差,氧气含量少,块茎发芽率低,而沙土和沙壤土质地比较疏松,通气条件好,氧气浓度含量高于黏质土壤,块茎发芽率更高。
在自然条件下,块茎发芽有季节性变化,春夏两季发芽多,秋季发芽较少[9]。发芽主要受根茎顶端优势控制,从发芽率看老块茎>新块茎>鳞茎,而新、老块茎差异不大,块茎发芽与大小、成熟度无明显关系,但鳞茎明显低于前二者。块茎发芽与组织切割也有一定关系,切割过的块茎出苗数会增多。选较粗壮的根茎切段培养,平均出芽率达45%~55%。
香附子种子发芽较少,种皮切破与否对种子的发芽率影响不大,乙酸乙醋处理不利于发芽,但经丙酮处理10 min的种子发芽率比未经处理的高1.6倍左右[8]。变温处理对香附子种子发芽率有一定影响,能促进种子发芽。
2.4 休眠和寿命
地下繁殖器官通过顶端优势控制块茎发芽来保存生命,正常情况下,香附子块茎有50%以上处于休眠状态,有的是形成块茎后不长出新株,有的是新株死亡后休眠。休眠块茎不会产生新的根茎,由老根茎连接的多个块茎,一般位于中间的休眠,两端的块茎能发芽。如把根茎连接的多个块茎切断成单个块茎,不论是否休眠,只要环境条件适宜,均能长出新株[9]。
Neeser等指出,块茎年龄和埋藏深度是块茎休眠的重要决定因素。块茎休眠随块茎年龄的增加而增加,观察发现18个月后块茎死亡速度加快,在33~36个月内全部死亡,推测除草剂对年龄较大的块茎种群可能效果较差[29]。香附子块茎的80%以上存在于距表层15 cm内土壤中,Neeser等研究表明,深度在8~23 cm的块茎寿命并没有明显差异。另外,研究表明,破坏香附子的地上部分不会减少地下块茎的密度,且不影响块茎的休眠和发芽能力[29]。
香附子种子活力5年达到峰值,发芽率在5年内随着存放年数的增加而上升,5年后随着时间的延长发芽率逐年下降[8]。
2.5 传播
在农田中香附子主要通过块茎繁殖,块茎可以向上、向下或水平延伸[13,15]。地下大量的块茎系统是香附子生存发展的关键,也是防治的难点[4-5]。这些块茎可通过农业机械传播,自然界中风暴、动物、流水可帮助其传播,人为的苗木运输、灌水、土壤搬运、草皮、地膜、干草和饲料也可导致块茎的长距离传播[30]。香附子块茎的快速繁殖能力是其快速侵染扩张的主要因素,为了限制这种杂草的蔓延,摧毁地下休眠的块茎是必要而有效的[31]。
3 香附子的危害
3.1 农作物产量损失
香附子的快速繁殖能力和庞大的地下块茎系统对作物有着非常强大的竞争优势,在香附子生长季节可以有效地与作物争夺水分、光照和营养[32]。据报道,香附子在半年中能从每667 m2的土壤中吸取6.37 kg氮、0.78 kg钾、3.39 kg磷,其中50%以上贮存在块茎中,其危害以3—11月花果期最重。香附子严重危害农作物生产,在全世界每年可造成数百万美元的经济损失。
据报道,香附子可造成南亚夏季作物减产23%~89% [33];在乔治亚州香附子是玉米、棉花、花生、大豆、烟草和蔬菜中五大恶性杂草之一[34];香附子是直播稻中第二大恶性杂草,在21个水稻种植国家均有分布,可造成水稻产量损失42%~50% [35-37];香附子占甘蔗田总杂草数量的80%,特别是在热带和亚热带的土壤湿润地区,可造成甘蔗产量损失20%~30% [38-40];在美国密西西比州可造成棉花减产70%~85%,损失约4 050万美元[41-43];在大豆田中可造成23%~89%的产量损失[44];与大豆相比玉米对香附子更敏感,即使杂草在低密度情況下也会造成较大的产量损失[41]。除了主要农作物外,香附子对蔬菜、水果也会造成不同程度的产量损失。香附子可导致甜椒减产31%~73%,萝卜减产39%,番茄减产 28%~40%,茄子减产10%,可降低香菜茎干重、叶面积、叶柄液中氮钾浓度和产量[45-47]。香附子是斯里兰卡洋葱田中最主要杂草,可造成减产高达61%[48]。
香附子是棉花田的恶性杂草,在棉花田的危害较重,因香附子是C4植物,可以在高温和强光条件下吸收更多的二氧化碳,比C3作物棉花和其他杂草更具有竞争力。Charles等将莎草列为澳大利亚棉花生产的第二大杂草,对新南威尔士州79%的棉花产业和15%的棉花面积(21 000 hm2)造成了不利影响[49]。而香附子是莎草科杂草中危害最为严重的杂草,影响90个国家的52种作物。
近年来,我国棉田耕作制度的改变和新疆主产棉区膜下滴灌植棉技术的推广应用,为香附子的繁衍创造了适宜的生态环境,香附子等棉田恶性杂草危害逐年上升,尤其在湿润疏松土壤或沙土棉田易暴发危害,对棉花前期生长发育造成严重威胁。但据黄红娟等对新疆生产建设兵团第五师、第六师和第八师的棉田杂草抽样调查结果,目前在新疆棉田为害的三棱草,其实是与香附子比较接近的莎草科杂草扁秆荆三棱,该草在新疆局部棉区的发生非常严重,虽然只是局部发生,但在所发生地块的杂草密度很高,给当地棉花生产带来极大损失[50]。
3.2 化感作用
据报道香附子块茎中存在多种化感物质,它们以有机酸和无机酸的形式存在,具有明显的化感作用,对作物、水果和蔬菜的生长、繁殖产生影响[51-52]。香附子的提取物对作物的萌发、根茎的伸长、幼苗生长、叶绿素含量以及干物质的生产均有一定抑制作用[53]。据报道,香附子的一种提取物可缩短小麦和豆类根茎长度,导致叶尖卷曲,从而抑制其光合作用[51,54-55];香附子高浓度的叶片渗滤液和根分泌物对蔬菜作物和水果的萌发有抑制作用[54,56];香附子块茎的甲醇提取物可以抑制乙酰胆碱酯酶活性,其含量在3.30 mg/mL时可以降低种子萌发率,含量在350 g/mL时可抑制幼苗生长[57]。
3.3 病虫害寄主
香附子可作为许多病虫害的寄主,包括无脊椎动物、病害、线虫[58]。Schroeder等认为它是根结线虫的替代寄主[58]。刘洋报道,香附子是白背飞虱、黑蝽象、铁甲虫、东亚飞蝗等昆虫的寄主[59];陈秀双认为,棉花田杂草香附子、龙葵、反枝苋等能转主寄生的病虫害有26种之多[60]。有效控制香附子可以破坏以香附子为食的病虫害的生命周期。
4 防治对策
香附子被认为是世界上最难防治的杂草,对于多年生杂草来说,目前国际上最常用的防除方法是反复地进行机械翻耕处理和化学除草剂处理。笔者认为控制棉田香附子的危害必须坚持预防为主、综合防治的方针,建立以农业防治为基础,以化学除草为核心,包括物理、生物等多项措施相互配合、补充的综合防除体系,充分发挥各种防除措施的优点,扬长避短,以达到经济、安全、高效地控制香附子危害的目的。
4.1 预防措施
预防措施主要用于防止香附子的扩散,当发现新的危害点时,应在幼苗期及时小范围清除,避免形成发达的地下块根而造成长期危害,田间发现地下块根要及时深翻冬耕,并做冷冻或暴晒处理令其失活,避免进一步繁殖[61]。另外,播种前精选作物种子,避免通过作物种子运输等人为传播而扩大危害面。
4.2 农业防治
香附子喜潮湿、不耐旱,怕冻、怕荫、怕水淹,块茎多分布于浅土层[8],因此在防除香附子时,可根据香附子喜潮湿、怕水淹的特点进行水旱轮作;根据其怕荫可采用作物合理密植法,加速作物的封行进程,从而抑制杂草生长[61]。据报道,甘蔗密植可显著减少香附子在田里的生物量,使甘蔗植株充分利用资源、增加产量[62]。香附子块茎发芽最适温度为30~35 ℃;20 ℃以下,地上部生长缓慢,地下块茎不能形成。研究发现,密植作物在严密阴蔽条件下,土表温度要比暴露土表温度低 4 ℃ 左右,这对香附子生长蔓延不利,据1989年8月对夏山芋地调查,完全覆盖地平均每平方米有香附子植株10株,而1/3露地为21.51株,前者比后者减少53.51%[9]。另外,利用竞争作物套作也可以抑制其生长并减少大田中块茎的数量,如种植藜豆(velvet bean)、油麻藤(Florida velvet bean)和木豆(pigeonpea)均能降低香附子的生物量[63-64],用芝麻、高粱、大豆与棉花套作,也能使棉花田香附子密度降低了70%~96%。
4.3 物理防治
浅耕、深耕、土壤日晒、伤冻、遮盖和塑料覆盖都可导致块茎干燥和碳水化合物饥饿,从而降低块茎的活力和再生能力,抑制香附子生长[65-66]。根据怕旱、不耐冻的特点,可在冬天低温时深耕耙晒,把块茎翻上来能冻死一部分,春旱时再耙晒,由于没有水分又能晒死一部分香附子,也可进行夏季伏耕,块茎暴露在高温和脱水的环境中,发芽率可降低70%~100%[61,66]。定期浅耕也是防除多年生杂草的有效措施之一,据报道,反复人工除草、机械除草对香附子的防效可达 74%~93%[67-68]。地表覆盖或土壤覆盖可以显著降低香附子的干物质量,降低幅度达45%~53%和40%~50%[69]。在温暖的天气里,聚乙烯薄膜覆盖增加了土壤温度,可以有效地控制香附子,使营养生长和块茎减少95%[27-28],但一些可降解聚乙烯覆膜材料由于对缓慢穿孔的抵抗力较低,未能有效防治蔬菜作物中的香附子[70-71]。
4.4 化学防治
4.4.1 除草剂应用 除草剂应用是治理香附子的一个重要手段,化学除草剂的使用效果取决于除草剂的特性、施用量、施药时间和施药次数,及土壤块茎库和作物耕作情况。化学除草剂除了考虑香附子的防除效果,还需要考虑目标作物棉花及其后茬作物的安全性。化学除草剂按施用时间不同分为封闭除草剂和茎叶除草剂两大类。封闭除草剂的目的是降低块茎密度,防止其出芽和繁殖,并最终减少入侵。茎叶除草剂是施用于地上植株,杀死地上部分,并吸收传导到地下块根控制地下部分生长和繁殖。
目前,对香附子控制效果较好的除草剂主要为内吸传导性较好的除草剂,据报道对香附子活性较高的除草剂种类包括:ALS抑制类除草剂啶嘧磺隆、氯吡嘧磺隆、甲基碘磺隆、磺酰磺隆、噻酮磺隆、甲酰胺基嘧磺隆、三氟啶磺隆、吡嘧磺隆、醚磺隆、环丙嘧磺隆、乙氧磺隆、唑吡嘧磺隆、四唑嘧磺隆、苄嘧磺隆等;激素类除草剂2甲4氯、氯氟吡氧乙酸等;PDS抑制类除草剂氟啶草酮等;PPO抑制类除草剂甲磺草胺、乙氧氟草醚;光合作用抑制剂苯达松和特草定,以及其他除草劑草甘膦、甲基磺草酮等[72-73]。上述除草剂被用于防治香附子均有一定防效,但最有效的还是草甘膦和氯吡嘧磺隆,这2种除草剂不但能杀死地上组织,还可以向下传导至块茎中,降低其地上植物和地下块茎活性[59]。为了有效且持久防治香附子,化学除草可以封杀结合,早期使用封闭除草剂封闭处理,出苗后结合草甘膦茎叶喷雾处理。
Charles研究表明,棉花田香附子的防治策略是在休耕期反复施用草甘膦,配合在棉季早期施用MSMA等封闭剂,在棉季后期施用草甘膦,能有效防除棉田香附子[74]。在抗草甘膦大豆和棉花体系中连续施用草甘膦可有效防治香附子,防效高达90%,可以降低块茎活力达45%~80%[75]。在我国棉区生产上经常采用人工涂抹高浓度草甘膦、氯吡嘧磺隆药液到香附子成株茎叶上或定向喷雾,药液能吸收传导至地下块茎而腐烂死亡。据报道,新疆棉田采用三氟啶磺隆定向茎叶喷雾处理,也能有效防除香附子,但遇不良气候条件容易产生药害[76];用氟啶草酮+二甲戊灵于棉花播前土壤封闭处理也能防除棉田三棱草和阔叶草,其中对三棱草防效达54%[77]。目前国内登记用于棉田阔叶草或莎草防除的药剂只有草甘膦和氟啶草酮。使用化学防除需要结合除草剂的特性掌握好使用时期,如香附子地下繁殖器官存在休眠现象,若在休眠期进行化学防除,化学除草剂的有效成分不能转移至地下营养繁殖器官,就没有好的防除效果,导致人力和物力的极大浪费。如草甘膦防治香附子,需要在香附子地上部分生长旺盛期进行,即能灭生又能除根,如未出苗则无效[61]。
4.4.2 熏蒸和化感 早年在蔬菜生产中广泛使用溴化甲烷来防治香附子,但由于环境问题已被禁用[78],现在人们正在寻找对环境友好的可替代溴化甲烷的产品。另外,研究人员已经发现,许多植物和微生物的残留物和提取物对香附子具有化感作用,这些提取物和残留物向土壤中释放了大量的毒素,最终减少了香附子的生长和发育[63,79]。利用化感物质来防控杂草,可以减少除草剂的使用,减缓杂草抗性,对环境友好,在有机农业生产中有一定使用潜力。
4.5 生物防治
使用真菌、细菌、鸟类和昆虫等生物防治方法。研究发现,病原真菌Cercospora caricis很可能对香附子有效[80];真菌Dactylaria higginsii对香附子也有效果,其悬浮液在田间施用3次后,可使香附子干重降低90%[23,81];Puccinia romagnoliana可导致桑园中香附子幼芽迅速死亡,块茎活力和数量显著下降[82]。此外,2种放线菌KA1-4和 KA1-7(鉴定为链霉菌)可以抑制香附子生长[83]。除了真菌还发现Bactra venosana的幼虫对香附子有很好的抑制作用[84],可破坏主根导致植株干燥。生物农药的研发使用受到很多因素限制,如开发成本高、货架期短、运输要求高、病原菌和昆虫使用受限,因此在香附子防治领域,生物防治方面的工作十分有限,还不能依赖生物防治来控制香附子[23]。
4.6 综合防治
香附子是世界上最难防治的杂草之一,在目前还没有特别有效控制手段状态下,需要采用多种防治方法结合的综合治理措施[85]。正确的防治方法是防止新的感染,消耗现有的块茎,减少新块茎的产生。轮作、套作、混作、作物覆盖、耕作、种植竞争作物等方法是香附子治理的常用农业防治和物理防治方法。除草剂与轮作相结合的方式可以减少香附子对作物的侵扰[86]。人工除草和化学除草相结合的方式可以有效减少香附子种群密度[87]。例如在花生田中,播后3 d施用乙氧氟草醚,然后在分别播后15、30 d进行人工除草,可有效降低香附子的密度[88]。此外种植抗除草剂作物和改进除草剂应用技术可以有效控制香附子[86]。人工合成的化学除草剂与具有化感作用的植物提取物结合使用可以提高化感物质的防效,且可以减少人工合成化学除草剂的用量[4]。
为了有效且持久防治香附子,化学除草可以封杀结合,早期使用封闭除草剂封闭处理,出苗后结合草甘膦茎叶处理。化学防除在实际应用中可以采取和农业防治相结合的方式,以达到根除效果,节省人力物力。如对香附子发生集中而又以块茎繁殖为主的地块,其一,可结合耕地或中耕松土时,人工捡拾土中香附子块茎,田间晒干焚烧或作药用,能有效降低块茎基数;其二,棉花播种后采用封闭除草剂土壤处理减少植株出苗,杂草出苗后采用定向茎叶喷雾处理,破坏香附子出苗、生长、繁殖,降低危害;其三,到七八月香附子成株开花结籽期(种子未成熟前),拔除整株或割去地上部分的茎和花序,减少其种子落地,减少其靠种子繁殖而减轻危害;最后在棉花成熟期反复使用草甘膦灭杀香附子地上植株和地下块根。
5 展望
香附子是目前世界上研究最多的杂草,但仍有许多方面的问题需要解决。它的生命周期很复杂,杂草的竞争力、遗传多样性、对极端环境条件的适应机制、除草剂及其施用时机和未来可能的管理方法还需要进一步研究。由于香附子环境适应性极强,具有强大的地下繁殖系统,截至目前仍缺乏有效的防除方法。未来如能采用有效的技术使其地下块茎均匀出芽,将有助于对其进行全面防控[89]。
针对棉田莎草科雜草防除药剂种类单一的局面,应加强高效低毒环境友好的新型除草剂创制,开发不同类型的除草剂品种,筛选内吸传导性好、可有效杀死根系或对根系蔓延具有抑制作用、对作物安全的化学除草剂,还需将不同作用靶标和作用机制的除草剂混用,避免抗药性,改进除草剂的使用技术,更有效地防止香附子的发生,避免香附子的过度危害。同时,结合我国农业生产实际,在化学防治的基础上,可通过了解耕作方式与香附子发生危害的相关性,寻找合适的农业或生态防控措施。
目前针对香附子在不同气候条件下、不同生态区域的生活史和种群变化研究较少,需要加强这种杂草在世界各农业生态区域的生物学特性、繁殖能力、生命周期的研究,找到一个通用的方法来鉴别不同种植地区香附子种类和生命周期的变化,并根据不同生态型之间存在的形态差异和遗传差异,来制定不同的防治策略。
参考文献:
[1]张传伟. 大豆、花生田香附子的发生危害与防治[J]. 农药市场信息,2004(11):37.
[2]Bendixen L E,Nandihalli U B. Worldwide distribution of purple and yellow nutsedge (Cyperus rotundus and C. esculentus)[J]. Weed Technology,1987,1(1):61-65.
[3]Lati R N,Filin S,Eizenberg H. Temperature-and radiation-based models for predicting spatial growth of purple nutsedge (Cyperus rotundus)[J]. Weed Science,2011,59(4):476-482.
[4]Srivastava R K,Singh A,Shukla S V. Chemical investigation and pharmaceutical action of Cyperus rotundus:a review[J]. Journal of Biologically Active Products from Nature,2013,3(3):166-172.
[5]Nishimoto R O Y K. Purple nutsedge tuber sprouting[J]. Weed Biology and Management,2001,1(4):203-208.
[6]Santos B M,Morales-Payan J P,Stall W M,et al. Effects of shading on the growth of nutsedges (Cyperus spp.)[J]. Weed Science,1997,45(5):670-673.
[7]Okoli C A N,Shilling D G,Smith R L,et al. Genetic diversity in purple nutsedge (Cyperus rotundus L.) and yellow nutsedge (Cyperus esculentus L.)[J]. Biological Control,1997,8(2):111-118.
[8]錢益新,聂先雄. 香附子生物学特性研究[C]//面向21世纪的植物保护发展战略:中国植物保护学会第八届全国会员代表大会暨 21 世纪植物保护发展战略学术研讨会论文集. 北京:中国科学技术出版社,2007:965-967.
[9]王 鸿,苏卫华. 香附子生物生态学特性和防除措施研究[J]. 安徽农业科学,1991 (4):371-374.
[10]Hammeron J L. Experiments with Cyperus rotundus L. Ⅲ. Seasonal variations in growth[J]. Weed Research,1975,15(5):339-348.
[11]Brosnan J T,DeFrank J. Purple nutsedge control in turf and ornamentals[J]. College of Tropical Agriculture and Human Resources,University of Hawaii at Manoa,2008:1-4.
[12]Dor E,Hershenhorn J. Effect of low temperature on purple nutsedge (Cyperus rotundus) reproductive biology[J]. Weed Science,2013,61(2):239-243.
[13]Stoller E W,Sweet R D. Biology and life cycle of purple and yellow nutsedges (Cyperus rotundus and C. esculentus)[J]. Weed Technology,1987,1(1):66-73.
[14]Shahida K. Weeds of Pakistan:Cyperaceae[J]. Pakistan Journal of Weed Science Research,2014,20(2):233-263.
[15]Horowitz M. Mechanisms of establishment and spreading of Cyperus rotundus—The worst weed of warm regions[J]. Proc First Int Weed Cont Congr,1992,1:94-97.
[16]Santos B M,Morales-Payan J P,Stall W M,et al. Influence of purple nutsedge (Cyperus rotundus) density and nitrogen rate on radish (Raphanus sativus) yield[J]. Weed Science,1998,46:661-664.
[17]Lawal O A,Oyedeji A O. Chemical composition of the essential oils of Cyperus rotundus L. from South Africa[J]. Molecules,2009,14(8):2909-2917.
[18]Thullen R J,Keeley P E. Seed production and germination in Cyperus esculentus and C. rotundus[J]. Weed Science,1979,27(5):502-505.
[19]Siriwardana G,Nishimoto R K. Propagules of purple nutsedge (Cyperus rotundus) in soil[J]. Weed Technology,1987,1(3):217-220.
[20]Bangarwa S K,Norsworthy J K,Jha P,et al. Purple nutsedge (Cyperus rotundus) management in an organic production system[J]. Weed Science,2008,56(4):606-613.
[21]Gilreath J P,Santos B M. Herbicide dose and incorporation depth in combination with 1,3-dichloropropene plus chloropicrin for Cyperus rotundus control in tomato and pepper[J]. Crop Protection,2004,23(3):205-210.
[22]Wang G,McGiffen Jr M E,Ogbuchiekwe E J. Crop rotation effects on Cyperus rotundus and C. esculentus population dynamics in southern California vegetable production[J]. Weed Research,2008,48(5):420-428.
[23]Kadir J,Charudattan R. Dactylaria higginsii,a fungal bioherbicide agent for purple nutsedge (Cyperus rotundus)[J]. Biological Control,2000,17(2):113-124.
[24]Sparrow D M L . Nutgrass (Cyperus rotundus) and its control[J]. Leaflet Coconut Research Institute Ceylon,1958,4(3):135-145.
[25]Wallace R D,Grey T L,Webster T M,et al. Increased purple nutsedge (Cyperus rotundus) tuber sprouting with diurnally fluctuating temperatures[J]. Weed Science,2013,61(1):126-130.
[26]Iqbal J,Hussain S,Ali A,et al. Biology and management of purple nutsedge (Cyperus rotundus L.)[J]. Journal of Animal & Plant Sciences,2012,22(2):384-389.
[27]Webster T M. High temperatures and durations of exposure reduce nutsedge (Cyperus spp.) tuber viability[J]. Weed Science,2003,51(6):1010-1015.
[28]Travlos I S,Economou G,Kotoulas V E,et al. Potential effects of diurnally alternating temperatures and solarization on purple nutsedge (Cyperus rotundus) tuber sprouting[J]. Journal of Arid Environments,2009,73(1):22-25.
[29]Neeser C,Aguero R,Swanton C J. Survival and dormancy of purple nutsedge (Cyperus rotundus) tubers[J]. Weed Science,1997,45(6):784-790.
[30]Wills G D. Description of purple and yellow nutsedge (Cyperus rotundus and C. esculentus)[J]. Weed Technology,1987,1(1):2-9.
[31]Fuentes R G,Baltazar A M,Merca F E,et al. Morphological and physiological responses of lowland purple nutsedge (Cyperus rotundus L.) to flooding[J]. AoB Plants,2010:1-13.
[32]Pena-Fronteras J T,Villalobos M C,Baltazar A M,et al. Adaptation to flooding in upland and lowland ecotypes of Cyperus rotundus,a troublesome sedge weed of rice:tuber morphology and carbohydrate metabolism[J]. Annals of Botany,2009,103(2):295-302.
[33]Matloob A,Khaliq A,Farooq M,et al. Quantification of allelopathic potential of different crop residues for the purple nutsedge suppression[J]. Pakistan Journal of Weed Science Research,2010,16(1):1-12.
[34]Webster T M,Macdonald G E. A survey of weeds in various crops in Georgia[J]. Weed Technology,2001,15(4):771-790.
[35]Rabbani N,Bajwa R,Javaid A. Interference of five problematic weed species with rice growth and yield[J]. African Journal of Biotechnology,2011,10(10):1854-1862.
[36]Chauhan B S,Opea J. Growth of purple nutsedge (Cyperus rotundus) in response to interference with direct-seeded rice[J]. Weed Technology,2012,26(3):506-509.
[37]Donayre D K M,Martin E C,Casimero M C,et al. Prevalence of lowland ecotype Cyperus rotundus L. and weed management of rice farmers in Aliaga,Nueva Ecija,Philippines[J]. Int J Ecol Conserv,2015,13:14-28.
[38]Roshan L,Srivastava S N L,Chand M. Integrated weed management for sugarcane plant-ratoon cropping system[J]. Indian J Agron,2006,51(4):251-255.
[39]Aitken R L,Munro A J,McGuire P J. SRDC project NFS002—An integrated approach to nutgrass control (SD11002)[R]. 2011.
[40]Chand M,Singh S,Bir D,et al. Halosulfuron methyl:a new post emergence herbicide in India for effective control of Cyperus rotundus in sugarcane and its residual effects on the succeeding crops[J]. Sugar Tech,2014,16(1):67-74.
[41]Tuor F A,Froud-Williams R J. Influence of nitrogen on competition between purple nutsedge,maize and soybean[J]. International Journal of Pest Management,2002,48(1):73-79.
[42]Bryson C T,Carter R. The significance of Cyperaceae as weeds[M]//Sedges:uses,diversity and systematics of the Cyperaceae. St. Louis,MO:Missouri Botanic Garden Press,2008,15-101.
[43]Do gˇan M N,Jabran K,Unay A. Integrated weed management in cotton[M]//Recent advances in weed management. New York:Springer,2014:197-222.
[44]Das T K,Paul A K,Yaduraju N T. Density-effect and economic threshold of purple nutsedge (Cyperus rotundus) in soybean[J]. Journal of Pest Science,2014,87(1):211-220.
[45]Morales-Payan J P,Santos B M,Stall W M,et al. Effects of purple nutsedge (Cyperus rotundus) on tomato (Lycopersicon esculentum) and bell pepper (Capsicum annuum) vegetative growth and fruit yield[J]. Weed Technology,1997,11:672-676.
[46]Morales-Payan J P,Stall W M,Shilling D G,et al. Above-and belowground interference of purple and yellow nutsedge (Cyperus spp.) with tomato[J]. Weed Science,2003,51(2):181-185.
[47]Santos B M,Gilreath J P,Esmel C E,et al. Effects of yellow and purple nutsedge time of establishment on their distance of influence on bell pepper[J]. Hort Technology,2007,17(3):305-307.
[48]Geretharan T,Sangakkara U R,Arulnandhy V. Competitive performance of purple nutsedge (Cyperus rotundus L.) and onion (Allium cepa L.) as affected by different sources of nitrogen[J]. 2012,23(4):290-299.
[49]Charles G W. A grower survey of weeds and herbicide use in the New South Wales cotton industry[J]. Australian Journal of Experimental Agriculture,1991,31(3):387-392.
[50]黄红娟,张朝贤,姜翠兰,等. 北疆棉田杂草多样性及群落组成[J]. 杂草学报,2020,38(1):7-13.
[51]Ameena M,Geethakumari V L,George S. Allelopathic influence of purple nutsedge (Cyperus rotundus L.) root exudates on germination and growth of important field crops[J]. International Journal of Agricultural Sciences,2014,10(1):186-189.
[52]Dadar A,Asgharzade A,Nazari M. Determination of allelopathic effect of purple nutsedge (Cyperus rotundus L.) on germination and initial development of tomato (Lycopersicum esculentum)[J]. Indian Journal of Fundamental and Applied Life Sciences,2014,4(2):576-580.
[53]Kavitha D. Allelopathic potential of Cyperus rotundus L. and Cynodan dactylon L. on germination and growth responses of some rice cultivars [J]. Kongunadu Research Journal,2015,2(2):118-122.
[54]Ameena M,Geethakumari V L,George S. Allelopathic effects of root exudates of purple nutsedge (Cyperus rotundus L.) on growth of field crops[J]. J Crop Weed,2015,11:142-145.
[55]Khan R,Khan I A. Varietal response of chickpea (Cicer arietinum L.) towards the allelopathy of different weeds[J]. Sains Malaysiana,2015,44(1):25-30.
[56]Singh N B,Pandey B N,Singh A. Allelopathic effects of Cyperus rotundus extract in vitro and ex vitro on banana[J]. Acta Physiologiae Plantarum,2009,31(3):633-638.
[57]Sharma R,Gupta R. Cyperus rotundus extract inhibits acetylcholinesterase activity from animal and plants as well as inhibits germination and seedling growth in wheat and tomato[J]. Life Sciences,2007,80:2389-2392.
[58]Schroeder J,Thomas S H,Murray L. Yellow and purple nutsedge and chile peppers host southern root-knot nematode[J]. Weed Science,1993,41(1):150-156.
[59]劉 洋. 恶性杂草香附子的发生和防治[J]. 农药市场信息,2014(18):44-46.
[60]陈秀双. 棉花田化学除草技术[J]. 湖北植保,2002(5):6-7.
[61]尚成名. 香附子的发生与防治[J]. 安徽农学通报,2006,12(9):79.
[62]Munsif F,Ali K,Khalid S,et al. Influence of row spacing on weed density,biomass and yield of chip bud settling of sugarcane[J]. Pak J Weed Sci Res,2015,21(1):137-144.
[63]Zanuncio A,TeoDoro P E,Ribeiro L P,et al. Allelopathy of green manures on Cyperus rotundus[J]. Revista de Ciências Agrárias,2013,36(4):441-446.
[64]Iqbal J,Cheema Z A,An M. Intercropping of field crops in cotton for the management of purple nutsedge (Cyperus rotundus L.)[J]. Plant and Soil,2007,300(1/2):163-171.
[65]Summerlin Jr J R,Coble H D,Yelverton F H. Effect of mowing on perennial sedges[J]. Weed Science,2000,48(4):501-507.
[66]Hershenhorn J,Zion B,Smirnov E,et al. Cyperus rotundus control using a mechanical digger and solar radiation[J]. Weed Research,2015,55(1):42-50.
[67]Wang G,McGiffen Jr M E,Ogbuchiekwe E J,et al. Economic return of purple and yellow nutsedge management in vegetable production of southern California[J]. Crop Protection,2009,28(4):319-326.
[68]Akbar N,Jabran K,Ali M A. Weed management improves yield and quality of direct seeded rice[J]. Australian Journal of Crop Science,2011,5(6):688.
[69]Mahmood A,Cheema Z A. Influence of sorghum mulch on purple nutsedge (Cyperus rotundus L.)[J]. Int J Agric Biol,2004,6(1):86-88.
[70]Webster T M. Mulch type affects growth and tuber production of yellow nutsedge (Cyperus esculentus) and purple nutsedge (Cyperus rotundus)[J]. Weed Science,2005,53(6):834-838.
[71]Devendra R,Manjunatha S B,Kumar N N,et al. Lethal soil temperature under plastic mulch on growth and suppression of nutgrass[J]. Indian Journal of Weed Science,2015,47(2):183-187.
[72]马永林,覃建林,马跃峰,等. 14种磺酰脲类除草剂对蔗田香附子的防效及安全性评价[J]. 西南农业学报,2014,27(6):2419-2422.
[73]覃建林,龙丽萍,梁卫忠. 13种除草剂对甘蔗田恶性杂草香附子的防除效果试验及评价[J]. 广西农业科学,2005,36(4):359-362.
[74]Charles G W. Nutgrass (Cyperus rotundus L.) control in cotton (Gossypium hirsutum L.)[J]. Australian Journal of Experimental Agriculture,1995,35(5):633-639.
[75]Edenfield M W,Brecke B J,Colvin D L,et al. Purple nutsedge (Cyperus rotundus) control with glyphosate in soybean and cotton[J]. Weed Technology,2005,19(4):947-953.
[76]馬 艳,彭 军,马小艳,等. 75%三氟啶磺隆钠盐WG对棉田杂草的防除效果[J]. 中国棉花,2010,37(1):20-21.
[77]程 萍,王映山,何卫疆. 播前封闭防除棉田三棱草试验[J]. 农村科技,2020(2):37-38.
[78]Bangarwa S K,Norsworthy J K,Gbur E E,et al. Phenyl isothiocyanate performance on purple nutsedge under virtually impermeable film mulch[J]. HortTechnology,2010,20(2):402-408.
[79]Messiha N K,Ahmed S A,El-Rokiek K G,et al. The physiological influence of allelochemicals in two Brassicaceae plant seeds on the growth and propagative capacity of Cyperus rotundus and Zea mays L.[J]. World Applied Sciences Journal,2013,26(9):1142-1149.
[80]Aly R,Halpern N,Rubin B,et al. Biolistic transformation of Cercospora caricis a specific pathogenic fungus of Cyperus rotundus[J]. Mycological Research,2001,105(2):150-152.
[81]Yandoc C B,Rosskopf E N,Pitelli R,et al. Effect of selected pesticides on conidial germination and mycelial growth of Dactylaria higginsii,a potential bioherbicide for purple nutsedge (Cyperus rotundus)[J]. Weed Technology,2006,20(1):255-260.
[82]Gupta V P,Kumar V,Mishra R K,et al. Puccinia romagnoliana Marie & Sacc.—A potential bioherbicide agent for biocontrol of purple nutsedge (Cyperus rotundus L.) in mulberry[J]. Journal of Phytopathology,2002,150(4/5):263-270.
[83]Dhanasekaran D,Ambika K,Thajuddin N,et al. Allelopathic effect of actinobacterial isolates against selected weeds[J]. Archives of Phytopathology and Plant Protection,2012,45(5):505-521.
[84]Efil F,Levent E,Erol A,et al. The determination of infestation of Bactra venosana (Zeller,1847)(Lep.;Tortricidae) on Cyperus rotundus L. in Adana and Osmaniye Proviences[J]. Karadeniz Fen Bilimleri Dergisi,2012,3(2):39-46.
[85]Bryson C T,Reddy K N,Molin W T. Purple nutsedge (Cyperus rotundus) population dynamics in narrow row transgenic cotton (Gossypium hirsutum) and soybean (Glycine max) rotation[J]. Weed Technology,2003,17(4):805-810.
[86]Norsworthy J H,Schroeder J,Thomas S H,et al. Purple nutsedge (Cyperus rotundus) management in direct-seeded chile pepper using halosulfuron and cultivation[J]. Weed Technology,2007,21(3):636-641.
[87]Usman K,Khan N,Khan M U,et al. Impact of tillage and herbicides on weed density,yield and quality of cotton in wheat based cropping system[J]. Journal of Integrative Agriculture,2013,12(9):1568-1579.
[88]Kalaichelvi K,Sakthivel S,Balakrishnan A. Integrated weed management in groundnut[J]. Indian Journal of Weed Science,2015,47(2):174-177.
[89]Peerzada A M. Biology,agricultural impact,and management of Cyperus rotundus L.:the worlds most tenacious weed[J]. Acta Physiologiae Plantarum,2017,39(12):270.
