烟草茎点病菌生物学特性及室内毒力测定
2021-08-06商胜华江艳桑维钧张开虹杨茂发
商胜华 江艳 桑维钧 张开虹 杨茂发

摘 要:为明确烟草茎点病菌广生茎点霉Phoma omnivirens的最佳培养条件并筛选出有效的防治药剂,为生产实践中防治烟草茎点病提供理论依据。以病原菌P.omnivirens为试材,采用菌丝生长速率法,研究了病原菌P.omnivirens的生物学特性,并测定了12种供试杀菌剂对病原菌的抑制效果。病原菌P.omnivirens的最适培养基为牛肉膏蛋白胨培养基、燕麦培养基和马铃薯培养基;菌丝在5~30 ℃范围内均可生长,最适温度为30 ℃,5 ℃时菌丝生长最慢;PDA培养基pH为10时菌丝生长最快;光照对菌丝生长无显著影响;最佳碳源为蔗糖,最佳氮源为硝酸钾和硝酸钙;菌丝的致死温度为58 ℃ 10 min。12种杀菌剂中,3%中生菌素WP具有最佳抑菌效果,EC50最小,为0.9419 mg/L;其次是EC50为2.6940 mg/L的0.3%梧宁霉素AS和EC50为2.7917 mg/L的80%代森锰锌WP。生产上可将这3种药剂作为防治烟草茎点病的备选药剂。
关键词:烟草茎点病;广生茎点霉;生物学特性;毒力测定
中图分类号:S432.1
文献标识码:A
文章编号:1008-0457(2021)02-0001-08
国际DOI编码:10.15958/j.cnki.sdnyswxb.2021.02.001
Abstract:In order to provide theoretical basis for prevention and control of tobacco black spot stalk,this study explored the biological characteristics of Phoma omnivirens and tested its virulence determination.The biological characteristics of P.omnivirens was analyzed by hypha growth rate method,and the effect of twelve fungicides on the pathogen were also determined.The results showed that Nutrient Agar(NA),Oatmeal Agar(OMA) and Potato Dextrose Agar(PDA) were the most suitable culture medium for the growth of P.omnivirens.The mycelium could grow in the temperatures ranging from 5 ℃ to 30 ℃,30 ℃ was the optimum temperature for mycelium growth,and the mycelium grew the slowest at 5 ℃.The mycelium grew fastest at pH 10 in PDA.Different light conditions did not significantly influence the growth of mycelium.The optimal carbon source for the medium were sucrose,and the best nitrogen sources were potassium nitrate and calcium nitrate,respectively.The lethal temperatures of mycelium was 58 ℃ for 10 min.Among the 12 fungicides,3% Zhongshengmycin had the best inhibitory effect with the lowest EC50 of 0.9419 mg/L;followed by 0.3% Tetramycin and 80% Mancozeb,with EC50 of 2.6940 mg/L and 2.7917 mg/L,respectively.These three fungicides can be used to control tobacco black spot stalk in the field.
Keywords:tobacco black spot stalk;Phoma omnivirens;biological characteristics;virulence determination
17世纪初叶,烟草开始传入我国[1-2],成为我国重要的经济作物之一,在我国的经济发展上起到了极大的促进作用。但烟草病害的发生制约了烟叶产量的提高,使烟农收入受到严重影响。截止2002年,已报道116种烟草病害,其中79种为侵染性病害,37种为非侵染性病害[3-4]。烟草茎点病是一种偶发性的真菌性病害,可危害黄花烟和普通烟,田间大多于成株期危害烟株茎基部,使养分和水分的疏导受阻,叶片早衰,严重时茎秆和叶片枯死,造成烟叶产量下降、品质降低[5]。研究烟草茎点病菌的生物学特性、筛选高效抑制病原菌生长的杀菌剂对了解烟草茎点病的发生规律和生产上有效防治该病害具有重要意义。于莉等[6]最早在吉林省发现烟草茎点病,并将烟草茎点病病原鉴定为半知菌亚门Deuteromycotina,球壳孢目Sphaeropsidales,球殼孢科Sphaeropsidaceae,茎点霉属Phoma,Phoma tabaci Em.Sousa da Camara。此后,该病害也仅在吉林[7-8]、陕西[9]和河南[10]三省有过报道,但均未开展深入研究。直至2018年,江艳等[11]在贵州省再次发现了烟草茎点病,并根据形态学特征和分子生物学技术将病原菌鉴定为广生茎点霉Phoma omnivirens,致病性测定结果表明该病原菌可侵染烟株的叶片和茎秆。目前,还未见关于烟草茎点病病原菌生物学特性研究和防治该病害的相关报道。鉴于此,本研究采用菌丝生长速率法对烟草茎点病菌P.omnivirens的生物学特性及室内毒力测定进行研究。以期能明确最适宜P.omnivirens生长的条件,同时筛选出高效抑制其生长的杀菌剂,为田间防治该病害提供参考。
1 材料与方法
1.1 试验材料
供试菌株:研究所用菌株为广生茎点霉P.omnivirens,采集于贵州省贵安新区具有典型发病症状的烟草茎点病病株,经分离、鉴定及致病性测定的病原菌菌株,现保存于贵州大学农学院植物病理教研室,菌株编号为HGUP8001。
供试药剂:3%中生菌素WP,福建凯立生物制品有限公司;0.3%梧宁霉素AS,辽宁微科生物工程股份有限公司;80%代森锰锌WP,四川国光农业股份有限公司;20%苯醚甲环唑EW,青岛瀚生生物科技股份有限公司;40%丙环唑ME,青岛瀚生生物科技股份有限公司;70%甲基硫菌灵WP,江苏龙灯化学有限公司;50%福美双WP,河北赞峰生物工程有限公司;12.5%腈菌唑EW,青岛瀚生生物科技股份有限公司;8%宁南霉素AS,德强生物股份有限公司;80%乙蒜素EC,河南科邦化工有限公司;8×108個/g蜡质芽孢杆菌WP,山东泰诺药业有限公司。
1.2 试验方法
1.2.1 病原菌的生物学特性研究
培养基对菌丝生长的影响:参照方中达[12]的方法配置以下培养基:牛肉膏蛋白胨培养基(NA)、燕麦琼脂培养基(OMA)、马铃薯琼脂培养基(PDA)、玉米粉琼脂培养基(CMA)、查氏培养基(Czapek)、胡萝卜琼脂培养基(CDA)、麦芽汁琼脂培养基(MEA),pH为配制培养基时的自然值。供试菌株接于PDA平板, 25 ℃黑暗恒温培养5 d,用打孔器沿菌落边缘打孔,取打下的菌饼接于供试培养基平板中央,菌丝面朝下,每处理3个重复,置于25 ℃黑暗恒温的同一培养箱中培养,每天观察菌落情况,5 d后测量菌落直径。该研究中接种的所有菌饼打取方法及接种方法如上,培养皿直径均为90 mm,菌落直径均使用十字交叉法测量。
温度对菌丝生长的影响:将5 mm菌饼接种于PDA平板中央,分别置于5、10、15、20、25、30、35、40、45、50 ℃的培养箱中恒温黑暗培养,每处理3个重复,每日观察,5 d后测量菌落直径,培养基pH为配制时的自然值。
pH值对菌丝生长的影响:用1 mol/L的稀盐酸和1 mol/L的氢氧化钠溶液将PDA培养基的pH值调为4、5、6、7、8、9、10、11,平板中央接入直径5 mm的菌饼,每处理3个重复,25 ℃恒温黑暗的同一培养箱中培养,每日观察,5 d后测量菌落直径。
光照条件对菌丝生长的影响:在PDA平板上接入直径5 mm的菌饼,培养基pH为配制时的自然值,分别置不同光照(连续光照、24 h光暗交替和连续黑暗)条件下25 ℃恒温培养,每处理3个重复,每日观察,5 d后测量菌落直径。
菌丝致死温度:在每支试管中装入5 mL无菌水,并接入3个直径为5 mm的菌饼,分别置于40、45、50、55、60、65、70 ℃的水浴锅中恒温水浴10 min,取出流水冷却,将各处理的菌饼接于PDA平板,培养基pH为配制时的自然值,每平板1个菌饼,置于25 ℃恒温黑暗的同一培养箱中培养,每日观察,5 d后根据各处理能否长出菌丝确定致死区间,能长出菌丝的最高温度为致死区间下限,无菌丝长出的最低温度为致死区间上限;区间内以1 ℃为一个梯度,每温度为一个处理,根据各处理能否长出菌丝确定致死温度,即不长菌丝的最低温度为菌丝致死温度。
碳、氮源对菌丝生长的影响:以等量的麦芽糖、葡萄糖、甘露醇、乳糖、淀粉、果糖、肌醇代替查氏培养基中的蔗糖,同时蔗糖为碳源作为对照;以等量L-苯丙氨酸、氨基乙酸、草酸铵、L-精氨酸、L-谷氨酸、硝酸钾、硝酸钙、硫酸铵代替查氏培养基中的硝酸钠,硝酸钠为氮源作为对照,制成不同碳、氮源的培养基平板,接入直径5 mm的菌饼,培养基pH均为配制时的自然值,25 ℃恒温黑暗的同一培养箱中培养,每日观察,5 d后测量菌落直径。
1.2.2 室内毒力测定
采用菌丝生长速率法[13],测定各供试杀菌剂对病原菌P.omnivirens的抑制作用,供试药剂剂型及生产厂家见1.1。参照高亚星等[14]配制不同浓度梯度农药的方法,将供试药剂用无菌水配制成各药剂所需的浓度梯度的10倍,然后按9∶1 的比例将PDA培养基与所配药剂混合,制成各浓度梯度的含药平板,以加等量无菌水的培养基平板为对照,每处理3个重复,各平板接入直径为5 mm的菌饼,25 ℃黑暗条件恒温培养,每日观察,7 d后十字交叉法测量菌落直径,并根据抑制率公式[15]计算各处理抑制率。
抑制率(%)=[(对照菌落直径-菌饼直径)-(处理菌落直径-菌饼直径)]/(对照菌落直径-菌饼直径)×100
1.3 数据统计与分析
研究数据用Excel 2016进行统计和生长速率计算,采用DPS 7.05的Duncan氏新复极差法进行差异显著性分析,采用Graphpad prism 7.0绘制柱形图,用农药室内试验数据处理系统软件[16]计算毒力回归方程Y=A+B*X,抑制中浓度EC50和相关系数 R,X为药剂浓度的对数值,Y为菌丝体抑制百分率的机率值。
2 结果与分析
2.1 病原的生物学特性
2.1.1 不同培养基对菌丝生长的影响
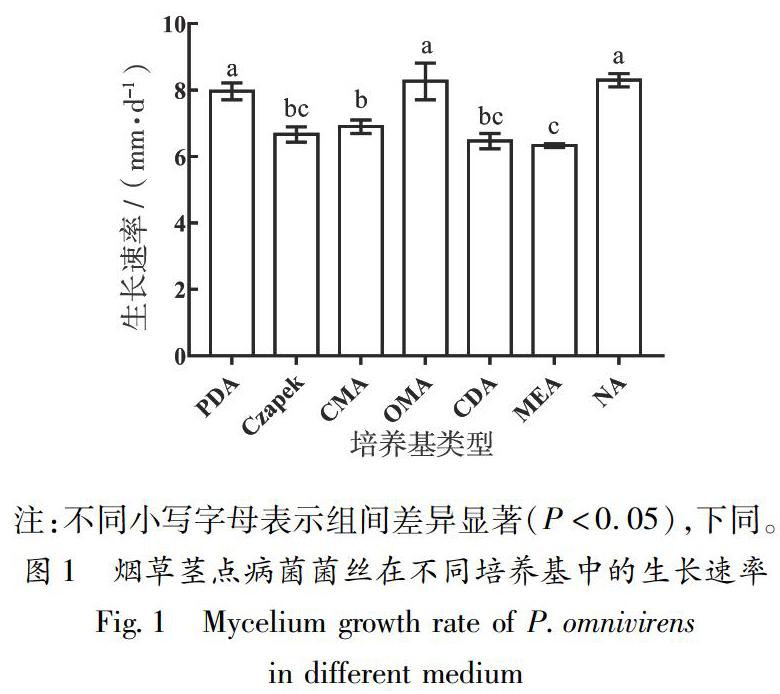
烟草茎点病菌在不同培养基中的生长速率如图1所示,在供试的7种培养基上均能生长,最利于烟草茎点病菌生长的培养基是PDA、OMA和NA,菌丝生长最快,与其他培养基上的菌丝生长速率差异显著,其次是CMA、Czapek、CDA,而在MEA培养基上生长最慢,生长速率最小。
2.1.2 温度对菌丝生长的影响
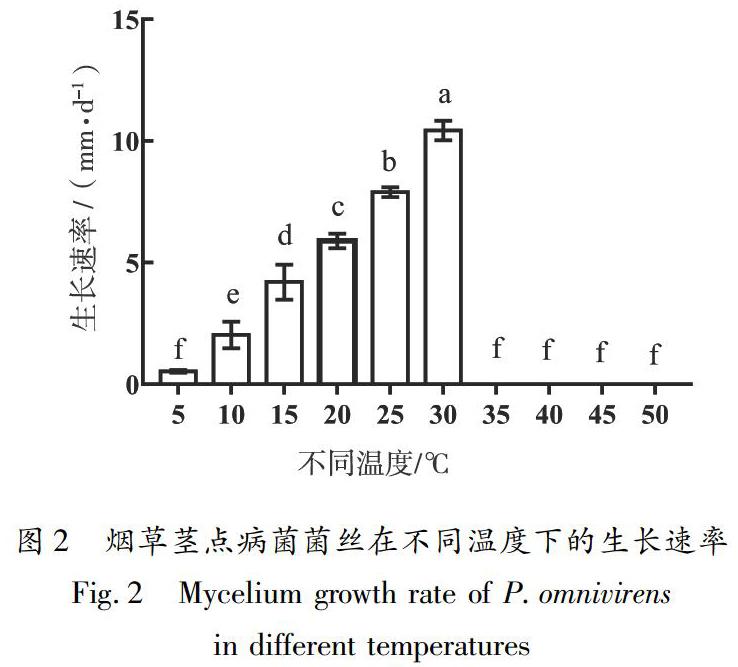
如图2所示,P.omnivirens在5~30 ℃条件下均能生长,且随着温度的升高生长越快,各处理的菌丝生长速率差异显著。5 ℃时菌丝生长缓慢,仅长出少许稀薄的菌丝,30 ℃时菌丝生长最快且浓密,35 ℃及以上温度时菌丝停止生长。
2.1.3 pH对菌丝生长的影响
如图3所示,P.omnivirens对pH有较强的适应性,在pH 4~11范围内均可生长,在pH 4~10范围内生长速率呈上升趋势,pH 5~9之间各处理菌丝生长速率差异不显著,pH达到11时其生长速率减慢,由此可知P.omnivirens既能适应酸性环境,也能适应碱性环境,最适生长pH为10。
2.1.4 光照对菌丝生长的影响
由图4可以看出,P.omnivirens菌丝在3种光照条件(连续光照、24 h光暗交替和连续黑暗)下生长速率差异不显著,说明光照条件的变化对P.omnivirens菌丝的生长速率影响不显著,但菌丝颜色会随着黑暗时间的增长而加深。
2.1.5 菌丝的致死温度
P.omnivirens在各预设温度条件下水浴10 min后,小于等于55 ℃时菌丝均可生长,大于等于60 ℃时菌丝不生长,说明菌丝的致死区间为55~60 ℃;再此区间内进一步的试验结果显示,58 ℃及以上温度水浴10 min后菌丝均不生长,说明菌丝的致死温度为58 ℃ 10min。
2.1.6 不同碳、氮源对菌丝生长的影响
研究结果表明,7种碳源对菌丝生长速率的影响存在差异(图5),以蔗糖为碳源的查氏培养基菌丝生长最快,肌醇为碳源时,菌丝生长最慢,因此,蔗糖为最佳碳源。由图6可知,P.omnivirens在9种氮源的查氏培养基中生长速率差异显著,以硝酸钾和硝酸钙为氮源的培养基菌丝生长最快,其次是L-精氨酸和硝酸钠,以硫酸铵为氮源的培养基菌丝生长最慢,因此硝酸钾和硝酸钙为最佳氮源。
2.2 室内毒力测定
研究结果表明(表1),12种杀菌剂在对应的浓度梯度范围内均对烟草茎点病菌有较好的抑菌作用,且抑制率与供试药剂浓度呈正相关。80%代森錳锌WP和50%福美双WP在使用浓度分别为16 mg/L和500 mg/L时抑制率均大于90%。3%中生菌素WP、0.3%梧宁霉素AS和20%苯醚甲环唑EW随浓度的增加抑制率均达85.97%~89.03%,其余药剂随浓度的增加抑制率也在63.5%~79.5%之间。
12种杀菌剂中,3%中生菌素WP的EC50最小,为0.9419 mg/L;其次是0.3%梧宁霉素AS和80%代森锰锌WP,EC50值分别为2.6940 mg/L和2.7917 mg/L。40%丙环唑ME和20%苯醚甲环唑EW的EC50值也小于20 mg/L。抑制中浓度EC50是杀菌剂毒力的可靠标准,EC50越小,说明其抑菌效果越好[17]。因此,在12种杀菌剂中,3%中生菌素WP对烟草病菌的抑制效果最好,0.3%梧宁霉素AS和80%代森锰锌WP次之。
3 结论与讨论
病原菌的生物学特性是监控病害发生的前提条件[18-19],但目前未见P.omnivirens的生物学特性研究的相关报道。本研究结果表明,烟草茎点病菌P.omnivirens对不同培养基、温度、pH、碳氮源具有不同程度的适应性,对不同光照条件的选择无显著差异;最适培养基为牛肉膏蛋白胨培养基、燕麦培养基和马铃薯培养基,3种培养基中,以马铃薯培养基配制最为简单、廉价,且在微生物相关研究中使用频率高,因此本文其他部分的研究均使用该培养基作为供试培养基;最适生长温度为30 ℃,35 ℃及以上时,菌丝停止生长,这与李海洋等[20]对同属P.dictamnicol生物学特性的研究结果一致,说明该菌在高温条件下不易存活,这或许是烟草茎点病目前尚未大面积发生的原因之一;菌丝在pH为4~11之间均可生长,pH为10时菌丝生长速率最大;最佳碳源为蔗糖,最佳氮源为硝酸钾和硝酸钙,菌丝致死温度为58 ℃ 10 min;不同光照条件下菌丝的生长速率无显著差异。
Phoma是一个广泛分布的属,在该属已报道的3000种中有110种为病原菌,常引起植物叶片枯萎、根部腐烂甚至整株植株萎蔫[21]。本研究对烟草茎点病菌P.omnivirens的生物学特性的研究结果不仅有助于了解烟草茎点病的发生和病害循环,为防治该病害奠定基础,也可为P.omnivirens引起的其他病害及同属病原菌的相关研究提供参考。
目前,生产上的农作物病虫害防治主要还是依靠化学农药,但随着人们对环境和食品安全要求的提高,生物农药也逐渐得到关注。本文采用菌丝生长速率法测定 12 种杀菌剂(7种化学杀菌剂和5种生物农药)对烟草茎点病菌P.omnivirens的室内毒力,结果显示生物农药3%中生菌素WP和0.3%梧宁霉素AS对菌丝的抑制效果最好,EC50分别为0.9419 mg/L和2.6940 mg/L,生产上也将这两种生物农药用于防治其他病害[22-23],可将其作为田间防治烟草茎点病的选用药剂。同时,化学杀菌剂50%代森锰锌WP也对烟草茎点病菌表现出较好的抑制效果,其EC50为2.7917 mg/L,也可作为生产上防治烟草茎点病的备选药剂。但该研究选用的杀菌剂仅在室内进行试验,具有一定的局限性。田间防治效果还与病原菌的孢子[24]、杀菌剂的特性[25]以及寄主植物的生长环境等[26]有关,后续还需进一步的田间防治试验进行验证。另外,针对不同地区的烟草茎点病,其病原菌菌株不同,生物学特性和防治药剂是否一样还需进一步探究。
参 考 文 献:
[1] 陈重明,陈迎晖.烟草的历史[J].中国野生植物资源,2001,20(5):30-33.
[2] 任民,王志德,牟建民,等.我国烟草种质资源的种类与分布概况[J].中国烟草科学,2009,30(S):8-14.
[3] 朱贤朝,王彦亭,王智发.中国烟草病害[M].北京:中国农业出版社,2002:3-4.
[4] NYVALL R F.Field crop disease handbook[M].New York:van nostrand reinhold,1989:661-707.
[5] 蒋士君,吴元华.烟草病理学[M].北京:中国农业出版社,2013(2):175-176.
[6] 于莉,华致甫,李玉.烟草上的一种新病害—烟草茎点病[J].吉林农业大学学报,1993(1):97-107.
[7] 陈瑞泰,朱贤朝,王智发,等.全国16个主产烟省(区)烟草侵染性病害调研报告[J].中国烟草科学,1997,18(4):1-7.
[8] 高崇,高玉亮,吴国贺,等.吉林省烟草有害生物种类及分布况调查[J].黑龙江农业科学,2016(11):77-81.
[9] 田佳,安德荣,雷超,等.陕西烟田病害种类调查[J].中国烟草科学,2016(5):57-62.
[10] 苗圃.河南省烟草真菌性根茎病害鉴定及黑胫病菌生理小种鉴定[D].洛阳:河南科技大学,2013.
[11] 江艳,桑维钧,曾尔玲,等.烟草茎点病在贵州省的发生及病原鉴定[J].江苏农业科学,2018,46(10):92-95.
[12] 方中达.植病研究方法[M].北京:中国农业出版社,1998(3):46-50.
[13] 慕立义.植物化学保护研究方法[M].北京:中国农业出版社,1994:76-81.
[14] 高亚星,彭丽娟,蒋选利.8 种药剂对烟草黑胫病菌室内毒力测定[J].山地农业生物学报,2016,35(6):31-34,39.
[15] 孙广宇,宗兆锋.植物病理学实验技术[M].北京:中国农业出版社,2002:94-106,139-146.
[16] 司升云,蔡定军,吴仁峰,等.农药室内生物测定数据处理系统[CP/DK].武汉市蔬菜科学研究所,2006.
[17] 李海薇,侯仙,王梦瑶,等.海岛棉枯萎病病原菌分离及室内药剂筛选[J].中国农学通报,2019,35(9):68-74.
[18] 余贤美,侯长明,王洁,等.柿树炭疽病菌的生物学特性及其抑菌药剂筛选[J].中国南方果树,2018,47(2):114-119.
[19] 郑肖兰,贺春萍,高亚男,等.咖啡炭疽病菌生物学特性及其毒力测定[J].热带农业科学,2015,35(12):94-98.
[20] 李海洋,魏春艳,刘丽玲,等.白藓茎点霉叶斑病菌的生物学特性及药剂敏感性[J].吉林农业大学学报,2017,39(3):281-286.
[21] DEBASISH D,AHAMED K,NRISINGHA D.Phoma diseases:Epidemiology and control[J].Plant Pathology,2020,69(7):1203-1217.
[22] 周开拓,蒋承耿,王秋萍,等.中生菌素对贵州烟区烟草青枯病的毒力测定及田间防效试验[J].农业科技与装备,2017(11):14-16.
[23] 杨霞,吴跃开,付莉,等.不同生物农药和化学农药对核桃枝枯病的防治试验[J].农药,2017,56(8):609-612.
[24] 宋慧云,段志豪,张伟豪,等.宫粉羊蹄甲炭疽病病原鉴定及其药剂筛选[J].南方农业学报,2018,49(10):1975-1981.
[25] 单体江,宋慧云,段志豪,等.短萼仪花炭疽病病原鉴定及其药剂筛选[J].中国植保导刊,2019,39(2):5-11.
[26] 楊友联,刘永翔,刘作易.水果采后炭疽病病原鉴定[J].西南农业学报,2014,27(3):1114-1123.
