内镜切除治疗食管神经鞘瘤的效果*
2021-08-06姜经伟孙琦倪牧含许真真曹守莉凌亭生王雷邹晓平吕瑛徐桂芳
姜经伟,孙琦,倪牧含,许真真,曹守莉,凌亭生,王雷,邹晓平,吕瑛,徐桂芳
(南京大学医学院附属鼓楼医院1.消化科;2.病理科,江苏南京210008)
食管上皮下肿瘤大多为食管平滑肌瘤和间质瘤,而食管神经鞘瘤极为罕见,文献[1]报道的病例不到20例。食管神经鞘瘤是起源于食管神经丛Schwann细胞的间叶源性肿瘤,多发于胸中、上段食管[2],其生长缓慢,临床表现、内镜下特征、CT 和MRI 等影像学特征与其他食管黏膜下肿瘤相比无特殊,主要通过超声内镜引导下细针穿刺吸取活检术(endoscopic ultrasonography guided fine-needle aspiration, EUSFNA)或手术切除标本的病理和免疫组化来诊断[1,3]。大部分食管神经鞘瘤为良性肿瘤,也有文献[4]报道了食管神经鞘瘤的恶性病变。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)和内镜经黏膜下隧道肿瘤切除术 (submucosal tunneling endoscopic resection,STER)已成功用于切除食管黏膜下肿瘤[5-6]。张其德等[7]和维妮热·阿布都外力等[8]报道,STER 或ESD 可用于治疗源自黏膜肌层或固有肌层的食管神经鞘瘤。本研究分析了食管神经鞘瘤的临床特征、病理特点、术后并发症和内镜下表现,旨在探讨内镜下切除食管神经鞘瘤的效果,以期为临床诊疗提供参考。
1 资料和方法
1.1 一般资料
回顾性分析2007年8月-2019年7月在南京大学医学院附属鼓楼医院确诊的11 例食管神经鞘瘤患者的临床特征、内镜下表现、术后并发症和病理特点。根据内镜治疗方式分为ESD 和STER 两组。11 例患者中,男6 例(54.5%),女5 例(45.5%),年龄40~81 岁,平均(57.5±12.4)岁,肿瘤直径0.3~5.0 cm,平均(2.5±1.8)cm;6 例(54.5%)有进食梗阻感,3 例(27.3%)有上腹不适,2 例(18.2%)无明显症状。1例患者有吸烟史,所有患者均无饮酒史、肿瘤史及家族史;患者血常规、肝肾功能和肿瘤标志物(CA125、CA72-4、CA19-9、癌胚抗原及甲胎蛋白)等指标均无明显异常。所有患者治疗前均签署知情同意书。
1.2 器械
超声探头:UM-DP20-25R(Olympus,日本)、GF-UE260-AL5(Olympus,日本);Dual 刀(型号:KD-650L;生产厂家:Olympus,日本);止血钳(型号:FD-410LR;生产厂家:Olympus,日本)。
1.3 检查方法
超声内镜(endoscopic ultrasonography,EUS):由熟练的内镜医师在术前根据病灶的形态(巴黎分类法[9])来评判病灶的起源、位置和深度,食管神经鞘瘤的回声类型可分成高、低及混合型回声,每种回声类型可均匀或不均匀。记录肿瘤的深度和大小,以EUS图像上肿瘤最长轴为病变最大直径。
1.4 治疗方法
由经验丰富的内镜医师采用标准化方案进行内镜下切除。
1.4.1 ESD麻醉后,在内镜下发现肿瘤。先用Dual刀在距离病灶0.5 cm处做标记,再将含肾上腺素和亚甲蓝的0.9%氯化钠溶液注入黏膜下层,使食管肿瘤与周围组织分离;用止血钳将切除区域可见的出血血管凝固,金属夹闭合创口[10],对于不能夹闭的大创口,用金属夹辅助荷包线缝合,使创口完全闭合[11]。
1.4.2 STER内镜下透明帽辅助以发现肿瘤。退镜到距离肿瘤口侧3.0~5.0 cm 处,在此处的食管黏膜上做一切口。将含靛胭脂和肾上腺素的0.9%氯化钠溶液注入黏膜下层后,抬举征良好,再用勾刀切开黏膜层1.5~2.0 cm,选择横切口,将黏膜下层的组织初步分割开,用勾刀将黏膜下层以及肌层组织逐层分离,在黏膜下层和肌层之间建立纵向隧道。看到肿瘤后,在肿瘤周边进行分离,明确其来源,并保留完整的肿瘤包膜,完全剥离肿瘤,尽可能防止对食管黏膜造成损伤。肿瘤切除后,对创口进行止血,再将内镜从隧道中撤出,使用钛夹完全缝合黏膜切口[12]。切除病灶后,内镜下未见病灶残余的为完整切除,显微镜下达到完全切除的为R0 切除,显微镜下肿瘤残留的为R1切除。
1.5 术后处理
予以禁食、补充液体和抑酸护胃等治疗。术中发生穿孔等情况的患者,术后行胃肠减压及抗感染等处理,若病情稳定,于术后24 h 进食流食。每位患者在术后3、6 和12 个月复查内镜,随后每年复查1次。
1.6 术后病理
使用10%中性福尔马林对标本进行固定后,用石蜡包埋,再切片并进行苏木精-伊红染色(hematoxylin and eosin staining,HE)。每个病例由两位经验丰富的病理学专家进行独立评估。免疫组化染色检查包括:S100 (Dako,Carpinteria,Calif)、CD34 (Beckman Coulter,Inc,Miami,Fla)、CD117(Dako)、Smooth muscle actin (Dako)、 Desmin (Dako) 和Ki-67(Dako),设置阳性和阴性对照。
2 结果
2.1 内镜下特征
食管神经鞘瘤多发于胸上段(45.5%,5/11),其次是胸中段(27.3%,3/11)。11例(100.0%)病灶在白光内镜下均为隆起型(0~Ⅰ,图1A),表面黏膜均正常,无溃疡;周围黏膜中,仅1例(9.1%)伴黏膜桥;1例(9.1%)出现滑动。经EUS检查发现,食管神经鞘瘤表现出特征性回声,低回声瘤体内部可见片状不均匀的高回声。10例(90.9%)起源于固有肌层(图1B),1 例(9.1%)起源于黏膜下层,肿瘤呈圆形或卵圆形;11 例(100.0%)病灶均为低回声,其中9 例(81.8%)回声均匀,2 例(18.2%)回声不均匀,边界均清楚;11例病灶EUS下均无血流信号;6 例(54.5%)病灶为腔内生长,5 例(45.5%)为腔内外生长,均无分叶、囊变和钙化。超声弹性成像提示病变质地硬(图1C)。

图1 食管神经鞘瘤的内镜特征Fig.1 Endoscopic examination of esophageal schwannomas
2.2 内镜切除效果
11 例食管神经鞘瘤中,ESD 切除4 例,STER 切除7例,完整切除率为100.0%,中位手术时间41 min(17~135 min),术中仅有1例患者出血,经热钳止血成功,未发生穿孔,所有患者均未发生迟发性出血。术后首次进流食时间为(1.2±0.6)d,平均住院时间为(6.9±2.5)d。1 例患者因手术结束取出瘤体时致食管壁撕裂,故放置两根引流管,术后共引流出17 mL 褐色液体。术后有3 例出现颈胸部皮下气肿,术后24 h 内逐渐吸收。2 例经STER 切除的患者,术后体温和白细胞略有上升,经保守治疗后好转。所有患者均未发生感染。见图2。
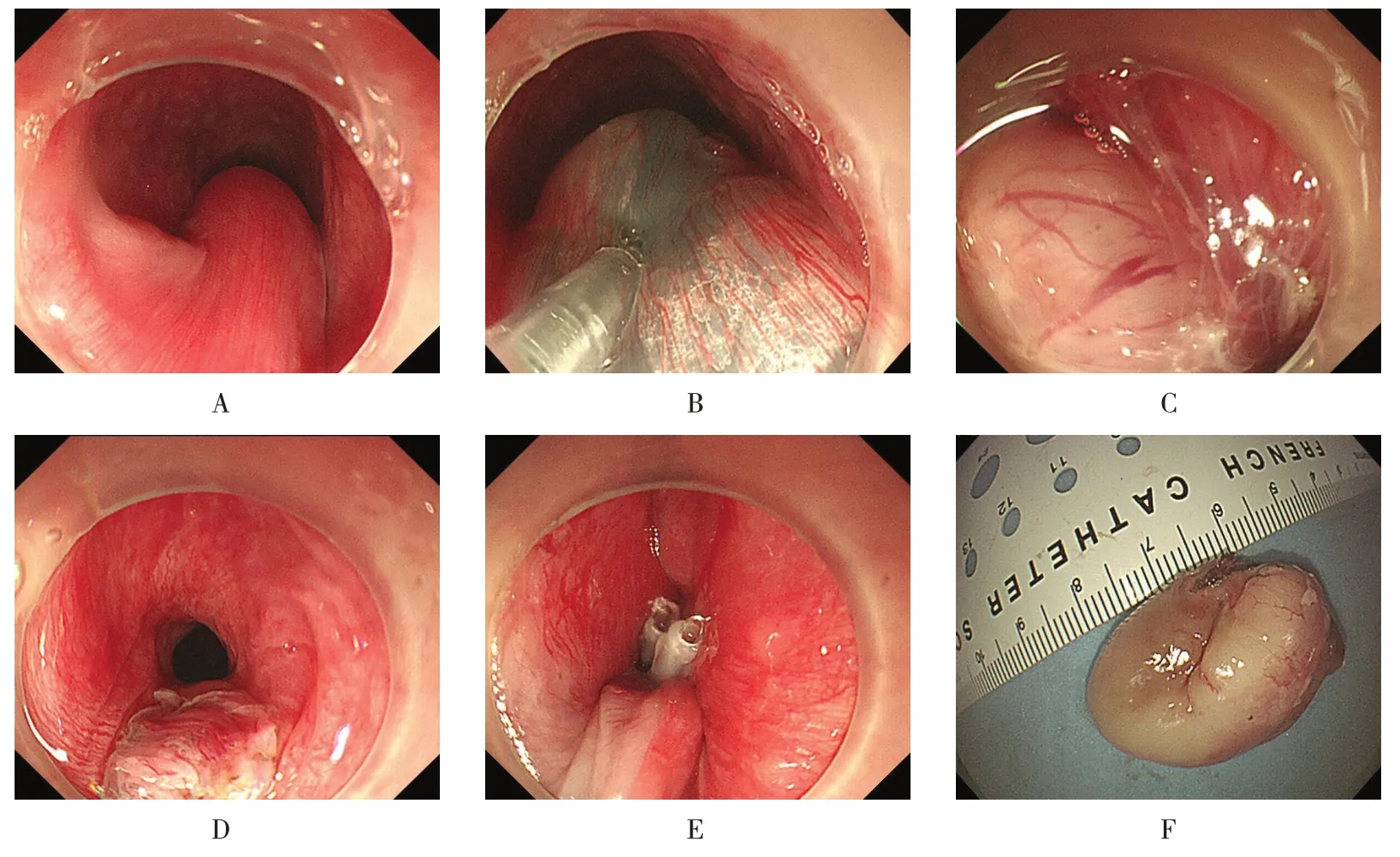
图2 内镜下治疗食管神经鞘瘤Fig.2 Endoscopic treatment of esophageal schwannomas
2.3 组织病理学
肉眼观:肿瘤的切面呈灰白或灰黄色,半透明且有光泽,实性、质地中等;组织病理学:瘤细胞界限清楚,伴包膜,呈梭形、栅栏状或编织状排列,没有核异型(图3A),食管神经鞘瘤的免疫组化显示Desmin和CD117均为阴性,S100均阳性(图3B),有4例局灶CD34阳性,有3例局灶平滑肌肌动蛋白和琥珀酸脱氢酶复合体B亚基重组蛋白阳性,1例SOX阳性,1例神经元特异性烯醇化酶重组蛋白阳性,但均无弥漫性免疫反应,Ki-67指数为1%~10%。

图3 组织病理学检查Fig.3 Histopathological examination
2.4 随访
中位随访时间53个月(12~85个月),期间患者无局部复发、远处转移和疾病相关死亡病例发生。术后3个月复查内镜,提示创口愈合。见图4。

图4 术后3个月伤口愈合情况Fig.4 Wound healing at 3 months after operation
3 讨论
神经鞘瘤,又称施万(Schwann)细胞瘤,起源于胃肠道壁内神经丛的Schwann 细胞[13],是最多见的良性外周神经肿瘤,可发生于身体任何部位,尤其是软组织,但消化道少见[14]。胃肠道神经鞘瘤占所有胃肠道肿瘤的0.2%~1.0%,多发生于胃,极少发生于食管[15],文献中报道的食管神经鞘瘤病例数不到20例[1,13]。本研究中,主要见于中老年,平均发病年龄为57.5 岁,男女比例为1.2∶1.0。本文发病年龄与文献[16]报道一致,但性别比例上有差别,该文献中以女性更为常见。
食管神经鞘瘤患者最常见的症状是吞咽困难,其次是疼痛,通常位于食管上部,患者常无明显临床表现[17]。本研究中,有54.5%的患者出现进食哽咽感,27.3%的患者有上腹部不适,18.2%的患者无明显症状,所有患者均无特殊个人或家族史;患者术前血清肿瘤标志物(CA125、CA19-9、CA72-4、甲胎蛋白和癌胚抗原等)均正常。食管神经鞘瘤的CT 和MRI影像学特征与其他食管黏膜下肿瘤极为相似,无明显特异性,影像学诊断价值不高[18]。
食管神经鞘瘤的内镜特点与食管平滑肌瘤和间质瘤类似,无明显特异性。有研究[17,19]报道,食管神经鞘瘤最常见于食管上部和中部,与本研究相似。本研究中,病变在白光内镜下均呈隆起型,食管表面黏膜正常,光滑无溃疡;有1例(9.1%)病灶周围黏膜可见黏膜桥,瘤体可随蠕动而上下滑动,该例患者术后证实病变起源于黏膜下层。因食管神经鞘瘤起源于黏膜下层和固有肌层,内镜下取黏膜活检经常无法作出诊断。
近年来,EUS越来越多地被用于食管黏膜下肿瘤的术前判断,包括肿瘤的起源、回声模式、边界和淋巴结肿大与否等[20]。有研究[21]表明,食管神经鞘瘤在EUS下是低回声病灶,与本文一致。本研究中,病灶源于固有肌层(90.9%)和黏膜下层(9.1%),呈现卵圆形或圆形,低回声,界限清晰,大部分病灶(81.8%)回声均匀,所有病灶在EUS 下均无血流信号,有6 例(54.5%)为腔内生长,5 例(45.5%)为腔内外生长,病灶中均未见分叶、囊变和钙化。尽管EUS在诊断食管神经鞘瘤范围、形状和血流信号等方面发挥着重要的作用,但最终诊断仍需经过组织病理学检查来明确。食管神经鞘瘤、食管平滑肌瘤和食管间质瘤在白光内镜与EUS 下表现类似,术前难以辨别[22]。EUS-FNA 用于上消化道黏膜下病灶的穿刺,一般是安全有效的,与传统活检钳技术不同的是,EUS-FNA 可以对累及黏膜下层或深肌层的病灶进行取样[23]。LI等[24]研究表明,利用免疫组化方法检测病灶中蛋白的表达,可以区分神经鞘瘤与其他食管黏膜下肿瘤,如平滑肌瘤和间质瘤。因此,在最终的病理诊断中,免疫组化必不可少。大多数食管神经鞘瘤是良性病灶,但也具有恶变的可能[19],手术切除是首选的治疗方法。目前,临床亦开始采用内镜切除食管神经鞘瘤[25]。本研究表明,ESD 和STER 用于食管神经鞘瘤的治疗是安全有效的,且可完整切除位于深肌层的食管神经鞘瘤。本文有3 例患者出现术后皮下气肿,均在术后24 h 内自行吸收、消失;11 例患者均未出现穿孔、迟发性出血和感染,2例术后出现短暂白细胞及体温升高,但体温均于24 h内恢复正常,均未发生感染,术后24 h基本恢复流食,未出现消化道出血、胸膜炎和纵隔脓肿等相关并发症,无死亡病例。有2 例(18.2%)患者因标本边缘见肿瘤组织,考虑为R1 切除,但病理活检时未见核异型和侵袭周围组织等表现,综合患者情况,没有追加外科手术。由此可见,食管神经鞘瘤可以在内镜下局部切除。相比于手术切除,内镜切除可以减轻患者疼痛感,缩短术后进流食时间,减少住院天数和降低费用[26]。本研究的患者在随访中均未出现术后食管狭窄、局部复发或远处转移,有2 例患者出现术后反流,1 例距门齿19.0 cm,另1 例距门齿25.0 cm,考虑与患者本身有胃食管反流病有关。
本研究显示,食管神经鞘瘤为单发的灰白、黄白色肿块,呈半透明状、有光泽,实性且质地中等;组织学上,瘤细胞呈梭形、栅栏状或编织状排列;即使病灶大小为5.0 cm,也未见核异型,且无核分裂象及坏死;免疫组化结果显示,S100 在所有病灶中均为阳性,CD117 和Desmin 均阴性,少数局灶CD34 阳性或其他抗体阳性,Ki-67指数低,均未见弥漫性免疫反应。本研究提示:内镜切除是治疗食管神经鞘瘤可行的方法。
综上所述,ESD 和STER 能够完整切除食管神经鞘瘤,且安全有效。但本研究样本量较小,是一项单中心回顾性研究,随访时间较短,仍需今后大样本、前瞻性研究来进一步明确其疗效。
