高效液相色谱-共振瑞利散射联用检测人体尿液中的法莫替丁与雷尼替丁
2021-08-06张钰玉龙登莹彭敬东
陈 方,张钰玉,龙登莹,鲜 红,彭敬东*
(1.贵阳学院 化学与材料工程学院,贵州 贵阳 550005;2.西南大学 化学化工学院,重庆 400715)
雷尼替丁(RNTD)和法莫替丁(FMTD)均为H2受体阻滞剂,是抑制胃酸分泌的药物,具有抑制胃酸和胃蛋白酶活性,通过改善胃粘膜的微循环促进细胞再生和修复的作用,主要用于治疗胃和十二指肠溃疡,但大量服用会损伤肾功能、性腺功能和中枢神经,对人体健康产生不利影响[1-2]。RNTD和FMTD的半衰期约为2~3 h,主要通过尿液排泄,尿液中的药物浓度变化幅度大且快,因此研究其在尿液样品中的测定方法对于临床用药和科学研究具有重要意义[3-4]。RNTD和FMTD的检测方法包括荧光光谱法[5]、流动注射-抑制化学发光法[6]、Gran电位滴定法[7]、表面增强拉曼散射法(SERS)[8]、高效液相色谱法(HPLC)[9]、液相色谱-质谱联用法(LC-MS)[10]和毛细管电泳法(CE)[11]。上述方法虽有很好的优势,但实际应用仍存在局限,如:HPLC法的选择性很高,但灵敏度较低;LC-MS和CE方法复杂且灵敏度不高,因而有必要探索高选择性、高灵敏度和快速检测RNTD和FMTD的方法。
目前,共振瑞利散射(RRS)作为一种新颖、高灵敏度的分析方法已被采用。该方法是基于当瑞利散射的波长接近分子吸收光谱带时,由于发生共振而产生再次散射的过程[12],具有较高的灵敏度,且分析速度快,已被广泛用于药物分析[13-14]、环境分析[15-16]、无机物[17]及生物大分子分析[18]等领域。但该方法的选择性较差,易受相同结构物质的干扰,可利用HPLC的高选择性,将HPLC与RRS联用得到高选择性和高灵敏度的分析方法。
本研究发现在pH 4.6的BR缓冲溶液中RNTD和FMTD能与金属离子Pd(Ⅱ)螯合形成阳离子,再与染料赤藓红(Ery)在静电引力和疏水作用下形成三元离子缔合物,导致整个体系的RRS信号急剧增强。基于此,将高效液相色谱作为分离装置,通过柱后衍生系统与共振瑞利散射反应装置联用,经HPLC分离后的RNTD和FMTD,再与柱后衍生系统引入的探针在反应装置中缔合成离子化合物,然后记录得到RRS信号,从而实现对RNTD和FMTD的分析。该方法成功应用于实际样品的检测。
1 实验部分
1.1 仪器与试剂
HPLC-RRS联用技术包括HPLC和RRS反应装置。其中高效液相色谱仪包含分离和柱后衍生系统(日本Shimadzu公司):DGU-20A5R脱气装置,两个LC-20AD泵,RF-20A荧光检测器。PCX-BT柱后衍生装置(沈阳天美达仪器公司),F-2500荧光检测器(日本Hitachi公司),UV-2450分光光度计(日本Shimadzu公司),PHS-FE20酸度计(上海科学仪器有限公司),Millipore SZ-93自动纯水二水蒸馏器(上海圣科仪器设备有限公司)。
雷尼替丁、法莫替丁标准品和醋酸钠(阿拉丁化工试剂有限公司),赤藓红(麦克林生化科技有限公司),醋酸钯(Pd(Ac)2,瑞奇斯特集团有限公司),乙腈(色谱纯,天津市科密欧公司)。不同pH值的BR缓冲溶液:由0.2 mol/L的NaOH溶液和0.4 mol/L的H3PO4、HAc-H3BO3混合酸按一定比例混合而成。氢氧化钠(分析纯)、硼酸、醋酸均购于重庆川东化工有限公司。实验用水为二次蒸馏水,各溶液均用0.22μm滤膜过滤。
1.2 溶液制备
分别准确称取一定量的RNTD和FMTD标准品用水溶解并定容,配制成1 mg/L的储备液,于冰箱0~4℃下避光保存;准确称取一定量醋酸钯,用醋酸溶解并配制成2×10-4mol/L的储备液;准确称取一定量赤藓红用水配制成4×10-4mol/L的储备液,避光保存,用水稀释储备液得到不同浓度的操作液。
1.3 尿样采集及前处理
采集服用法莫替丁胶囊志愿者的尿样,该患者服用法莫替丁胶囊3粒/天,每粒350 mg(269 mg FMTD)。在患者用药12 h后,收集其尿液。取200μL尿样加入400μL乙腈,涡旋1 min并以5 000 r/min离心10 min,取上清液转移至离心管中,在真空干燥箱(40℃)中干燥1 h,以除去乙腈。用0.22 μm混合相针式滤器过滤后,待测定。
1.4 HPLC分离及RRS检测条件
HPLC-RRS联用装置如图1。柱前分离条件为:以pH 4.5的醋酸-醋酸钠缓冲溶液与乙腈(90∶10)为流动相等度洗脱,流速为0.5 mL/min,进样量为20μL,使用Kinetex 5μm C18液相色谱柱(250 mm×4.60 mm),柱温为35℃。柱后衍生条件为:Pd(Ac)2溶液以0.3 mL/min流入三通管1内,体系中流动的螯合离子与Ery在三通管2内混合,Ery流速为0.2 mL/min。最后流至加热反应管路中,直至缔合反应完全后进入检测器,F-2500荧光检测器的检测波长λex=λem=370 nm,记录RRS信号。
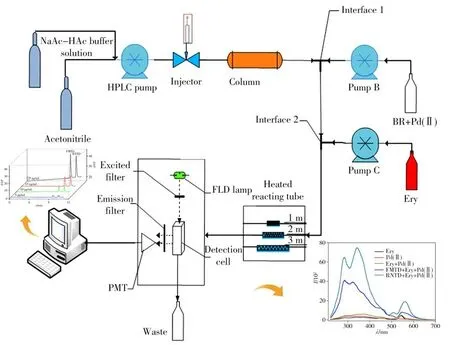
图1 HPLC-RRS反应装置示意图Fig.1 The schematic diagram of HPLC-RRS system
2 结果与讨论
2.1 反应机理的探究
分别用等摩尔连续变化法测定Pd(Ⅱ)与FMTD二元配合物及Pd(Ⅱ)与Ery形成离子化合物的组成比,如图2所示,该二元配合物Pd(Ⅱ)-FMTD的组成比为1∶1;Pd(Ⅱ)-Ery的结合比为1∶2,而当Pd(Ⅱ)-FMTD二元配合物进一步与染料Ery作用形成[Pd(FMTD)]·(Ery)2时,该三元离子缔合物的组成比为nFMTD∶nPd(Ⅱ)∶nEry=1∶1∶2,这与文献结果一致[5]。此外,采用分布分数计算法讨论了反应生成的离子化合物组成形式,因在pH 4.6时,Ery的pKa1=2.9,pKa2=3.8,经过计算该实验条件下Ery各型体(H2L、HL-、L2-)的分布系数分别为0.3%、13.6%、86.1%,Ery主要以Ery-的形式存在。而Ery-形式分子中的1个苯基上有2个π6键,与苯基相接的羧基上有1个π2键,使得Ery-的羧基处于强大的共轭体系中,带有极强的电子,更易离解,在实验条件下二元配合物Pd(Ⅱ)-FMTD可通过静电引力和疏水作用力形成电中性的[Pd(FMTD)]·(Ery)2三元离子缔合物。
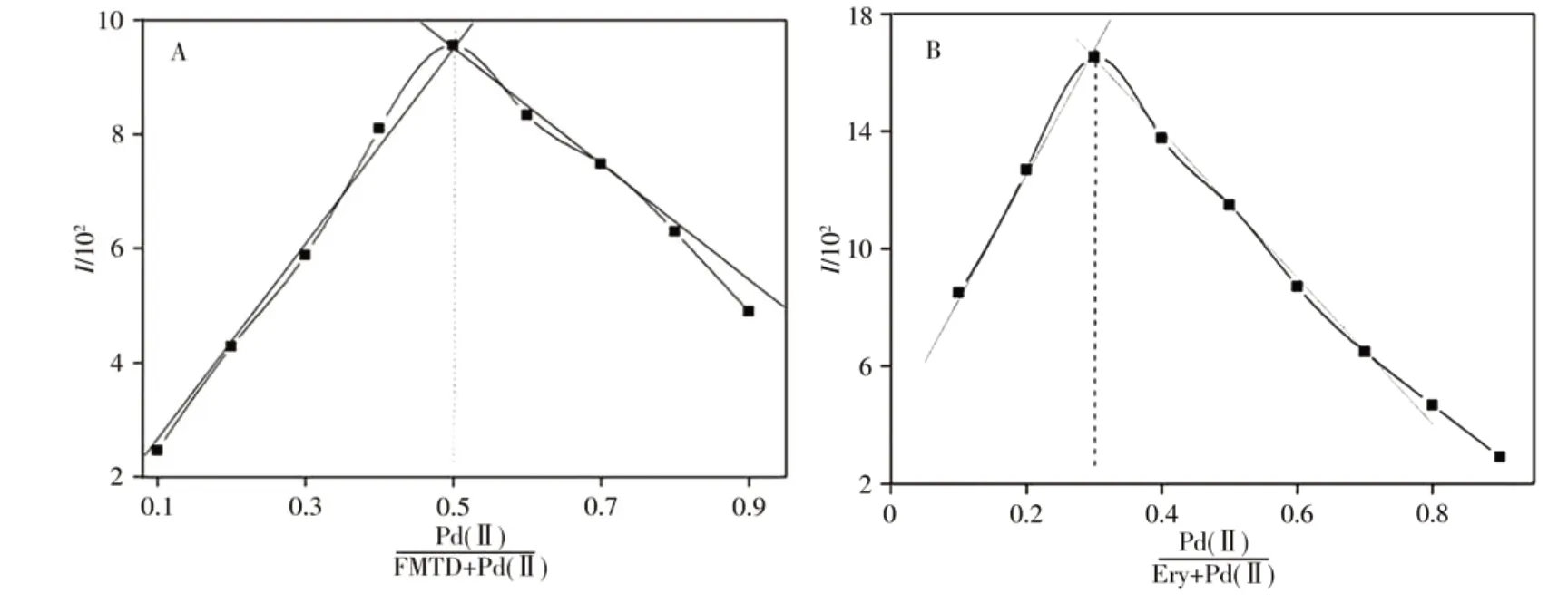
图2 等摩尔连续变化法测定Pd(Ⅱ)与法莫替丁二元配合物和Pd(Ⅱ)与赤藓红形成离子化合物的组成比Fig.2 Composition ratios of Pd(Ⅱ)and FMTD,Pd(Ⅱ)and Ery by molar ratio method
2.2 体系共振瑞利散射信号增强的原因
共振瑞利散射过程是当散射光谱带接近分子紫外吸收光谱带时,发生散射后吸收再次散射产生极强的共振瑞利散射光谱。反应体系中三元离子缔合物[Pd(FMTD)]·(Ery)2的RRS光谱与紫外吸收光谱如图3所示,比较发现较强的RRS信号分别位于295 nm和360 nm,以及生成1个很小的散射峰处于610 nm,而该体系最大的吸收光谱信号分别位于335 nm和560 nm,即RRS光谱与吸收光谱非常接近,与最大散射峰相比红移了40 nm。因此散射信号显著增强的主要原因是散射光谱接近吸收光谱带时产生了共振增强效应。

图3 Pd(Ⅱ)-赤藓红-法莫替丁的RRS光谱与紫外吸收光谱Fig.3 RRS and UV absorption spectra of the Pd(Ⅱ)-Ery-FMTD
2.3 检测波长的优化
将F-2500荧光检测器设置成入射波长等于发射波长,从220 nm到800 nm进行同步扫描,分析不同波长下该体系的RRS信号值。由图4A可见,FMTD和Ery自身的RRS信号均很弱,FMTD分别与Pd(Ⅱ)、Ery作用时的RRS信号仍较弱。如图4B所示,金属离子Pd(Ⅱ)与Ery相互作用时体系的RRS信号很弱,但分别加入药物RNTD和FMTD后,三元混合反应体系的RRS信号显著增强。实验考察了不同检测波长(300~380 nm)对三元混合体系RRS信号的影响,结果显示,RNTD和FMTD的RRS信号在检测波长370 nm处达到最大(图4C),因而选择最佳检测波长为λex=λem=370 nm。

图4 FMTD与Pd(Ⅱ)、Ery分别作用的RRS光谱(A),Pd(Ⅱ)-Ery-药品的RRS光谱(B),以及检测波长对反应体系RRS光谱信号的影响(C)Fig.4 RRS spectra of FMTD with Pd(Ⅱ)and Ery,respectively(A),RRS spectra of Pd(Ⅱ)-Ery-drugs(B)and the effect of detection wavelength on RRS spectra signal(C)
2.4 溶液p H值、反应温度与有机溶剂浓度的优化
溶液pH值直接影响整个反应体系的RRS信号,因此考察了柱后衍生系统的溶液pH值对Pd(Ⅱ)-Ery-药品三元体系RRS光谱的影响,以BR缓冲溶液调节溶液的pH值在3.5~5.0范围内。结果表明,当pH值为4.6时体系的RRS响应值最高,若酸度较低,染料自身会发生聚集;而酸度较高时,Pd(Ⅱ)与药物形成的螯合阳离子难以与Ery相互作用,因此确定最佳pH值为4.6。考察了不同的柱后反应温度(20~50℃)对体系RRS信号的影响,发现当反应体系处于30℃时RRS信号最强,因此确定柱后反应温度为30℃。HPLC-RRS联用装置中有机相在分离系统不可或缺,而有机溶剂的浓度对体系反应物缔合作用的影响很大,因而考察了不同含量的乙腈对体系RRS信号的影响。结果显示,当溶液中乙腈含量为10%时体系的RRS信号最大,因此选择乙腈含量为10%。
2.5 柱后Ery与Pd(Ac)2浓度的优化
HPLC-RRS联用技术的柱后衍生系统以Ery和Pd(Ⅱ)同时作为探针引入反应装置,因此Ery和Pd(Ac)2的浓度对反应体系RRS强度的影响至关重要。考察了Ery浓度在2×10-4~10×10-4mol/L范围内对体系RRS强度的影响,结果表明,Ery浓度为6×10-4mol/L时,体系的RRS信号值最大且稳定。当Ery浓度太低时,体系中的三元螯合物反应不完全;但Ery浓度过大时,其本身的RRS信号增大,且噪音也迅速增大。进一步考察了Pd(Ac)2浓度在0.6×10-4~1.4×10-4mol/L范围内对体系RRS强度的影响,发现Pd(Ac)2的最佳浓度为1.0×10-4mol/L,此时体系的RRS响应最大且稳定。
2.6 标准曲线与检出限
在最佳实验条件下,采用本方法测定质量浓度分别为5、10、15、20μg/mL的法莫替丁与雷尼替丁混合标准工作溶液,以峰面积为纵坐标(y),以样品的质量浓度为横坐标(x,μg/mL)绘制标准曲线。如表1所示,法莫替丁与雷尼替丁分别在0.024~25μg/mL和0.033~25μg/mL质量浓度范围内线性良好,相关系数(r)分别为0.999 0和0.998 8;根据信噪比(S/N)大于3计算得到方法检出限(LOD)分别为7.3、10.1 ng/mL,结果显示该方法的灵敏度高。将标准药品加入空白尿样中配制系列质量浓度的混合溶液,然后分别重复进样分析5次,得到的RRS信号稳定。图5A为法莫替丁和雷尼替丁标准溶液的色谱图,表明该方法得到的色谱峰尖锐且稳定,基线噪音很小,保留时间在12 min内。

表1 法莫替丁和雷尼替丁的线性关系、检出限、回收率及相对标准偏差Table 1 Linear relations,detection limits,recoveries and RSDs of famotidine and ranitidine
2.7 回收率与相对标准偏差
在经前处理的空白尿液样品中加入FMTD和RNTD标准品,制备成加标浓度分别为5.0、10μg/mL的样品,各浓度平行进样6次,按照本方法进行分析(见表1)。结果显示,法莫替丁与雷尼替丁的加标回收率为97.8%~102%,相对标准偏差(RSD)均不大于5.1%,显示该方法的准确性和精密度高,符合分析方法要求。
2.8 实际样品测定
按“1.3”方法采集和处理服用法莫替丁胶囊志愿者的尿样,采用本方法进行检测。结果显示,尿液中法莫替丁的平均质量浓度约为0.765μg/mL。其色谱图中存在其他的代谢产物(如图5B),但对比标准溶液的色谱图,可见尿液中的其它代谢产物不会对样品检测产生干扰。

图5 法莫替丁和雷尼替丁标准溶液(A)及实际人体尿液的色谱图(B)Fig.5 Chromatograms of the standard solution for FMTD and RNTD(A)and the real urine sample(B)B:a.the standard solution;b.the urine sample was taken 12 h after the patient took 269 mg FMTD
3 结 论
本研究通过高效液相色谱与共振瑞利散射联用建立了一种新颖的分析检测方法。通过将金属离子Pd(Ⅱ)与雷尼替丁和法莫替丁在弱酸介质中螯合后,再与赤藓红通过分子间作用力结合形成离子缔合物,使整个体系的RRS信号显著增强。采用金属离子Pd(Ⅱ)和赤藓红同时作为探针,引入高效液相色谱的柱后联用装置,与柱前分离的雷尼替丁与法莫替丁相互作用后再通过荧光检测器记录RRS信号。该方法具有准确度和灵敏度高等特点,将其用于服用法莫替丁胶囊患者尿液中残留药物的检测,结果显示该法选择性强、稳定可靠。
