“化学反应原理”相关模型在解题中的应用
2021-08-05李开标
李开标
(福建省上杭县第一中学 364200)
一、原电池模型在解题中的应用
构建原电池模型应明确原电池内外电路的电子移动方向,能够运用所学的氧化还原反应判断正负极的反应方程式.另外,为使学生能够在解题中灵活应用该模型,可围绕原电池模型设计如下习题,要求学生思考解答.
例1 使用铜片和银片设计成如图1所示的原电池,则有关该电池的判断正确的是( ).

图1
A.电子通过盐桥从乙池流向甲池


D.将铜片浸入硝酸银溶液中发生的化学反应与该原电池总反应相同

二、电解池模型在解题中的应用
应用电解池模型时应鼓励学生采用对比方法分析电解池和原电池之间的区别与联系,以更好的加深其印象,避免将两种模型搞混淆.同时,为使学生更好的把握电解池模型本质,掌握解答相关问题的思路,课堂上可与学生一起分析相关的例题,如下题.
例2为减少二氧化碳的排放,我国科学家设计熔盐电解池用于捕获二氧化碳,如图2所示,则以下说法不正确的是( ).
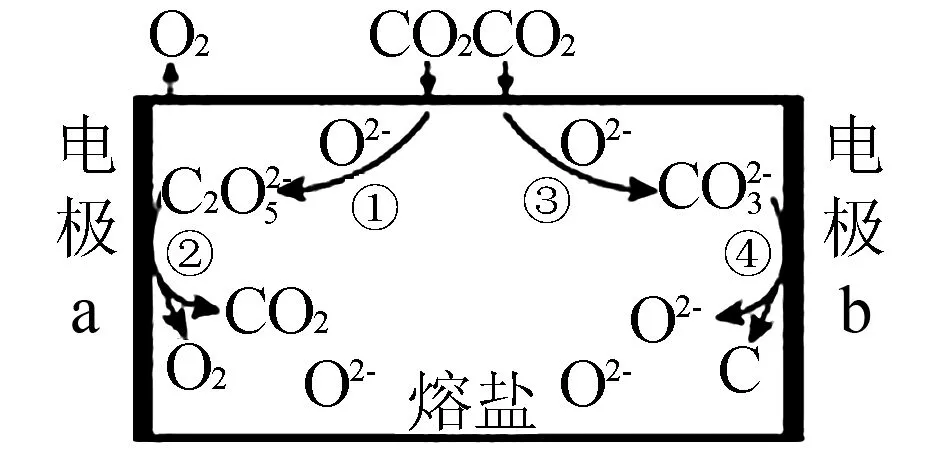
图2
A.CO2过量排放是导致温室效应的原因之一
D.CO2最终转化为C和O2

三、化学平衡模型在解题中的应用
化学平衡模型是高中化学的重点、难点.该模型不仅涉及较多的概念,而且知识较为抽象,对学生的理解能力要求较高.教学中应结合具体的化学反应为学生展示改变浓度、压强、温度、催化剂等条件给化学平衡带来的影响,使其能够灵活运用勒夏特列原理分析化学平衡问题.同时,为使学生更好地把握化学平衡模型本质,可设计如下课堂训练习题.


图3
A.图中ω1≥1
B.图3乙中,线A表示正反应的平衡常数
C.在恒容容器中进行,压强不变时反应达到平衡状态
D.当温度为T1,ω=2时,Cl2的转化率为33.3%

四、盐类的水解模型在解题中的应用
盐类的水解模型包括盐类水解的规律、影响盐类水解的因素等.为提高学生运用盐类的水解分析问题的能力,应结合教学经验,为学生布置相关的作业,更好的巩固学生所学.如在布置作业中可要求学生作答以下习题.
例4室温时,向20mL0.1mol/L的两种酸HA、HB中分别滴加0.1mol/L的NaOH溶液,其pH变化分别对应图4中的Ⅰ、Ⅱ,以下说法不正确的是( ).

图4
A.向NaA溶液中滴加HB可产生HA
B.滴加NaOH溶液至pH=7,两种溶液中c(A-)=c(B-)
C.a点,溶液中微粒浓度:c(A-)>c(Na+)
D.滴加20mL NaOH溶液时Ⅰ中H2O的电离程度大于Ⅱ中
该题目结合图像能很好的考查学生对盐类水解模型的理解.A项,由图可知HB溶液的pH较HA的小,表明HB的酸性强于HA,由强酸制弱酸原理可知,正确;B项,因HA和HB的酸性不同,消耗NaOH溶液的体积不同,则溶液中的c(Na+)不同,两溶液中c(A-)一定不等于c(B-),错误;C项,a点为等浓度的HA和NaA混合液,溶液呈酸性,则HA的电离大于NaA的水解,溶液中微粒浓度c(A-)>c(Na+),正确.D项,当滴加NaOH溶液20mL时,等浓度的HB和HA刚好完全反应,但HB的酸性强于HA,则NaA水解大于NaB,Ⅰ中H2O的电离程度大于Ⅱ中,正确.
