我国鲑鳟鱼类养殖常见流行疫病研究概况
2021-08-05李乐于晓清李翘楚于道德邹琰叶海斌吴海一刁菁
李乐, 于晓清, 李翘楚, 于道德, 邹琰, 叶海斌, 吴海一, 刁菁
山东省海洋科学研究院,山东省海水养殖病害防治重点实验室,山东青岛266104
鲑鳟鱼类是鲑鱼和鳟鱼的统称,均隶属于鲑科(Salmonidae),为世界三大主养品种之一,因生活环境清洁、肉质细嫩且富含二十二碳六烯酸(docosahexaenoic acid,DHA)等不饱和脂肪酸等优点深受消费者喜爱,在我国有50 多年的养殖历史。养殖品种包括大西洋鲑、虹鳟、金鳟、银鲑、硬头鳟、七彩鲑、山女鳟等10余种,养殖区域涵盖了北京、青海、黑龙江、辽宁、吉林、甘肃、山东、新疆等地,随着近年来对黄海冷水团资源的发掘,鲑鳟鱼养殖也从陆地走向了海洋[1-5]。
我国鲑鳟鱼人工养殖规模逐年扩大,养殖技术日趋成熟,但养殖品种种质退化、外源疾病输入、养殖环境遭受破坏、防病意识缺乏以及其他人为原因导致近年来病害频发,特别是传染性造血器官坏死病、疖疮病等暴发性疾病,给养殖业带来了巨大危害[6-9]。因此,本文对我国养殖鲑鳟鱼主要流行疫病种类、诊断技术以及免疫防控技术的研究现状进行概述,旨在为鲑鳟鱼养殖从业者对疫病的预防和诊断提供参考。
1 主要流行疫病
1.1 细菌性疾病
1.1.1 疖疮病 疖疮病(furunculosis)是鲑鳟养殖过程中常见细菌病之一,可分为急性型、亚急性型、慢性Ⅰ型及慢性Ⅱ型,虹鳟鱼多表现为慢性型或亚急性型[10],通常表现为体色发黑、眼球突出、食欲不振、腹部肿胀、鳍基部充血、皮肤溃疡等。疖疮病的病原为杀鲑气单胞菌(Aeromonas salmonicida),属气单胞菌科(Aeromonadaceae)气单胞菌属(Aeromonas)[11],是一种不能运动、兼性厌氧的革兰氏阴性菌。杀鲑气单胞菌具有广泛的地理分布,其宿主范围广泛,主要危害鲑鳟鱼类、鲤鱼、大菱鲆等,可感染各个生长发育阶段的海淡水鱼类[11-14]。目前已知的杀鲑气单胞菌分为:杀鲑亚种、无色亚种、杀日本鲑亚种、溶果胶亚种和史氏亚种等,其中杀鲑亚种为典型株。近年来,有学者根据其特异性毒力基因vapA序列的差异分为14个类型,呈现出一定程度的地缘特性[15-17]。
目前,我国对杀鲑气单胞菌的分离鉴定、致病性、生长模型、药敏特性等方面开展了相关研究。刁菁等[18]自虹鳟病鱼中分离到一株致病菌,通过生理生化分析及分子生物学手段鉴定为A. salmonicida,并通过回染实验和毒力因子(如气溶素、溶血素、封闭带毒素等)检测,确定此菌株具有较强的致病力。田会芹等[19]则对从大西洋鲑患病个体分离的A. salmonicida开展了环境因子(温度、pH)对其生长的影响研究,确定了其各单因子的适宜范围,并以温度为主要影响因子建立了生长模型。此外,有团队研究了A.salmonicida感染对大西洋鲑游泳和变色型的影响及其生理机制,对受感染后体内免疫系统以及与能量代谢相关的因子进行了量化分析,揭示了病变后的生理变化[20]。上述研究通过探明A. salmonicida致病机理、分析其生长特性、研究鱼类感染后的行为变化和生理机制,来为疫苗研制、病害预警系统研发提供理论数据,有助于减少养殖鲑鳟鱼类感染A.salmonicida的可能性,降低疖疮病的发病率。
1.1.2 细菌性败血症 细菌性败血症也称细菌性出血病、细菌性腹水病等,是一种水产养殖过程中常见的病症之一,病鱼外部症状表现为体色发黑、腹部肿胀、尾部和鳍条出现坏死和糜烂,肛门和大部分皮肤出血且会恶化为水肿型溃烂,并伴有内脏器官出血。嗜水气单胞菌(Aeromonas hydrophila)为该病主要病原,隶属于气单胞菌科气单胞菌属,是淡水养殖动物与重要的病原菌之一,严重危害鲑鳟鱼类、草鱼、牙鲆、鲫鱼、团头鲂等鱼类的养殖业,可引起细菌性败血症、肠炎,是一种典型的条件性致病菌,当饲养周边条件、水质指标发生剧烈变化时,常与其他病原菌混合感染使病情恶化[21-25]。研究表明,A. hydrophila致病性与自身两大类致病因子密切相关:一类是本身具有致病作用,如溶血素、肠毒素等外毒素;另一类则与细菌的吸附、入侵机体有关,如菌毛、表面蛋白S 层等粘附因子[26-28]。
1.1.3 其他细菌性疾病 除疖疮病、细菌性败血症两类常见流行疫病外,还有烂鳃病、烂鳍病、红嘴病、肠炎等细菌性疾病,相应的病原种类繁多,多为条件致病菌,包括鳗弧菌、嗜鳃黄杆菌、鲁氏耶尔森菌、迟钝爱德华氏菌、海分枝杆菌、柱状黄杆菌等,大多存在着混合感染的情况,对鲑鳟鱼养殖业造成一定程度的危害[2,9,27-30]。
1.2 病毒性疾病
世界动物卫生组织(Office International des Épizooties,OIE)必须申报的鱼类疫病中,以鲑鳟鱼类作为宿主的有5种:传染性鲑鱼贫血症、鲑鱼甲病毒病、流行性造血器官坏死病、病毒性出血性败血症、传染性造血器官坏死病,均为病毒性疾病,它们对全球鲑鳟鱼类养殖业造成了巨大的经济打击。我国贯彻执行《中国人民共和国动物防疫法》,农业农村部明确规定了《一、二、三类动物疫病病种名录》[31],其中流行性造血器官坏死病、传染性造血器官坏死病、病毒性出血性败血症被归为二类疫病,进行重点防疫。
水温对上述病毒病的发病及死亡率影响较大,在水温3~18 ℃均可造成鱼类死亡,8~12 ℃为流行高峰。其中,传染性造血器官坏死病在水温10 ℃时,死亡率最高;水温低于10 ℃时,潜伏期延长,病情呈慢性;水温高于10 ℃时病情较急,显示低死亡率;当水温超过15 ℃后,一般不出现自然发病。
相较于欧洲、北美等地区,我国目前报道的病毒性疾病种类较少,主要为传染性造血器官坏死病和传染性胰腺坏死病2 种,目前国内尚未有鲑鳟鱼类暴发其他疾病的报道,但仍有较大的传入风险[32-34]。
1.2.1 传染性造血器官坏死病 传染性造血器官坏死病为农业部二类动物疫病,也是OIE 必须申报的疫病,常发生于虹鳟鱼养殖场,急性暴发会导致极高死亡率。该病病原为传染性造血器官坏死病毒(infectious hematopoietic necrosis virus,IHNV),是一种单链RNA 病毒,弹状病毒科,侵染的主要靶器官为肾造血组织[35-37]。IHNV 于20 世纪80年代传入我国,农业农村部于2011年起对其实施专项监测,中国水产科学研究院黑龙江水产研究所卢彤岩团队于2012—2017 年在辽宁、北京、山东、甘肃、新疆、河北、云南、青海等省份均分离到相应的病毒(图1)[38]。

图1 2012—2017年我国IHNV收集分布图[38]Fig.1 Map of collection sites for IHNV in China from 2012 to 2017[38]
IHNV 的核酸序列约为11 000 bp,目前NCBI录入的已有6 株完整的IHNV 毒株基因组被分离鉴定,其中 HLJ-09(JX64910)、BjLL(MF509592)及 CH20101008(KJ421216)均为国内分离鉴定[39-40]。IHNV 蛋白则由 P、G、M、N 和 L 5 种结构蛋白和1 种非结构蛋白组成,通过对G 基因进行系统发育分析,将IHNV 分为5 个主要的基因型,即 U、M、L、E 和 J 型[41-42],我国以 J 基因型为主,具有显著的地域特性。IHNV 在稚鱼和幼鱼之间水平传播是最主要的传染方式,其主要通过接触被病毒污染的水、食物、带毒鱼排泄的尿、粪便以及渔具等而感染[43]。
1.2.2 传染性胰腺坏死病 传染性胰腺坏死病主要危害20 周龄以内的鲑鳟幼鱼,一般为急性流行,短时间致死率可达90%以上,分布范围广泛,涉及我国山西、甘肃、山东、辽宁、四川等省份,其中1989 年发生的传染性胰腺坏死病暴发导致山东省的鲑鳟鱼类养殖损失接近90%[44]。其病原为传染性胰脏坏死病毒(infectious pancreatic necrosis virus,IPNV),隶属于双RNA 病毒科,可通过垂直传播和水平传播将病毒粒子释放到环境中,染病后幸存鱼将成为IPNV的终身携带者。
IPNV 基因组包含 A 和 B 2 个线性 RNA 分子,B 链编码的 VP1 为 RNA 聚合酶,A 链编码 VP2、VP3、VP4 和 VP5 4 种蛋白,其中,VP2 作为主要外衣壳蛋白,含有主要的抗原表位决定簇,其217~221 位氨基酸与病毒的毒力密切相关,现阶段大部分IPNV 的检测、分类、免疫研究均以VP2 为研究对象[45-47]。2013 年 Ji 等[48]在云南某养殖场虹鳟中分离出了IPNV 毒株——ChRtm213,并确定了其全基因组序列,这是我国IPNV分离株的第一个基因序列,根据A 链序列比对分析,其与日本株AM-98(AY283780.1)聚为一簇。同时,刘淼等[49]根据VP2序列进行基因型分型,采用临位相邻法构建了IPNV 的系统进化树,聚类分析结果显示,ChRtm213 与参考毒株加拿大Jasper(ATCC:VR-1325)聚为一簇,具有较近的亲缘关系(图2)。
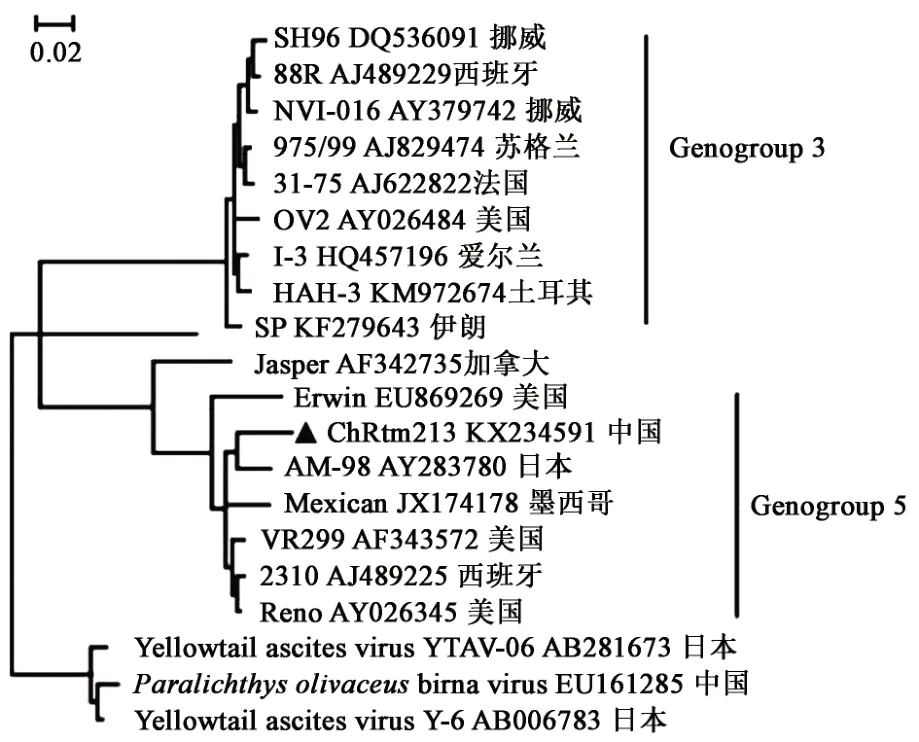
图2 以VP2基因序列构建的ChRtm213分离株进化树[49]Fig.2 Phylogenetic tree of ChRtm213 isolate based on gene sequence of VP2[49]
1.2.3 病毒性出血性败血症 病毒性出血性败血症为农业农村部二类动物疫病,也是OIE 必须申报的疫病,主要流行于欧洲和北美,近年来扩散到日本和韩国,迄今为止我国未见报道[33]。该病病原为病毒性出血性败血病毒(viral hemorrhagic septicemia virus,VHSV),属于弹状病毒科,为单链负义RNA 病毒,宿主极为广泛,可感染鲑鳟鱼、牙鲆、狗鱼和大菱鲆等淡水、海水养殖品种,近年来野生鱼类遭受感染而死亡的情况亦有报道[50-55]。
1.3 其他生物疾病
1.3.1 鱼虱病 挪威作为大西洋鲑的主产国,目前已形成成熟的防疫体系,但鱼虱病引起的损失仍困扰着其鲑鱼养殖业。鱼虱病的病原为鱼虱,属于节肢动物门、甲壳纲、桡足亚纲、鱼虱目、鱼虱科、鱼虱属,以寄主的粘液、表皮组织和血液为食,寄生在鲑鱼身上影响肉质,严重时导致鱼死亡,具有11 个不同形态的发育阶段,流行季节为5—10月[56]。鱼虱很容易产生广泛的抗药性,不易用药物防治,鱼虱雌虫受精后会离开宿主,将卵袋产在附着物上,这时可能是其生命周期最薄弱的环节[5]。目前,除生态防治和免疫预防外,通过防虫药物如敌百虫、除虫菊酯等药浴或饲料中预混杀虫药物,也是国外对其防控的主要手段。
1.3.2 水霉病 水霉病又叫白毛病、水绵病或肤霉病,一般是由水霉属或绵霉属等的真菌引起,大多生长在鱼体的伤口处和鱼卵上,呈白色棉絮状。健康鱼体具有较强的抗水霉病能力,水霉病多发生于养殖过程中分池、倒池、清污、运输等环节后,因操作粗暴导致鱼体体表组织破损、鳞片脱落等机械损伤后感染。随着其特效药——孔雀石绿于2002 年后全面禁用,水霉病也成为了限制虹鳟、七彩鲑、山女鳟等鲑鳟鱼类养殖增产的重要因素[57-58]。
2 流行疫病诊断技术
尽管各类疾病均在国内流行多年,但尚无有效治疗的措施。随着病原体耐药性的增强,高效检出病原、切断传播途径尤为重要。目前,针对水生动物疫病诊断,OIE 出版了《水生动物诊断手册》,我国颁布了相关的检测标准(表1),通过细菌培养鉴定、组织病理学、免疫学、分子生物学等手段综合判断,对流行疫病病原诊断起到了指导性作用。

表1 我国鲑鳟鱼类部分疾病检验规程Table 1 The quarantine methods of partial disease of salmon and trout in China
2.1 组织病理学技术
组织病理学作为基础诊断手段,在初诊中具有不可替代的地位。从业人员观察鱼体体表,对内脏器官、组织进行染色切片,利用显微镜检查,对机体进行解剖学特征分析,综合正常组织与老化、损伤、感染、病变等过程的特征变化,对鱼体疾病进行判断。但需要丰富的一线经验和技术手段,较难有科技产出,且需与其他手段配合。王琦等[59]对感染IHNV 的发病与未发病虹鳟的组织进行常规石蜡切片,HE 染色,并结合对不同规格和不同发病阶段虹鳟的血液细胞学检测。结果表明,发病虹鳟肝脏、肾脏、肠上皮、心肌等组织都发生了不同程度坏死;同时,发病鱼的血液细胞学各项指标发生了明显变化。这也说明,通过对虹鳟各组织的观察以及血液的检测,能较为便捷、直观地反映其健康状况。中国农业出版社出版的《鲑鳟疾病彩色图谱(第2 版)》将鲑鳟鱼类受到感染后的体表、鳃、肝、脾、肾等部位出现的病灶以图谱的形式展现,涵盖了八类疾病,为从业者初诊提供了直观的检索参考[60]。
2.2 细菌培养鉴定技术
使用取样针从病灶处取样,选取适当的培养基划线培养,选取菌斑进行分离鉴定。使用细菌生化实验微量鉴定管、全自动生化分析仪等对细菌的形态学特征、培养特性及生化实验结果综合分析,可以在一定程度上将细菌进行鉴定,但仍需通过分子生物学方法对16S rDNA 基因片段进行比对来判断[61]。郭中钢等[21]挑取虹鳟的肝脏、肾脏等病变部位,通过重复划线培养,获得一株嗜水气单胞菌,命名为HSZS-01,为革兰氏阴性菌,采用细菌微量生化鉴定管进行了生理生化分析,按照《常规细菌系统鉴定手册》鉴定到种,并使用药敏纸片进行了药敏分析。该方法操作简便、适用于初检以及基层检测。
2.3 细胞培养技术
作为病毒学研究最经典的方法,目前细胞培养技术仍为水生动物病毒诊断的“黄金标准”。将待测样本的靶器官(如肝脏、肾脏、脾脏)进行破碎匀浆并稀释,选用特定的敏感细胞进行分离培养后,通过显微镜观察是否出现细胞病变(cytopathic effect,CPE)进行判断[62]。该方法观察方法简单,能够通过培养分离毒株、保存毒株,但操作要求高、诊断时间长且难以鉴定到种,需要与其他检测技术配合使用,不适合大规模检测。胡晓利等[46]将病料进行匀浆后,用含有双抗的M199 细胞培养液1∶10稀释后,4 ℃孵育过夜,稀释接种于大鳞大麻哈鱼胚胎细胞(Chinook salmonembryo cells,CHSE)进行传代培养,分离得到了一株IPNV。赵景壮等[36]则利用鲤鱼上皮瘤细胞(epithelioma papulosum cyprini,EPC)分 离 得 到 了 IHNV 毒 株Sn1203,同时结合分子生物学手段进行了全基因组序列分析,进一步明晰了该毒株的系统进化地位。
2.4 免疫学技术
根据抗原抗体特异性结合的原理,针对保守的抗原决定簇,借助于显色手段或标记技术,达到诊断特定病原的目的。免疫学检测技术包括中和试验、免疫荧光、免疫印迹、酶联免疫吸附、胶体金、原位杂交等。免疫学技术对抗体要求较高,高效价抗血清难以制备,容易出现交叉反应,影响鉴定的可靠性[63]。同细胞培养技术相比较,免疫学技术具有灵敏性和特异性高、假阳性率低、部分手段不依赖仪器设备、适用环境广等优点,特异性诊断产品研发之后具有极高的推广应用价值。陈桂花等[64]以 IPNV ChRtm213 分离株的 VP3 序列为模板进行了原核表达,以纯化的VP3 蛋白为免疫原制备鼠抗血清,并将该血清应用到了中国不同地区的IPNV 分离株的免疫荧光检测中,对基因1 型和5 型均有识别,且对IHNV 和VHSV 无交叉反应。
2.5 分子生物学技术
分子生物学诊断技术通过细菌培养或病毒分离,进行核酸提取,根据病原的保守片段(如致病菌的16S rDNA、真菌ITS、IHNV的G基因、IPNV的VP2等)设计特异性引物,进行对数扩增,能够迅速准确地进行判断。分子生物学诊断技术包括传统的PCR、real-time PCR、LAMP 等手段,也有多重PCR、基因芯片、DNA 探针、重组酶聚合酶扩增等新型技术[65-68]。与其他诊断方法相比,分子生物学手段具有灵敏度高、特异性强、耗时短、可确认到种、手段丰富等优点,被广泛应用,如普通PCR、恒温扩增适用于高通量、基层诊断,而荧光定量PCR、DNA探针等技术适用于实验室精细化操作。吕晓楠等[65]以IHNV G 基因为靶位点,建立了逆转录重组酶介导扩增(reverse transcription recombinase-aid amplification,RT-RAA)检测技术,反应条件为恒温37 ℃,扩增时间为20 min,与传统RTPCR(约180 min)相比,更具有时效性和普遍适用性,同时在灵敏度、特异性以及准确率上与传统的RT-PCR技术基本一致。
3 免疫防控技术
目前国内鱼类疾病的控制,仍有不少从业者依赖于抗生素,但随着抗生素的使用甚至滥用,鱼类养殖面临着耐药性以及质量控制的问题,将来可能会面临着“无药可用”的状态。在挪威,从起初的单价疫苗到现在的多联疫苗,已逐渐形成一个成熟的免疫防控产业化体系,从1987 年的每吨大西洋鲑使用接近1 kg的抗生素到目前的几乎不使用抗生素,死亡率控制到5%以下[69]。疫苗接种方式有口服、浸泡、注射等多种手段,迄今为止,已报道的疫苗主要有灭活疫苗、减毒活疫苗和重组疫苗等,多联疫苗的研发亦备受主流研究机构的青睐。
3.1 灭活疫苗
灭活疫苗作为当前最为成熟的技术手段被广泛应用,通过物理或化学方法将培养的病原进行消杀灭活而成,在保持抗原免疫原性的基础上,破坏了病原体的致病性,因此安全性得到保障。由于制备方法简便、研发周期短且成本低廉,长期以来都是各类疫苗研发的首选,国内水产疫苗如弧菌、气单胞菌和草鱼呼肠弧病毒等疫苗的免疫保护性非常明显[70]。物理灭活方法(如高温法)制备的疫苗免疫保护率相对较低,通常采用化学灭活剂进行灭活。
最传统且最广泛的化学灭活剂为甲醛,具有价格低廉、易获取等优点,其对杀鲑气单胞菌、嗜冷黄杆菌肾杆菌等细菌以及IHNV、IPNV 等病毒进行灭活后均有良好的效果。但甲醛存在着一定的刺激性和致癌风险,灭活时间长且不彻底,筛选更有效的灭活剂成为研究热点[71]。β-丙内酯是甲醛的良好替代品,采用 2.7 mmol·L-1的 β-丙内酯灭活IHNV 24 h 后对虹鳟进行注射,相对保护率达90%以上,免疫时效可持续56 d[71]。刁菁等[72]则使用新型材料-纳米锌作为灭活剂,使用100 mg·L-1的纳米锌溶液制作的杀鲑气单胞菌灭活疫苗效果优于甲醛处理组,免疫保护率达86%,同时对EPC 细胞的生长及代谢无显著影响,是一种潜在的高效灭活剂。
3.2 重组疫苗
利用现代分子生物学及微生物学技术,将特定的抗原基因进行重组、表达,直接将核酸或表达的蛋白注入鱼体内进行免疫,含重组亚单位疫苗、核酸疫苗、基因缺失或突变疫苗及活载体疫苗等[73]。与传统的疫苗相比,具有成本低、无致病性、适用范围广、储存方便等优点,显示出广阔的开发和应用前景。
重组亚单位疫苗是指将保守的抗原基因进行体外表达,并将病原蛋白分离纯化制备而成。Diao等[74]将杀鲑气单胞菌的外膜蛋白OmpC、溶血素等进行重组表达,免疫保护率达80%以上,特异性抗体水平在6 周内呈持续升高趋势。但受限于大肠杆菌、酵母等表达系统的影响,通常情况下重组亚单位疫苗需添加佐剂以增强其免疫原性。
核酸疫苗一般指DNA 疫苗,指将表达主要抗原原性的基因链接到不同的载体上构建而成的重组质粒。目前国内多个研发团队针对IHNV 的G基因、IPNV 的VP2等构建了适用于不同情况的DNA 疫苗,效果良好,其中,徐黎明等[75-77]构建的IHN DNA 疫苗(pIHNchG)在黑龙江省已完成中间试验,提交了环境释放申报材料。但由于进入体内的质粒不可控,它将持续在体内进行表达并释放到环境中,缺乏与风险相关的基础研究,出于安全性考虑,一些国家(如挪威)禁止使用DNA疫苗。
相较于核酸疫苗及亚单位疫苗,基因缺失或突变疫苗及活载体疫苗受限于研发成本及难度,相关研究较少,20世纪90年代由欧洲学者最先报道的基因突变疫苗及活载体疫苗均为杀鲑气单胞菌疫苗。李守湖等[78]运用腺病毒作为载体,利用IHNV G蛋白完成了重组腺病毒的构建,制备而成的活载体疫苗,通过浸泡的方式进行免疫,免疫保护率达90%以上,免疫持续期达6个月。
3.3 多联疫苗
多联疫苗即经一次免疫可同时抵抗2 种或2种以上病原感染,避免重复接种造成的机械损伤,多联疫苗的研发对鲑鳟鱼养殖业的健康可持续发展极为重要。由于鲑鳟鱼类养殖过程中经常发生诸如杀鲑气单胞菌、IHNV 等不同病原引起的疾病交叉,挪威已经研发出针对弧菌病、疖疮病和肠炎等多种病害的六联、七联疫苗[79]。国内的鲑鳟鱼养殖业起步较晚,相关多联疫苗的研发相对滞后,2017 年国内研发团队构建了IHNV 和IPNV 的二价核酸疫苗,可以对IHNV 和IPNV 的交叉感染具有显著作用,累积死亡率低于7%[80]。
3.4 佐剂
高度纯化的疫苗成分通常缺乏病原相关分子模式,不能有效激活先天免疫应答而发生有效的免疫反应,从而造成免疫保护效果不佳,需要配合佐剂使用。理想的佐剂须具备良好的免疫活性、稳定且清晰的化学结构、能够显著提高疫苗的免疫保护率和持久性,同时兼顾价格和副作用。佐剂的分类方法众说纷纭,在鲑鳟鱼疫苗中如弗氏佐剂、Seppic 公司的 ISA763 和 IMS1312 等含油佐剂应用最广,采用油包水的方式将疫苗包裹在内部用于注射,其他常用佐剂有铝盐佐剂、葡聚糖、脂多糖、皂苷、细胞因子、蜂胶等[81-84]。刘帅[83]使用蜂胶和弗氏完全2 种佐剂混合杀鲑气单胞菌疫苗对虹鳟进行接种,攻毒14 d 后免疫保护率分别为90%和85%,均高于纯疫苗接种组,说明佐剂的使用能有效提高疫苗的保护作用,而副作用方面的研究结果表明蜂胶佐剂不会对鱼体造成损害,更适于生产应用。
4 展望
目前,我国鲑鳟鱼的养殖规模仍小于挪威、智利等主产国,但随着国民生活水平的不断提高,人民对优质蛋白质的需求不断加大,国内科技力量对于鲑鳟鱼类养殖不断投入,有效地促进了产业的发展。伴随着我国东北、西南、西北、华北以及黄海冷水团等地鲑鳟鱼产业的迅猛发展,国内科技力量的联合攻关,我国水生动物疫病及免疫学研究近年来获得了长足的进步。与此同时,国内对于鲑鳟鱼类疫病的研究和防控体系建设方面仍落后于挪威等国。流行疫病基础理论研究仍有欠缺,部分疫病的致病机理、传播途径以及机体响应机制尚不明确,我国仍存在着病原变异、外源疫病输入等风险,而流行病学调查的重要性则容易被忽略,导致研究水平滞后于疫病暴发情况。
伴随着免疫学和分子生物学的发展,如胶体金技术、恒温扩增技术等广泛开发和推广应用,将突破实验条件限制,能够迅速、准确进行现场判断,结合更加科学的实验室检验,能够让诊断技术更好的为产业服务。
国内鲑鳟鱼适用的预防接种处于“九龙治水”阶段,多为自家疫苗,商品化疫苗仍未实现零的突破,与国外的商品化多联疫苗仍存在不小差距。同时接种手段、注射疫苗后的器官黏连、佐剂配伍以及小规格鱼苗的预防接种方案等难题仍困扰着科研人员,科学预防体系任重道远。因病原的耐药性问题以及药物限用,将来可能会面临着发病后无药可用的状态,科学防控尤为重要,充分利用诊断技术将疫情控制,通过免疫接种预防将成为主流手段,具有无可比拟的优势和发展前景。
