丹参提取工艺过程中糖类成分变化趋势△
2021-08-05周立红周梦鸽齐敏超杨哲萱刘朋章顺楠朱永宏王涛
周立红,周梦鸽,齐敏超,杨哲萱,刘朋,章顺楠*,朱永宏,王涛
1.天津中医药大学,天津 300193;2.天士力医药集团股份有限公司 中药先进制造技术国家地方联合工程实验室,天津 300410
丹参是唇形科植物丹参SalviamiltiorrhizaBunge的干燥根及根茎,具有活血化瘀、通经止痛、清心除烦、凉血消痛的功效[1]。丹参提取物能够从心肌缺血的不同阶段发挥保护作用[2],可以降低心肌缺血诱导因子的产生[3]、舒张血管[4]、提高心肌代谢效率[5]、降低心肌细胞凋亡率,达到保护受损心肌的作用[6]。
《药品生产质量管理规范》(GMP)2010年版明确指出,中药制剂的质量与中药提取工艺密切相关,因而,对中药提取过程建立过程控制标准、提高批次间质量一致性是保证中药产品质量提升的关键点之一。水提液醇沉工艺是中药提取精制的传统手段,较高的乙醇体积分数可以去除蛋白质、鞣质、水溶性色素等杂质,还包括大分子的多糖类成分[7]。丹参提取物是丹参药材经水提醇沉多道工序得来的中成药原料。已知糖类成分总量占丹参提取物总量的50%左右,经过高效凝胶渗透色谱法(HPGPC)分析表明,其中糖类成分相对分子质量在2000以下,属于单糖和低聚糖[5]。糖类成分在整个提取工艺过程中总量占比最高,性质相对稳定,因而对提取工艺过程中糖类成分变化趋势的研究,有助于加深对提取工艺过程的理解,提高工艺控制水平。
糖类成分的含量检测方法有苯酚-浓硫酸的比色法、柱前衍生化法、HPLC-示差检测器法、高效液相色谱-蒸发光散射检测法(HPLC-ELSD)等。其中,苯酚-硫酸法专属性较差,而且只能做总糖测定,不能测定糖类成分组成[8];柱前衍生化法操作步骤繁琐[8];示差折光检测器的灵敏度低、平衡时间长[9];HPLC则用时较长[10]。本研究建立了超高效液相色谱-蒸发光散射检测法(UPLC-ELSD),采用Waters UPLC-BEH amide色谱柱,有效去除其他物质干扰,在15 min内完成对丹参提取物中果糖、葡萄糖、蔗糖、棉子糖、水苏糖5种糖的含量测定,该方法更加简便、快捷。
1 材料
1.1 仪器
Waters超高效液相色谱仪,包括蒸发光检测器(ELSD)、Empower 3 化学工作站等;XS205型电子天平(瑞士梅特勒-托利多公司)。
1.2 试药
标准品果糖(批号:059K00681V,纯度:100%)、葡萄糖(批号:059K00681V,纯度:99.5%)、蔗糖(批号:090M02112V,纯度:99.5%)、棉籽糖(批号:BCBH6893V,纯度:99%)、水苏糖(批号:MKBL6314V,纯度:98%)均购于Sigma公司;乙腈(默克公司,色谱纯);三乙胺(Sigma公司,纯度:99.5%);甲醇[利安隆博华(天津)医药化学有限公司,分析纯];水为实验室自制。
丹参提取物(丹参素质量分数≥3%)由天士力医药集团股份有限公司提供。
2 方法与结果
2.1 检测方法
色谱条件:ACQUITY UPLC BEH Amide色谱柱(100 mm×2.1 mm,1.7 μm);柱温:35 ℃;样品室温度:20 ℃;流动相:乙腈-水(67∶33,含0.2%三乙胺);流速:0.11 mL·min-1;进样量:1 μL。蒸发光检测器增益:200;载气压力:241.316 Pa;漂移管温度:50 ℃;雾化器参数65%。
对照品溶液的制备:取果糖约0.080 g、葡萄糖约0.050 g、蔗糖约0.360 g、棉子糖约0.088 g、水苏糖约1.000 g,精密称定,置50 mL量瓶中,加纯化水溶解并稀释至刻度,摇匀。取5 mL置25 mL量瓶中,加纯化水溶解并稀释至刻度,摇匀,即得对照品储备液。精密量取上述对照品储备液3 mL,置10 mL量瓶中,加纯化水溶解并稀释至刻度,摇匀,得对照品混合溶液1。精密量取上述对照品储备液7 mL,置10 mL量瓶中,加纯化水溶解并稀释至刻度,摇匀,即得对照品混合溶液2。
供试品溶液的制备:精密称取丹参提取物约0.4 g,置10 mL量瓶中,加纯化水适量,超声使溶解,放冷,定容至刻度,摇匀,精密量取2 mL上至已处理好的固相萃取小柱[Cleanert PS-SPE,1000 mg·(6 mL)-1,甲醇20 mL,水20 mL活化],用纯化水以0.1 mL·min-1的速度洗涤,收集全部洗脱液至10 mL量瓶,加纯化水至刻度,摇匀,即得。
测定法:将供试品溶液和对照品混合溶液1、对照品混合溶液2分别进样1 μL,见图1,采用外标两点法计算供试品中各成分含量。

注:A.对照品;B.供试品;1.果糖;2.葡萄糖;3.蔗糖;4.棉子糖;5.水苏糖。图1 对照品及丹参提取物糖成分色谱图
外标两点法对数方程:Y=KX+b,其中,Y=lgC,X=lgA。
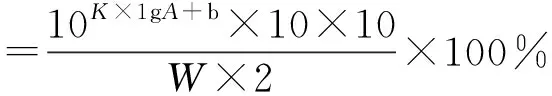
(1)
式中,K为外标两点法对数方程斜率;A为峰面积;b为外标两点法对数方程截距;W为称样量。
2.2 样品含量测定
应用所建立的UPLC-ELSD,测定19批不同年份生产规模的丹参提取物糖类成分含量。从表1中数据可以看出,丹参提取物中含量最高的寡糖成分是水苏糖(四糖),其次是蔗糖、果糖、葡萄糖和棉子糖,且各个样品中5种糖类成分含量差异较小。

表1 丹参提取物糖类组分含量测定结果 %
2.3 提取过程中糖类成分转移率
取3个不同批次的丹参提取工艺过程中间体(提取液、浓缩液、醇沉上清液、稀浸膏),按照2.1项下方法测定各个样品的5种糖类成分含量,并通过每个工艺节点总量计算各糖类成分质量分数(表2),同时计算提取工艺中各工序糖类成分的转移率(各工序所测糖总量与提取工序获得相应糖总量百分比),结果见图2。
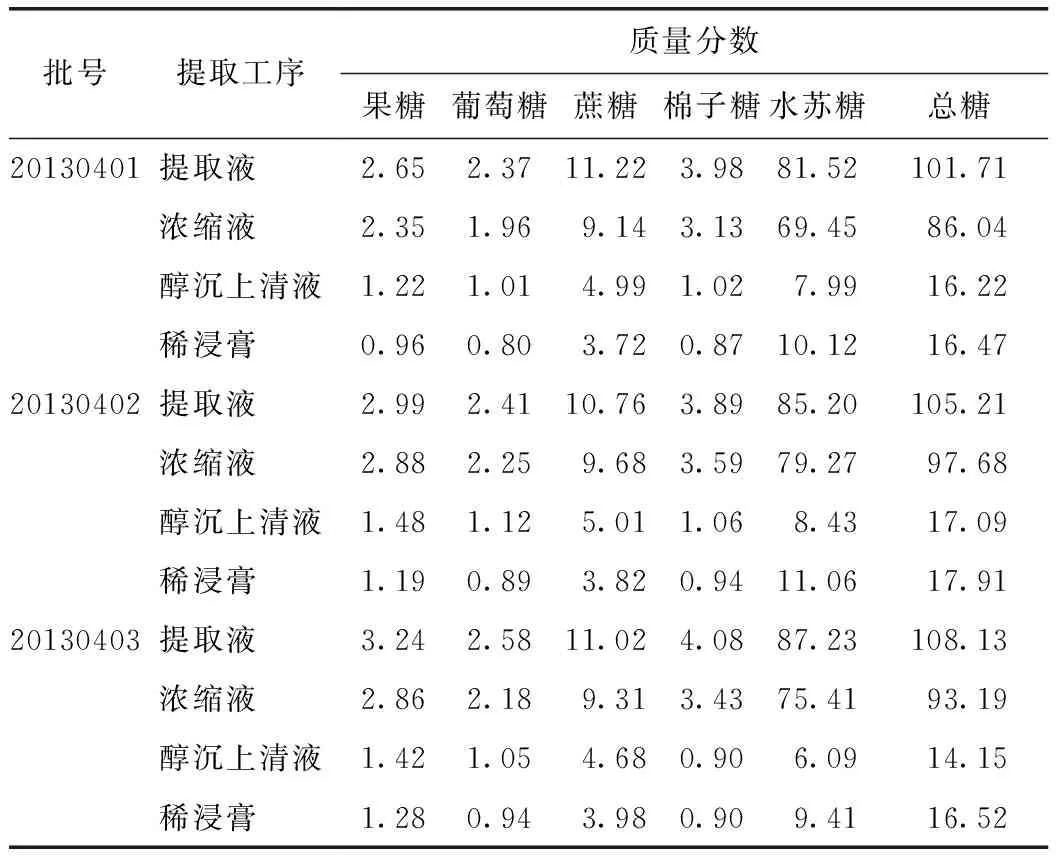
表2 丹参提取工艺过程中间体糖类成分质量分数 %
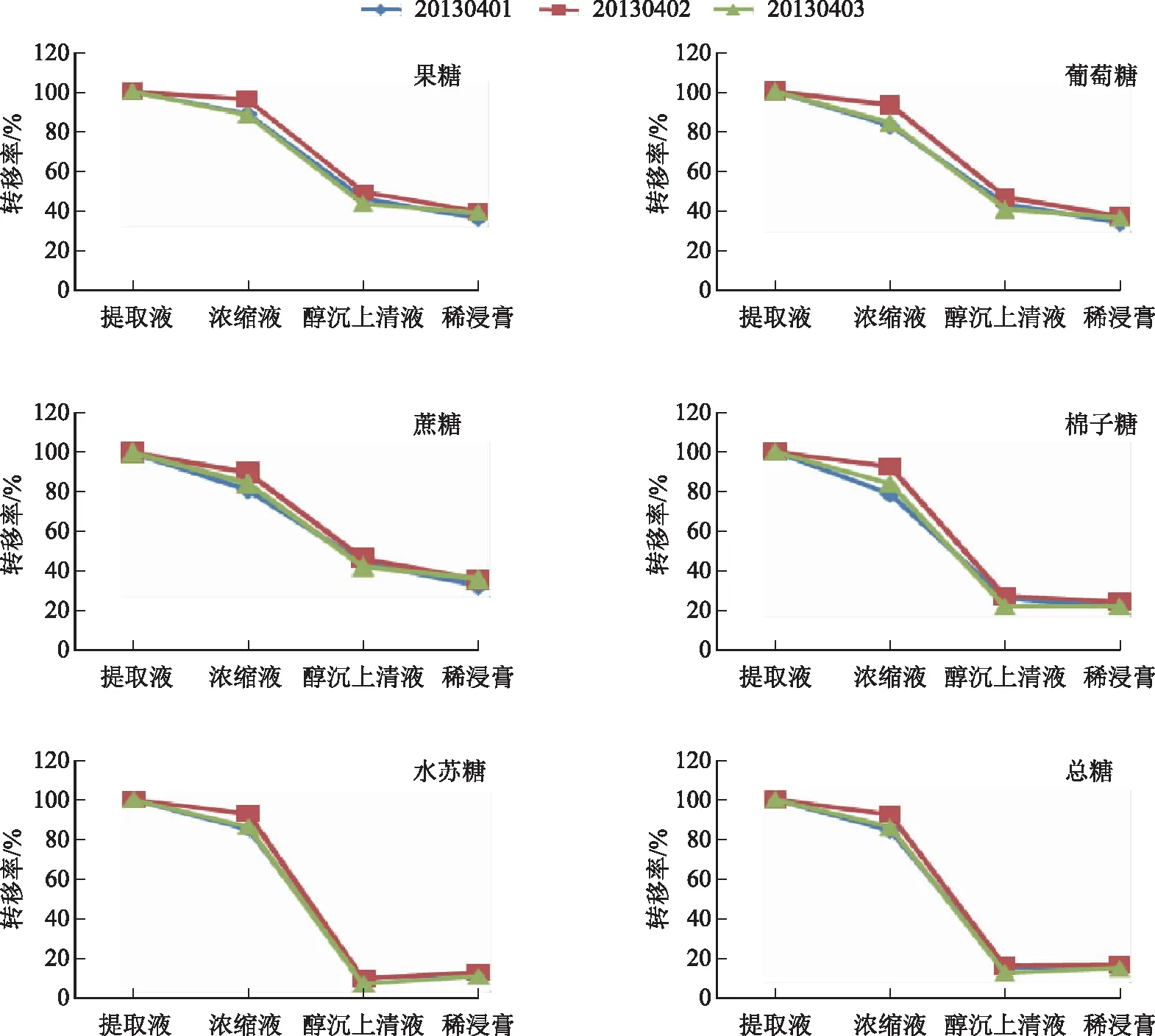
图2 糖类成分在提取过程中的转移率
数据结果分析发现,在提取工艺过程中不同批次的糖类成分的变化趋势一致,总量均为明显下降趋势,而且在醇沉工序下降幅度最大,见图2。在醇沉工序糖类成分转移率与相对分子质量关系直观图可以看出(图3),单糖(果糖、葡萄糖)、二糖(蔗糖)转移率相当,分别为38.51%、36.41%、34.92%;但随着相对分子质量的增加,转移率下降明显,其中水苏糖(四糖)的转移率最低,平均仅为12.06%。

图3 不同相对分子质量糖成分醇沉工序转移率
2.4 醇沉方式对糖类成分转移率影响
由于醇沉工序是影响糖成分的关键步骤,因此,醇沉方式也可能影响醇沉效果,从而影响终产品的质量一致性。考察2种醇沉方式对丹参提取物糖成分含量的影响,一种为以表观醇度判定终点法,即少量逐次加入乙醇;另一种方式为通过计算一次性倍量加入乙醇,两者乙醇加入总量相当。分别对30批次丹参提取物5种糖含量进行检测。组间比较采用单因素方差分析(One-way ANOVA)并以t检验。统计结果见表3,两者总糖含量差异有统计学意义(P<0.001),平均质量分数分别为39.92%、34.44%;其中,果糖(单糖,P<0.01)和水苏糖(四糖,P<0.001)2种成分含量差异有统计学意义,以表观醇度判定终点法为醇沉方式得到的提取物中水苏糖含量较高,而倍量乙醇加入法果糖含量较高。总体上,倍量乙醇加入法的组内差异RSD较小。2种醇沉方式各批次提取物糖含量分布见图4。

表3 不同醇沉方式对丹参提取物中糖成分含量影响 %

图4 不同醇沉方式对多批次丹参提取物糖成分含量分布的影响
3 讨论
多个生产批次含量考察结果可以看出,丹参提取物中糖类成分含量波动较小;提取物总量与糖类成分总量进行相关性分析,结果相关性在0.9以上。且5种糖类成分在丹参提取工艺过程中均表现稳定,尤其是水苏糖含量最高,因此其能够很好地作为提取工艺过程质量一致性的表征。
在提取工艺过程中间体的糖类成分研究中发现,多批次样品糖类成分在整个提取工艺过程中变化一致,整体呈下降趋势,醇沉过程下降最为明显,表明醇沉工序是影响糖含量的关键工序。很多研究已表明,醇沉醇度与糖类成分转移率相关性最强,与相对分子质量呈反比[11];即醇沉工艺能够用以去除大相对分子质量的糖类成分。这对纯化中药有效成分、提高治疗效果及揭示药效物质基础、确保质量一致性至关重要[12]。本研究中糖成分转移率与相对分子质量分布情况也验证了上述趋势,小相对分子质量的单糖、二糖转移率相当,三糖、四糖则随着相对分子质量的增加转移率趋于降低,且下降明显,这与糖在介质中溶解度差异有很大的关系[13]。
本研究醇沉方式考察也表明,不同方式影响不同相对分子质量糖成分的转移率,而水苏糖相对分子质量最大,含量也最高,显示了与总糖含量与波动一致性现象。再者,即使加醇量一致,不同的放入方式也会影响总糖与单成分的含量和波动,这与过程中温度、工序时间及过程中成分在料液中的溶解行为有关,应该综合考虑工艺参数的设计以提高工艺过程控制能力[14];糖类成分可以作为醇沉工艺控制能力的表征。
