不可或缺,还是无足轻重
——胃癌新辅助化疗争议的探讨
2021-08-05朱晓东陈思元
朱晓东 陈思元
(复旦大学附属肿瘤医院肿瘤内科-复旦大学上海医学院肿瘤学系 上海 200032)
胃癌位列全球癌症发病率第五位、死亡率第三位[1]。中国国家癌症中心2019年癌症报告显示,2015年我国胃癌发病率为29.31/10万,位列第二;死亡率为21.16/10万,位列第三[2-3]。胃癌患者的总生存时间与其分期密切相关,亚洲国家Ⅱ期胃癌的5年生存率达70%,但Ⅲ~Ⅳ期患者5年生存率急剧下降。目前,我国初治胃癌约80%属于进展期和晚期[4-5],5年生存率35.9%,而日本和韩国胃癌的5年生存率分别为60.3%和68.9%[6]。这与中国早期胃癌的诊治率(<20%)远低于日本(70%)和韩国(50%)有关[7]。早期诊断和治疗是提高胃癌患者生存的重要途径,但考虑到我国胃癌早筛早诊尚处发展阶段,早诊率短期内无法显著提高,我国胃癌患者5年生存率的提高很大程度上取决于如何使进展期胃癌患者生存得到提高。
对于进展期胃癌,根治性R0切除术是唯一的治愈手段,根治术的完成度对生存期有至关重要的影响。我国胃肠肿瘤外科联盟的数据显示,2014—2016年接受胃癌手术治疗的患者中,19.5%为早期胃癌,70.8%为进展期胃癌,9.7%为晚期胃癌[8],可见外科手术在进展期胃癌中的重要地位。因此提高进展期胃癌的R0切除率,从而提高胃癌治愈率,延长总生存时间(overall survival,OS)和无病生存时间(disease free survival,DFS)是进展期胃癌研究关注的重点之一。在给定的区域,若手术水平稳定,胃癌分期构成比恒定的情况下,增加有效的术前干预手段是提高R0切除率最常见的策略。
新辅助治疗/围手术期化疗新辅助治疗是对可切除的肿瘤在术前给予的综合治疗措施,通常包括化疗、放疗或放化疗,在头颈部肿瘤、乳腺癌、直肠癌等恶性肿瘤中取得了巨大成功。新辅助治疗能较早开始全身治疗,利于控制和消灭微小转移灶;帮助指导术后方案选择[9];使治疗期间迅速进展转移的不宜手术患者避免了无意义的手术。
胃癌新辅助治疗的发展历程
(1)围手术期化疗对比单纯手术的经典研究发表于2006年的英国MAGIC研究[10]是胃癌新辅助化疗发展的里程碑,该研究首次表明,在可切除胃癌、食管胃交界处癌(G/GEJ)或下段食管癌患者中,与单纯手术对比,手术联合围手术期ECF方案化疗(表柔比星+顺铂+氟尿嘧啶)显著延长患者生存,5年OS提 高13.3%(36.3%vs.23.0%,P=0.009)。之后,法国的随机对照FNCLCC/FFCD 9703试验[11]也证实围手术期PF方案(氟尿嘧啶联合顺铂)对比单纯手术可显著改善胃食管癌患者生存时间,5年OS提高14%(38%vs.24%,P<0.02)。MAGIC研究和FFCD 9703试验确立了围手术期化疗在欧洲国家进展期胃癌治疗中的重要地位。
(2)提高围术期化疗强度的研究ECF系列方案成为围手术期治疗标准后,德国学者致力于探索提高化疗强度以进一步提高疗效。FLOT4-AIO研究对比了FLOT方案(氟尿嘧啶+奥沙利铂联合多西他赛)及ECF/ECX方案(表柔比星+顺铂+氟尿嘧啶滴注或口服卡培他滨)围手术期化疗的差异[12-13],证实FLOT方案中位DFS(30个月vs.18个月,P=0.0036)和中位OS(50个月vs.35个月,P=0.012)均显著优于ECF/ECX方案。
由于两药联合方案疗效及安全性数据的积累,及OE05等研究中蒽环类联合方案并未优于CF方案[14],且含蒽环类方案不良事件较多,2016年NCCN指南将ECF和改良ECF方案从1类证据降级为2B类证据,不再作为新辅助化疗的首选方案。2018年V1版进一步更新:肯定了氟尿嘧啶和奥沙利铂的首选地位,增加FLOT方案为1类推荐,去除ECF和改 良ECF方案[15]。
围手术期化疗与辅助化疗尽管高级别的证据已证实围手术期化疗较单纯手术的生存优势,但是否优于手术联合辅助化疗并不明确。ACTS-GC研 究[16]中S-1单药辅助 治 疗的5年OS较单 纯 手术提高10.6%(71.7%vs.61.1%),CLASSIC研究[17]中XELOX辅 助 化 疗5年OS提 高9%(78%vs.69%)。仅从5年OS数据来看,似乎即使单纯手术组也均优于MAGIC(36.3%)、FNCLCC/FFCD 9703(38%)和FLOT4-AIO(45%)研究中围手术化疗方案组。但需注意的是,以上两类研究入组人群存在极大差异,两项亚洲的术后辅助化疗研究人群均为完成D2根治术、术中腹腔灌洗液游离癌细胞阴性、确证达到R0切除的患者,而围手术期化疗研究中包含影像学评估可切除但实际未完成根治术的患者,这部分人群会大大拉低总体生存数据。因此,单纯从数值上比较术后辅助化疗同围手术期化疗的生存数据并不合理。
围手术期/术前化疗对比辅助化疗的研究尽管ACT-GC和CLASSIC研究后,D2根治术后辅助化疗已成为亚洲进展期胃癌的标准治疗,但在新辅助化疗方面的探索也从未停止,只是多为小样本的Ⅱ期单臂试验[18-21]。直到近几年,亚洲陆续报道了几项大型Ⅲ期研究,旨在探索围手术期化疗是否优于手术联合辅助化疗模式。
(1)术后替吉奥(S-1)单药辅助化疗基础上增加术前化疗的研究2018年报道的日本Ⅲ期JCOG 0501研究[22-23],针对Borrmann 4型和直径≥8 cm的巨大3型临床可切除胃癌,新辅助化疗组术前给予两周期S-1和顺铂(SP)方案,两组术后方案均为S-1辅助化疗1年。遗憾的是,SP新辅助化疗对比辅助化疗未能改善患者生存(3年OS:60.9%vs.62.4%)。
2019年 韩国PRODIGY研究[24]中G/GEJ癌 患者随机接受多西他赛加奥沙利铂加S-1(DOS)新辅助化疗及术后S-1辅助化疗或单纯手术加S-1辅助化疗。该研究达到首要终点,新辅助化疗显著改善患者3年DFS(66.3%vs.60.2%,P=0.023),亚组分析显示临床ⅢB及ⅢC期获益更显著,但总体OS差异无统计学意义(P=0.3383)。(2)围手术期化疗对比术后辅助化疗的研究三臂RESOLVE试验是迄今为止我国最大的胃癌新辅助化疗对比术后辅助化疗的研究[25],主要目的之一是评估SOX围手术期化疗对比XELOX辅助化疗的优效性,首要终点3年DFS以SOX围手术期化疗显著优于XELOX辅助化疗(P=0.045),但同SOX术后辅助化疗相比,差异无统计学意义。总体OS结果尚未公布。
国内另一项RESONANCE研究早期结果也在2020年初公布[26],其研究设计与RESOLVE研究相似,旨在评估SOX围手术期化疗对比SOX辅助化疗在G/GEJ癌患者中的疗效。初步结果显示了SOX新辅助化疗组优越的R0切除率和病理完全缓解(pathologic complete remission,pCR)率,生存结果仍在随访中。
围手术期/术前化疗对比术后辅助治疗的优劣势分析纵观胃癌围手术期/术前新辅助化疗的发展(表1),虽然术前化疗有一些优势,但总体获益仍值得探讨。我们对术前化疗的利弊进行下权衡。
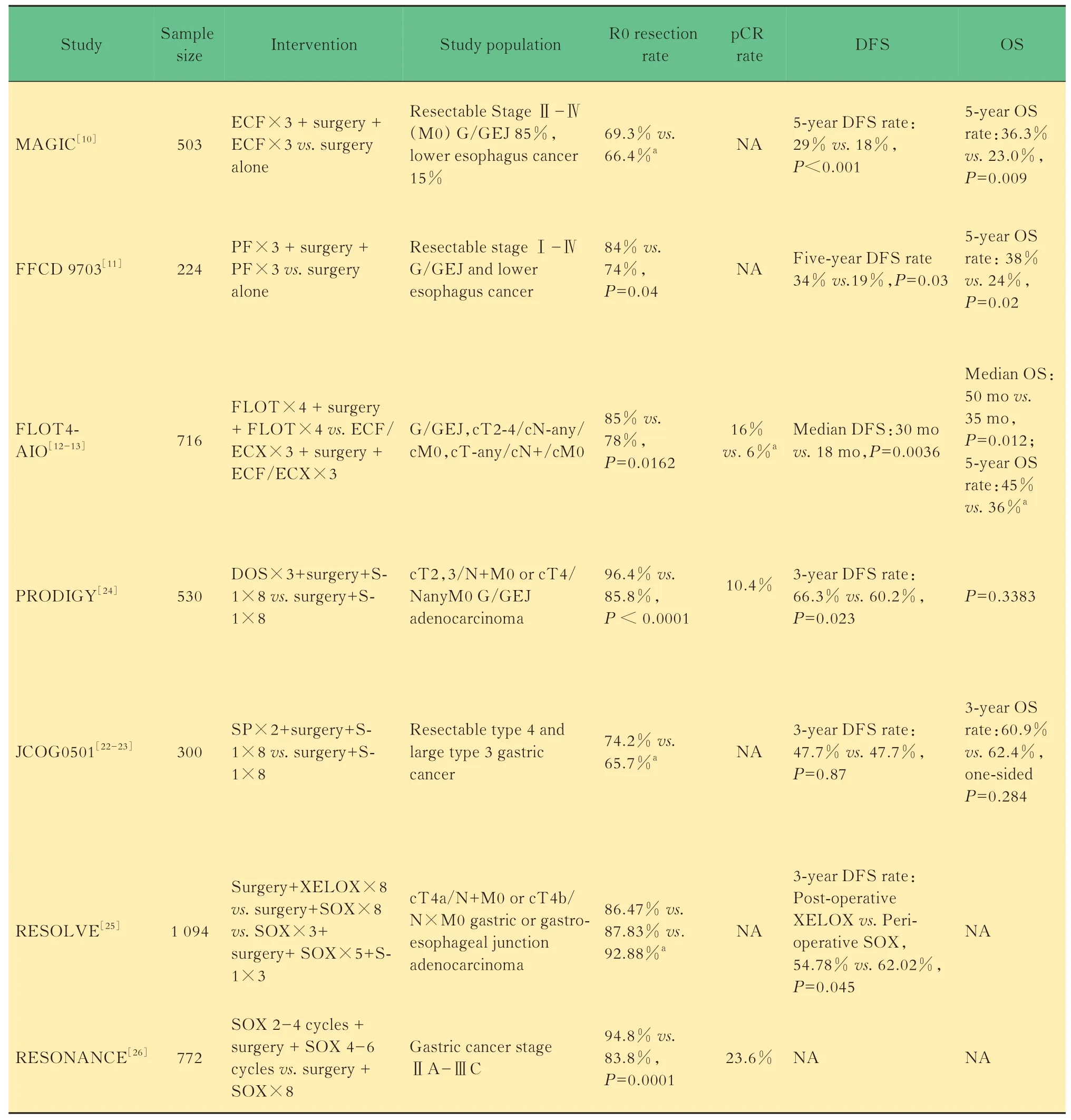
表1 胃癌围手术期化疗/新辅助化疗的重要Ⅲ期临床研究汇总Tab 1 Summary of important phaseⅢclinical trials of perioperative chemotherapy/neoadjuvant chemotherapy for gastric cancer
术前化疗优势
(1)降期MAGIC研究中,术前化疗较直接手术组显著降低T分期(≤T2:51.7%vs.36.8%,P=0.002)和N分期(≤N1:84.4%vs.70.5%,P=0.01)。FFCD 9703研究同样观察到降期趋势尤其是N(N0:33%vs.20%)分期。PRODIGY研究DOS方案带来了10.4%的pCR率。JCOG0501研究新辅助化疗使51.0%的患者肿瘤退缩超1/3。RESOLVE研究中SOX新辅助化疗对比XELOX及SOX辅助化疗T分期(≤T2:25.61%vs.10.54%vs.11.07%,P<0.001)和N分 期(N0:37.71%vs.16.93%vs.20.25%,P<0.001)显著降低。RESONANCE研究中患者降期率为46.4%,pI期比例显著提高(47.6%vs.6.6%)。FLOT4-AIO研 究 中,FLOT方 案 组ypT1分期的比例更高(25%vs.15%,P=0.0008)。说明术前化疗降期确切,且高强度方案降期似更明显。
(2)提高R0切除率新辅助化疗后降期可提高R0切除率,FFCD 9703(84%vs.74%,P<0.04)、PRODIGY(96.4%vs.85.8%,P<0.0001)和RESONANCE(94.8%vs.83.8%,P=0.0001)研 究中R0切除率改善均有统计学意义,提升均在10%左 右。MAGIC(69.3%vs.66.4%)、JCOG0501(74.2%vs.65.7%)和RESOLVE(92.88%vs.86.47%)研究中R0切除率也有提高趋势。说明术前化疗能提高R0切除率,而FLOT4-AIO的数据(85%vs.78%,P=0.0162)提示化疗强度提高似能进一步提高R0切除率。
(3)术前化疗完成度更高MAGIC研究中,围手术期化疗组相同方案术前化疗完成度高于术后化疗(86%vs.41.6%),FFCD 9703研究也观察到相同结果,围手术期术前化疗≥2周期完成度为87%,相同方案术后化疗≥3周期完成度仅为36%。如果说这两项研究术后化疗完成度低可能与接受过术前 化 疗 有 关,RESOLVE和RESONANCE研 究 则更清晰地展示了围手术期化疗较术后辅助化疗有更高的完成度。RESOLVE研究中SOX围手术化疗组术前完成度为61.42%,术后化疗≥4周期完成度为61.72%,而XELOX、SOX术后辅助化疗组≥4周期完成度分别只有44.93%和42.65%。RESONANCE研究中围手术期化疗整体完成度也高于辅助化疗(53.2%vs.47.7%),其中术前完成度达91.9%。PRODIGY和JCOG0501则证明,与术后单药S-1辅助化疗对比,术前较强的化疗方案完成度也更高。PRODIGY研究显示,围手术期化疗组术前DOS、术后S-1完成度分别为89.9%和83.3%,而S-1辅助化疗组完成度为84.0%。JCOG0501研究中围手术期化疗术前SP和术后S-1完成度分别为86.8%和63.4%,S-1辅助化疗组完成度为66.0%。可见,术前患者体能状况较佳,化疗完成度较术后更高,且更能耐受强度较大的化疗。
术前化疗劣势
(1)过度治疗新辅助治疗存在因过度分期导致过度治疗的风险。目前pT1N0及低危pT2N0的胃癌患者术后辅助化疗并无确切获益证据,所以无需辅助化疗。这些患者接受新辅助治疗则导致过度治疗。MAGIC研究中,单纯手术组pT1比例为8.3%,pN0为26.9%,基于入组平衡,估算围手术期化疗组有近10%的患者过度治疗。FFCD 9703研究中,单纯手术组pT1-2和pN0患者分别占32%和20%,保守估计过度治疗比例近10%。RESOLVE研究中XELOX和SOX辅助化疗组T1比例分别为3.51%和4.11%,N0比 例 分 别 为16.93%和20.25%,估计过度治疗比例超过5%。PRODIGY研究中,术后辅助化疗组pⅠ期占11%,RESONANCE研究中该比例为6.6%,基于组间平衡推断新辅助化疗组也包含相当百分比的Ⅰ期患者。总体来看,新辅助化疗可能带来5%~10%的过度治疗,若选择T分期及N分期较高的患者,则过度治疗的风险会降低。
(2)延误手术新辅助治疗的另一顾虑是延误手术。MAGIC研究中,围手术化疗组未接受手术患者比例略高于单纯手术组(6.1%vs.2.4%)。FFCD 9703研究中围手术化疗组未手术比例为3.5%(4/113),其中3例为疾病进展的不宜手术患者,单纯手术组中0.9%未接受手术。PRODIGY研究中,围手术期化疗组6.7%的患者未接受手术,可能与术前2.1%的患者疾病进展有关,辅助化疗组手术率为100%。JCOG0501研究围手术期化疗组未手术比例也高于辅助化疗组(7.95%vs.1.34%),3.3%(5例)的患者为疾病进展不宜手术。RESOLVE研究中围手术期化疗组未手术比例为13.65%,高于XELOX(2.61%)和SOX(3.24%)辅助化疗组,细节暂不详。但并非所有研究中新辅助化疗后未手术比例都更高,如RESONANCE研究围手术期化疗组未手术比例就略低于辅助化疗组(2.1%vs.3.5%)。另 外,FLOT4-AIO研 究 中FLOT组和ECX/ECF组的未手术率都很低(3.1%vs.5.3%)。总体来说,新辅助化疗导致部分患者未能按计划接受手术,但也使快速进展为远处转移的患者避免了无意义手术,除去这部分患者,手术延误比例整体较低。所以,密切复查评估以发现那些疾病进展且无远处转移的患者并及时手术能最大化降低新辅助化疗延误手术的风险。
(3)是否增加手术并发症在PRODIGY、JCOG0501、RESOLVE和RESONANCE的 研 究中,围手术期治疗模式均未增加手术相关并发症,与辅助化疗模式相比,术后30天死亡率、住院时间及其他并发症差异均无统计学意义。
新辅助治疗/围手术期化疗的权衡从上述研究可见:新辅助化疗和术后辅助化疗对OS的确切获益尚未被证实,但PRODIGY和RESOLVE研究已证明围手术期化疗能改善DFS,JCOG0501研究在非印戒细胞癌中发现,新辅助化疗有获益趋势(3年OS率:74.2%vs.62.3%)。总体而言,围手术期化疗与辅助化疗的生存相当或呈现提高趋势。综上所述,新辅助化疗有降期和提高R0切除率的优势,可使临界可切除或R0切除存在困难的患者提高根治率,且术前化疗完成度更高、不增加手术并发症,如果能控制过度治疗和延误手术的风险,围术期化疗将成为进展期胃癌患者的优选策略。
最后,比较东西方的围术期研究。胃癌新辅助化疗后最终是否达到R0切除与以下因素相关:(1)胃癌分期;(2)术前化疗疗效(部分和化疗强度有关);(3)手术技术水平。就当前资料而言,东方国家的D2根治技术水平整体优于西方国家,因而部分西方国家完不成的根治术可能在东方国家完成(图1)。分期较早的患者,无需降期直接手术即能够达到D2根治,此时新辅助治疗获益有限,术后按病理分期决定是否辅助化疗,能避免过度治疗及延误手术的风险。分期相对较晚的患者,新辅助化疗将肿瘤退缩至可R0切除的状态,提高了根治率,同时过度治疗及延误的手术风险也比较低,可扬长避短。由于手术技术方面的原因,欧美国家新辅助化疗能够获益的人群相对亚洲国家会广泛。而分期过晚的患者,即使很强的术前化疗也不能逆转无法R0切除的状态,同样获益有限。可见新辅助治疗对早期胃癌患者可能是画蛇添足,但对偏晚的患者则是雪中送炭,难点在于度的把握。
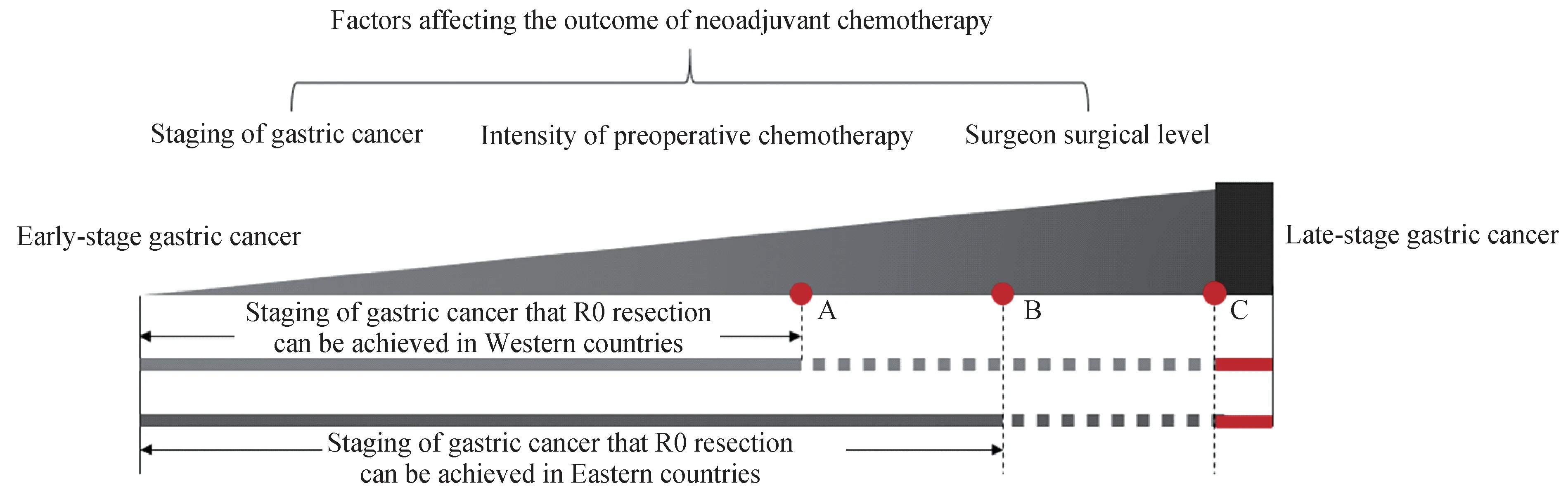
图1 影响新辅助化疗结局的因素Fig 1 Factors affecting the outcome of neoadjuvant chemotherapy
我们从国内外各大指南对新辅助化疗的不同推荐人群中可体会到东西方的差异:欧洲ESMO胃癌指南推荐>T1N0的患者接受新辅助化疗[27];美国NCCN指南推荐T2-4/N0-3/M0的进展期胃癌首选新辅助化疗[28];中国临床肿瘤学会(CSCO)胃癌指南1级推荐T3-4a/N1-3/M0食管胃结合部癌进行新辅助化疗[29];而日本《胃癌治疗指南》仅推荐新辅助化疗用于高度淋巴结转移的可切除患者[30]。
结语近年胃癌新辅助化疗越来越受到关注,与单纯手术相比,新辅助化疗有生存获益;与术后辅助化疗相比,新辅助化疗的总生存获益虽暂未确定,但降期、提高R0切除率、更好的化疗完成度是明确的,同时可能存在过度治疗和一定程度延误手术的风险。在分期偏晚(尤其是T3-4N+)的进展期胃癌中,新辅助化疗更有可能扬长避短、提高获益。如何避免画蛇添足,真正做到雪中送炭,对度的把握是一门艺术。
随着靶向和免疫治疗药物的发展,各种术前联合方案也在积极探索中。新辅助化疗正在往愈发高效、精准和联合免疫的方向发展。RAMSES/FLOT7研究显示术前FLOT联合雷莫芦单抗可进一步提高食管胃癌的R0切除率[31];DANTE研究将FLOT与阿替利株单抗(atezolizumab)联合使用,提示安全性可行[32]。HER2阳性胃癌中,FLOT+曲妥珠单抗+帕妥珠单抗显示出较高的pCR率[33],化疗+抗HER2联合免疫治疗的强强联合模式也初步展现了出色的客观缓解率(objective response rate,ORR)和疾病控制率[34-35]。可见未来胃癌新辅助化疗一定是在精准医疗的指导下,合理联合化疗、靶向治疗和免疫治疗,以寻求术前治疗疗效最大化,最大程度提高胃癌根治率,延长患者生存。
致谢感谢前赛诺菲医学部陈萌在收集和整理数据中提供帮助。
作者贡献声明朱晓东文章结构设计,数据获取和分析解读,论文撰写和修订。陈思元数据获取和分析解读,论文撰写和修订,制图。
利益冲突声明所有作者均声明不存在利益冲突。
