水中痕量氨的显色法测定及干扰分析
2021-08-05李远刚李华静周安宁梁耀东
李远刚,杨 容,陈 永,李华静,周安宁,梁耀东
(西安科技大学 化学与化工学院,陕西 西安 710054)
0 引 言
从氨基酸、多肽到功能蛋白,氮是所有生物体构建各种功能分子的基本元素,从大气中固定N2合成NH3是维持生命必不可少的过程[1]。工业上,将N2还原为NH3的Haber-Bosch工艺是当今化工的基本支柱之一。该工艺是在相对苛刻的条件下(200~400 bars,400~500 ℃)通过铁基催化剂协同活化实现的,反应原料H2通常是通过蒸汽甲烷重整(SMR)或水煤气变换反应(WGS)得到的,而SMR和WGS过程不可避免地会消耗大量化石燃料同时也排放大量CO2[2]。
在自然界,部分植物的根瘤菌合成氨是一个温和的过程。常温常压条件下,在固氮酶的催化下将大气中N2转变为NH3,但是该过程速度慢、产率低[3]。受固氮酶合成氨过程的启发,人们正在研究的新型光催化和电催化系统能够在类似于固氮酶的温和条件下,将大气中的N2转变为NH3。不同于高能耗高排放的Haber-Bosch过程,这种温和条件下的合成氨路线能够减少对化石燃料的依赖和温室气体的大量排放[4]。
光催化和电催化技术提出了一种有前景的无碳合成氨策略,从而为发展清洁、可持续的合成氨路线提供了潜在的新途径[5]。然而,不同于已经工业化的Haber-Bosch过程,温和条件下的合成氨研究尚处于实验室探索阶段,开发廉价高效的催化剂无疑是当前研究所面临的重要挑战。在这些研究中,为了准确评价催化剂活性,建立方便可靠的低浓度NH3定量方法显得尤为重要。另外,水样中低浓度氨的定量分析对控制环境水样富营养化[6-7]、实现人与环境的和谐发展也非常重要。
常见的氨检测方法有纳氏试剂法、靛酚蓝法、离子色谱法等。分光光度法因其成本较低得到广泛应用[8]。其中以纳氏试剂法和靛酚蓝法最为常见。纳氏试剂法[9-11]利用一种含有K2HgI4和KOH的溶液,使HgI42-离子与氨溶液在碱性条件下生成红棕色络合物,其最大吸收在420 nm处,在没有干扰的情况下,所得到红棕色络合物的吸光度与氨浓度成正比。但是该方法存在试剂含有剧毒汞成分[12]、使用寿命较短(约3周)、氨与纳氏试剂反应时间会影响氨的定量等缺点。另一种显色方法是靛酚蓝显色法[13-15],该方法具有操作简便、有较高的精密度和准确度、不需要特殊程序处理危险废物等优点,广泛应用于低浓度氨的定量分析。不同于上述显色方法,离子色谱法[16-17]具有高效简便、灵敏度高、重现性好、高选择性等特点,由于需要复杂昂贵的仪器在实际应用中受到限制。
利用靛酚蓝显色法测定氨含量是一种非常成熟的技术,在环境水样分析、生化样品检测等方面得到广泛应用。然而,将该方法应用到光电催化合成氨样品的定量分析时会遇到新的问题。因为电催化样品共存于高浓度电解液中,而光电催化过程使用的催化剂往往含有过渡金属成分。为了验证靛酚蓝显色法在光电催化合成氨领域应用的可能性,本论文着重分析了在模拟光电催化的高浓度电解质、共存过渡金属离子等条件下靛酚蓝显色法的离子干扰问题,并通过大量实验提出了排除干扰的离子掩蔽方案。论文结果显示,一些过渡金属离子确实对靛酚蓝显色法测氨产生强干扰,使得分析结果不可靠,而通过本论文提出的离子掩蔽策略,可以达到定量分析要求。因此,本论文为靛酚蓝显色法分析强干扰离子存在下的水溶液氨含量提供了有益借鉴。
1 实 验
1.1 实验原理
靛酚蓝分光光度法的理论依据为朗伯-比尔定律。在碱性条件及室温下,以亚硝基铁氰化钠(硝普钠)作为催化剂,氨与次氯酸盐、水杨酸盐反应生成蓝色化合物[18-19]。其最大吸收波长671 nm处的吸光度与样品中氨含量成正比例关系。反应式如图1所示。
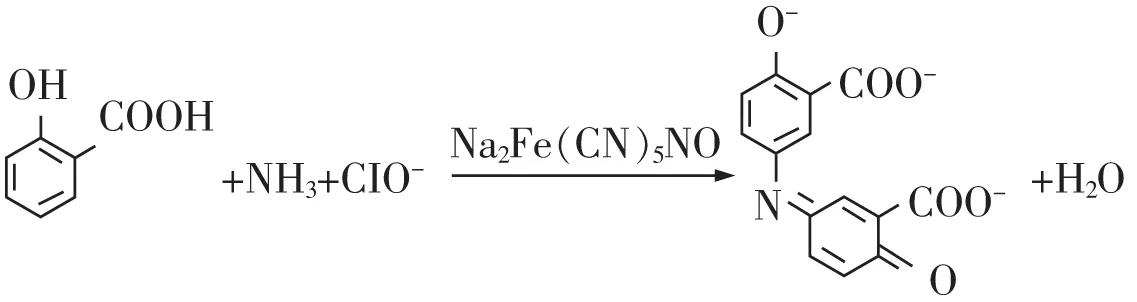
图1 靛酚蓝显色反应式[20]
1.2 仪器
紫外-可见分光光度计UV-2500(岛津)、离心机TGL-16C(上海安亭)、电子分析天平CP214(奥豪斯)、超声波清洗机JP-020PLUS(洁盟)、烧杯等玻璃仪器。
1.3 试剂
实验过程中所用的试剂都为分析纯,采购于国药集团化学试剂公司,硝普钠溶液0.01 g/mL(阿拉丁)。实验用水为去离子水,用干燥的氯化铵配制10 mM氨贮备液,使用时稀释到所需浓度。
1.4 绘制标准曲线
准确配制浓度为0.2 mM的氨储备液,准确量取该溶液0,1,2,4,6,8,16,24 mL于25 mL容量瓶,用超纯水定容至刻度线,得到浓度分别为0,0.008,0.016,0.032,0.048,0.064,0.128,0.192 mM的氨标准溶液。分别取0.6 mL上述溶液用于显色反应,依次加入1.9 mL去离子水、1 M水杨酸钠溶液0.4 mL、硝普钠溶液0.025 mL、0.35%wt次氯酸钠溶液0.025 mL,摇匀、混合静置。在室温下反应1.5 h,使其充分显色。然后从低浓度到高浓度依次测定其吸光度,得到浓度-吸光度的拟合曲线[21]。
1.5 离子干扰实验
为了检测常见金属离子对氨含量测定的干扰情况。分别配制含有10 mM(Ag+,Al3+,Ni2+,Ca2+,Co2+,Cu2+,Fe3+,Zn2+,Mg2+,Mn2+,Cd2+)或0.1 M(Li+,Na+,K+)金属离子的氨溶液。按上述实验方法显色并测定其吸光度,由此来确定干扰离子对测定水中氨含量的影响。掩蔽试剂的干扰测定使用相同的实验方法。
1.6 干扰离子掩蔽实验
为了进一步消除Ni2+,Cu2+,Co2+,Mn2+,Ag+,Fe3+离子对氨含量测定结果的影响。分别配制含有10 mM上述干扰离子以及相同浓度掩蔽试剂的氨溶液(0.1 mM)按相同的实验方法显色,并测定其吸光度,以此来消除干扰离子对测定氨含量造成的影响。如果加入掩蔽剂浓度不同于干扰离子,在图中以×X表示,代表所用掩蔽剂浓度为干扰离子的X倍。
1.7 样品测定
1.7.1 已知浓度氨溶液测定
准确量取1.25 mL,0.2 mM标准氨溶液,加入1.25 mL去离子水于5 mL试管中。然后取0.6 mL以上氨溶液,依次加入1.9 mL去离子水、水杨酸钠溶液0.4 mL、硝普钠溶液0.025 mL、次氯酸钠溶液0.025 mL。在室温下反应1.5 h,并测定其吸光度,通过以上标准曲线计算氨含量。平行测定3次,取平均值,计算相对偏差。
1.7.2 环境水样测定
取不同环境中的2种真实水样(西安科技大学临潼校区校内湖及曲江池),经过简单过滤处理。取0.6 mL以上水样,依次加入1.9 mL去离子水、水杨酸钠溶液0.4 mL、硝普钠溶液0.025 mL、次氯酸钠溶液0.025 mL。在室温下静置1.5 h,待显色完全测定其吸光度,计算水样中的氨含量。各样品分别平行测定7次,然后根据标准曲线计算得到各样品中的氨含量,求取平均值为真实水样中的氨含量(C0)。
1.7.3 回收率测定
采用加标回收实验测定回收率[22],在上述水样中加入0.1 mM(C1)的氨标准溶液,按相同方法显色,测定吸光度,计算加标后浓度(Cx)按下列公式计算回收率P∶P=(Cx-C0)/C1×100%。
2 结果与讨论
2.1 标准曲线的绘制
不同氨含量的标准溶液显色以后测定紫外可见吸收光谱结果如图2(a)所示。可以发现所有样品的紫外可见吸收光谱在671 nm出现最大吸收峰,且吸光度随样品氨浓度增加而增加。以氨含量(mM)为横坐标,以671 nm处的吸光度数值为纵坐标绘制氨的标准工作曲线,结果如图2(b)所示。其R2=0.999 34,说明靛酚蓝显色法具有良好的线性关系。经过分析计算,得到该方法的检出限为0.010 5 mM,线性范围为0.032 ~ 0.32 mM。
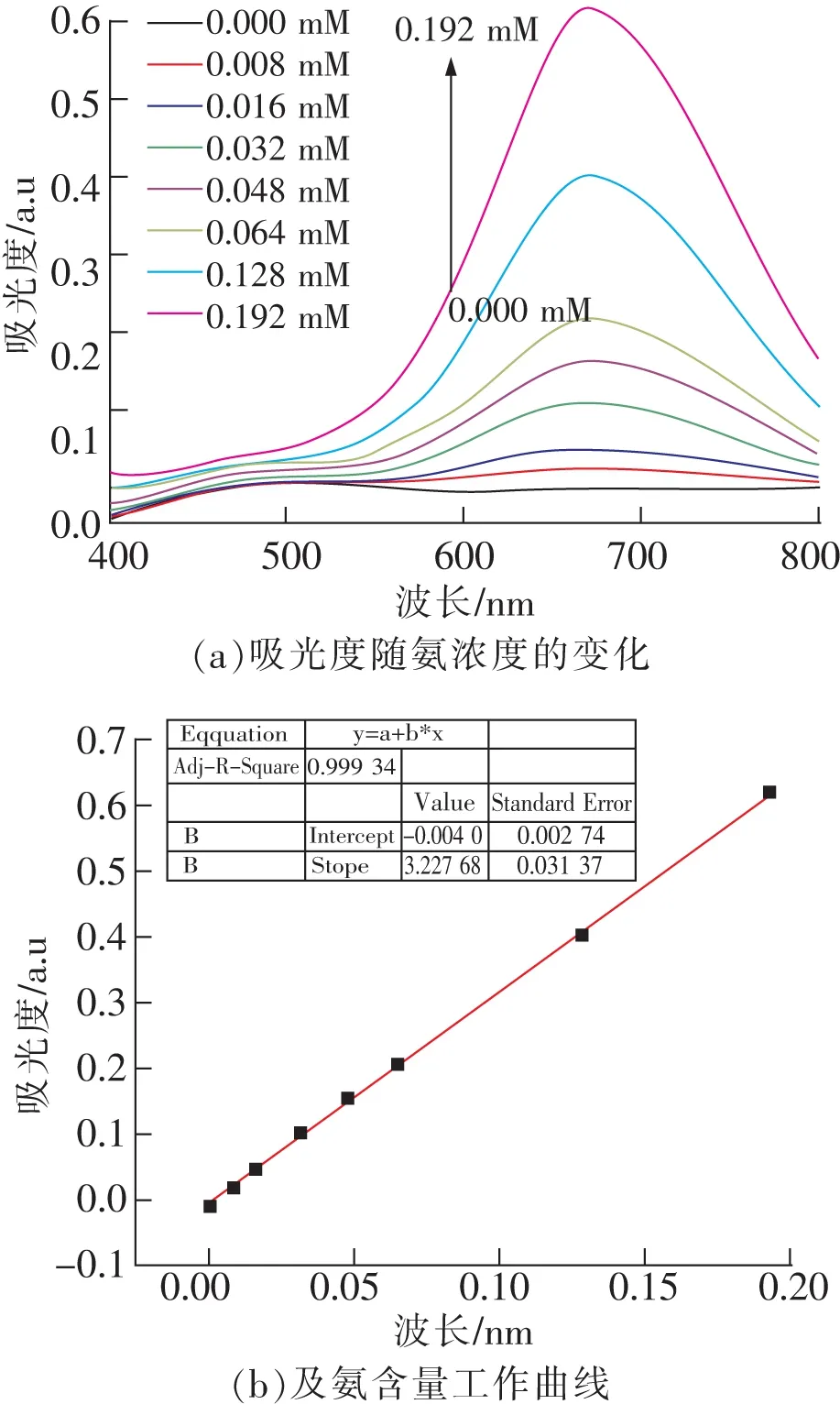
图2 吸光度随氨浓度的变化(a)及氨含量工作曲线(b)
2.2 干扰实验结果分析
为检验不同金属离子对氨含量测定的干扰情况,在共存干扰离子(Ag+,Al3+,Ni2+,Ca2+,Co2+,Cu2+,Fe3+,Zn2+,Mg2+,Mn2+,Cd2+)浓度为氨浓度的100倍或干扰离子(Li+,Na+,K+)的浓度为氨浓度的1 000倍情况下分别测定已知氨浓度溶液的吸光度,经过回归方程计算的氨浓度与无干扰(空白)氨浓度测定值的偏差如图3所示。
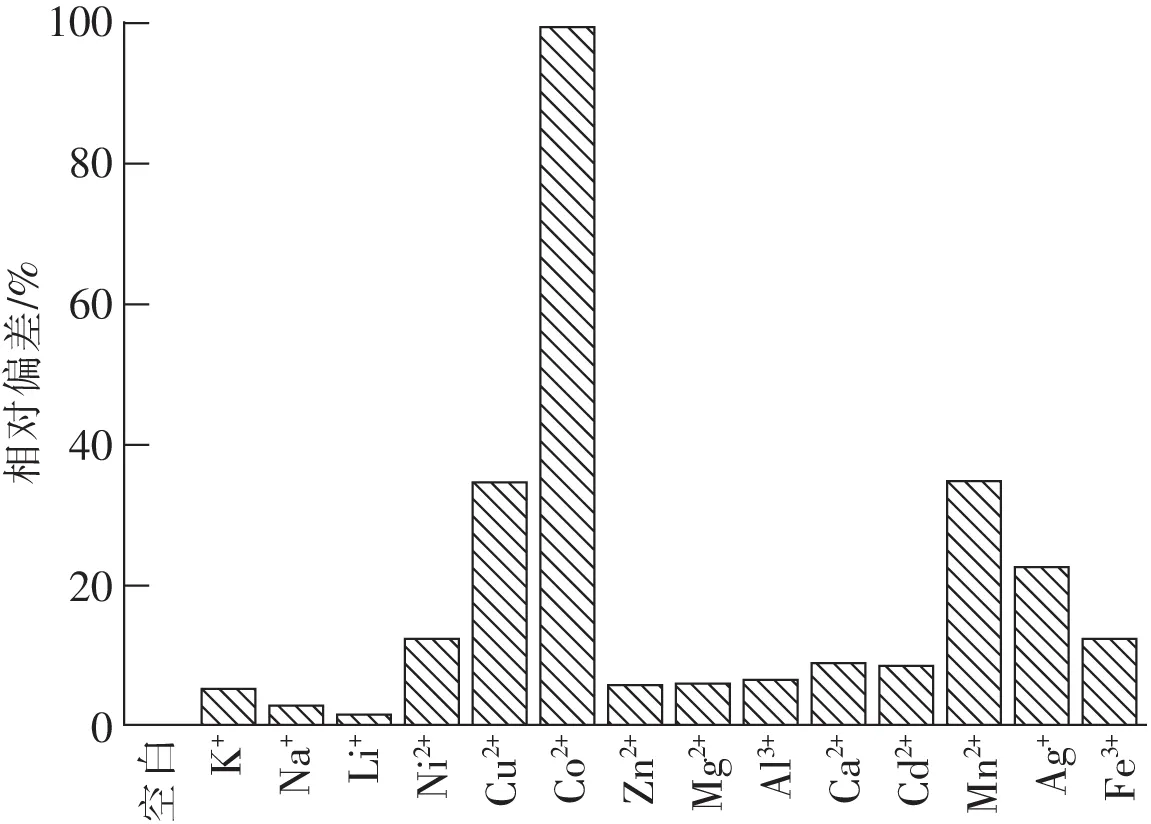
图3 在不同金属离子存在下氨测定的相对偏差
从图3可知,绝大多数离子(Li+,Na+,K+,Zn2+,Mg2+,Al3+,Ca2+,Cd2+)对氨含量测定的干扰小于10%;只有部分离子(Ni2+,Cu2+,Co2+,Mn2+,Ag+,Fe3+)对氨测定的干扰大于10%。其中Co2+离子对测定结果的干扰最为明显,偏差达到99.37%。考虑到实验精度的要求,认为干扰离子引起的偏差大于10%即为存在干扰。由此可知,Ni2+,Cu2+,Co2+,Mn2+,Ag+,Fe3+离子对测定水中氨含量产生较大干扰,为了消除这些离子对氨测量的影响,需要加掩蔽剂对其进行掩蔽。
2.3 掩蔽实验结果分析
2.3.1 干扰离子掩蔽实验
实验采用常见试剂分别对Ni2+,Cu2+,Co2+,Mn2+,Ag+,Fe3+离子进行掩蔽,结果如图4所示。
从图4(a)可以看出,EDTA,Na2SO4对Mn2+离子掩蔽效果明显,掩蔽后的氨测定偏差分别减小到9.345%,8.227%;从图4(b)可以看出,EDTA,NaOH,H3PO4,NaF,KMnO4(H+)、磺基水杨酸(C7H6O6S),Na2SO4对Fe3+离子掩蔽效果明显,掩蔽后的氨测定偏差分别减小到8.099%,9.968%,0.623%,6.230%,0.934%,4.049%,5.607%;从图4(c)可以看出,酒石酸(PST)、Na2CO3对Co2+离子掩蔽效果明显,掩蔽后的氨测定偏差分别减小到4.984%,2.492%;从图4(d)可以看出,Na2CO3,EDTA,K3[Fe(CN)6],Na3PO4,Na2SO4对Ni2+离子掩蔽效果明显,掩蔽后的氨测定偏差分别减小到3.115%,4.984%,0.3115%,2.492%,9.657%;从图4(e)可以看出,Na2CO3,Na3PO4,KMnO4(H+)对Cu2+离子掩蔽效果明显,掩蔽后的氨测定偏差分别减小到9.960%,1.557%,5.60%;从图4(f)可以看出,Na2CO3,NaOH,邻菲罗啉(PTL)、Na3PO4对Ag+离子掩蔽效果明显,掩蔽后的氨测定偏差分别减小到0.311 5%,2.180%,1.550%,9.345%。
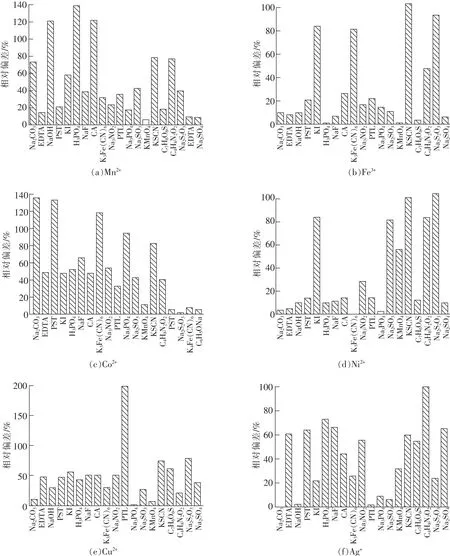
图4 常见试剂对干扰离子的掩蔽效果
2.3.2 掩蔽试剂的干扰分析
为进一步验证掩蔽方案的可靠性,我们测试了对干扰离子有掩蔽效果的EDTA等12种掩蔽试剂对氨测定的干扰情况,结果如图5所示。
从图5可知,绝大多数掩蔽试剂H3PO4,NaF,PTL,PST,C7H6O6S,Na2CO3,Na2SO4等对氨测定的干扰小于10%,而K3[Fe(CN)6],KMnO4(H+),Na3PO4这些掩蔽剂自身对水中氨含量测定存在严重干扰,其引起氨测定偏差分别为71.96%,26.49%,10.90%,由于自身干扰较大掩蔽剂不能用于离子掩蔽实验,为确保实验的精确度和可靠性,应该优先选择干扰较小的掩蔽剂。
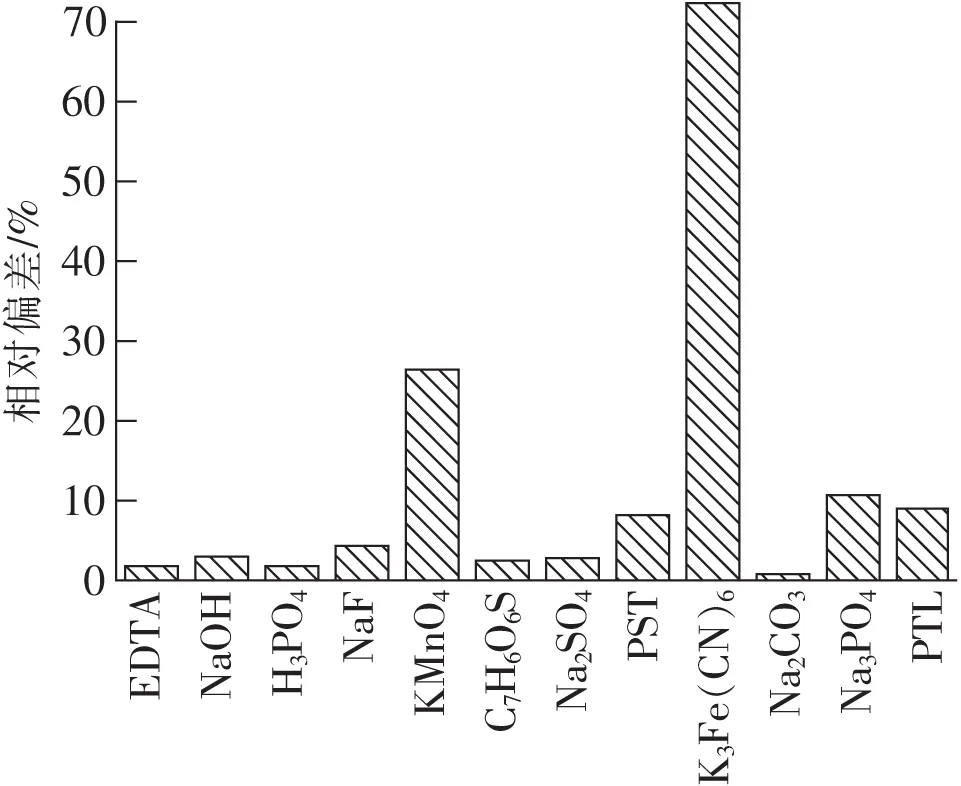
图5 掩蔽剂对测定结果的干扰
从以上干扰掩蔽实验的结果发现,Co2+,Ni2+,Cu2+,Ag+离子都可以通过分别加入Na2CO3掩蔽消除干扰,而Mn2+,Fe3+离子分别可以通过加入Na2SO4,H3PO4掩蔽消除干扰。
2.4 方法评价
2.4.1 已知浓度的氨测定
为评估该方法的可靠性,对已知浓度的氨溶液进行了3次平行测定,实验结果见表1。

表1 已知氨浓度溶液测定结果
表1所示为对已知浓度为0.100 00 mM氨溶液的3次平行测定结果,求得平均值为0.100 69 mM,相对偏差为0.69%,小于1%证明该方法有较高的准确度。
2.4.2 环境水样测定
为进一步验证此方法的可靠性,采用加标回收法测定真实水样氨含量的回收率,结果见表2。
由表2可知,用靛酚蓝法测定西安科技大学临潼校区校内湖水样和曲江池水样的回收率分别为101.09%和95.91%,符合定量分析的要求,并且曲江水样氨含量比临潼水样氨含量高。
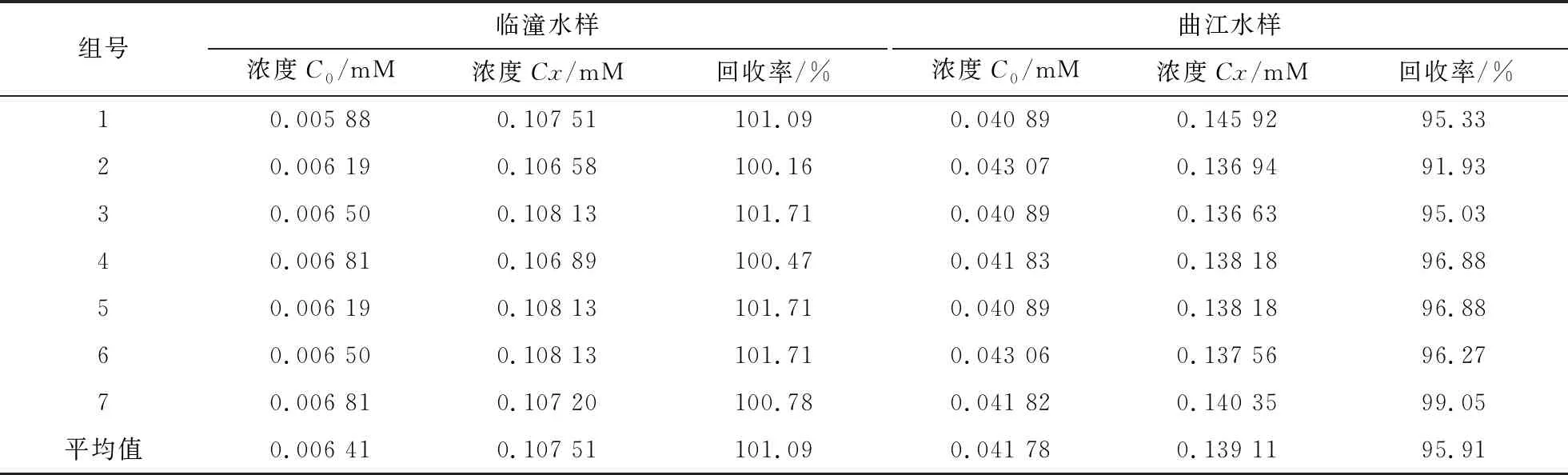
表2 加标回收率的测量结果
3 结 论
该论文采用靛酚蓝显色法测定了水样中的氨浓度,详细研究了常见金属离子对测定结果的干扰情况,并对强干扰离子采取了试剂掩蔽措施。在大量实验的基础上,发展了对影响氨测定金属离子的掩蔽方案。该论文提出的氨测定及干扰离子掩蔽方案在常温常压下的光电催化合成氨催化剂评价对环境水体富营养化控制等领域具有一定的指导意义和应用前景。
