一株耐盐微生物的分离鉴定及其对养殖尾水降解效果研究
2021-08-05夏枫峰油九菊洪志翔傅荣兵何映雪余靖雯张晓林
夏枫峰,油九菊,洪志翔,傅荣兵,何映雪,余靖雯,张晓林
(1.浙江省舟山市水产研究所,浙江舟山 316000;2.国家海洋设施养殖工程技术研究中心,浙江舟山 316022)
随着集约化海水养殖业的迅速发展,我国海水养殖的面积和密度不断扩大,在海水养殖虾类中凡纳滨对虾的养殖面积位居榜首。据2019 年渔业统计年鉴数据显示,2018 年凡纳滨对虾的养殖面积为167 025 hm2,占所有海水养殖虾类的69%[1]。目前,高密度池塘养殖是凡纳滨对虾最主要的养殖方式,虽然高密度养殖能够带来高产量和高收益,但由于养殖尾水中残饵和粪便随着养殖密度的增加而逐渐增多,从而导致水体的氨氮、COD 和总磷等有害物质严重超标[2],若不经处理直接排放,将对海域生态环境造成严重污染,同时也会对海水养殖业的可持续发展带来威胁。因此,有效处理高密度养殖尾水是海水养殖业健康发展的基本前提。
目前养殖尾水处理主要有物理、化学、生物等方法,其中物理和化学处理法由于成本高且容易产生二次污染,在实际应用中受到很大限制[3]。例如目前比较热门的电化学氧化法以及化学剂絮凝法等,不仅运营成本高昂,且使用范围受限制,仅适用于工厂化养殖车间,对于大面积的池塘养殖尾水的处理还达不到理想的效果[4]。因此,对于池塘养殖尾水的处理则更倾向于选择成本低且对环境友好的生物处理。目前已有一些降解效果较好的菌种报道,但是尚缺乏能够耐盐的菌株[5-6]。因此,本文将筛选出一株耐盐的微生物,通过分子生物学手段进行菌株鉴定和特性研究,同时将在实验室条件下初步检测该微生物对养殖尾水中氨氮、COD 和总磷的降解效果。
1 材料与方法
1.1 水样采集和培养基、试剂配制
实验用的养殖尾水取自舟山市定海盘峙水产养殖场凡纳滨对虾大棚养殖池。于凡纳滨对虾养殖密度最高的时期取养殖尾水约10 L 带回实验室,一部分用于分离微生物,一部分用于检测降解效果。
微生物分离所用的培养基为LB 固体和液体培养基,用干净的海水代替蒸馏水配制。培养基的成分为:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,pH 7.4~7.6,加海水至总体积为1 L;固体培养基为上述配方中添加1.5%琼脂粉。在LB 培养基中加入20%的甘油,用于菌种保存。所有的培养基配好后在121 ℃,103.4 kPa 条件下灭菌20 min。
实验中检测氨氮、COD 和总磷采用连华科技有限公司的氨氮、COD 和总磷检测试剂盒(货号:LHN2N3、LH-DE、LH-P1P2),对应试剂的配方如下:
N1 试剂:将整瓶晶体粉末状N1 全部倒入烧杯中,加入无氨水,搅拌溶解后,定容至100 mL,加入棕色试剂瓶中,贴好标签;N2 试剂:将整瓶片状N2-N 倒入烧杯中,加入50 mL 无氨水,搅拌溶解,充分冷却至室温。另将整瓶N2-KH 粉末试剂全部倒入烧杯中,加入少量无氨水,搅拌使其充分溶解,然后将此溶液在搅拌下徐徐注入充分冷却的N2-N 溶液中,用水稀释至100 mL,静置5 h 以上,储存于棕色聚乙烯瓶中,用橡皮塞或聚乙烯盖盖紧;LH-P1-100 试剂:将试剂全部加入烧杯,加入100 mL 蒸馏水并不断搅拌,试剂全部溶解后装瓶封存;LH-P2-100 试剂:将试剂全部加入烧杯,加入88 mL 蒸馏水并不断搅拌,在搅拌中加入12 mL 分析纯硫酸,试剂全部溶液后装瓶封存;LH-D-100 试剂:将整瓶的晶体状粉末试剂倒入烧杯中,加入75 mL 蒸馏水,在不断搅拌下加入5 mL 分析纯硫酸,直至全部溶解后备用;LH-E-100 试剂:将整瓶的晶体状粉末试剂,全部溶解于500 mL 分析纯硫酸中,不断搅拌或隔夜放置,直至试剂全部溶解后备用。
1.2 实验方法
1.2.1 菌种的分离及纯化
养殖尾水经0.22 μm 的滤膜过滤以富集海水中的微生物,滤膜上富集的微生物用无菌海水轻轻冲洗至一干净的培养皿,取培养皿中含微生物的混合液均匀涂布在提前制备好的LB 固体平板上,若微生物浓度过大,则需要进行一定倍数的稀释后再涂布,以得到单一的菌落。涂布好的固体平板置于37 ℃培养箱静置培养12~24 h,待平板上长出肉眼可见的单菌落后,用无菌牙签挑取单菌落至LB 液体培养基中振荡培养至培养液出现一定的浑浊,以备进一步鉴定和分析。每管单菌落从1 号开始分别进行连续编号。
1.2.2 分子生物学鉴定
利用细菌基因组提取试剂盒(全式金,货号:EE101-01)提取每管菌液的基因组DNA,以基因组DNA 为模板,通过PCR 扩增菌株的16S rDNA,扩增引物为:27F:AGAGTTTGATCCTGGCTCAG;1492R:CTACGGCTACCTTGTTACGA。PCR 产物通过胶回收试剂盒回收纯化后送至上海生工生物科技有限公司测序。测得的序列通过NCBI(https://www.ncbi.nlm.nih.gov/)上的BLAST 进行同源性比对,对筛选的不同菌落进行鉴定。序列相似性大于96%即认为是同一属,对筛选出的不同属细菌进行标记并保种。
1.2.3 菌株的形态观察和生理生化特征分析
取10 μL 菌液于载玻片中央,轻轻放上盖玻片,不要产生气泡,在显微镜(莱卡DM2000)下观察细菌的形态和运动模式,并拍照记录。同时在体视显微镜下观察固体平板上的单菌落形态,并拍照记录。
采用负染色法处理细菌并观察结果,观察分离的细菌是否有荚膜;同时对菌株进行革兰氏染色,以确定细菌为革兰氏阳性或阴性。
1.2.4 菌株的生长特性研究
1.2.4.1 生长曲线的测定
在无菌操作台中取100 mL LB 液体培养基,加入至三角烧瓶中,移液枪取1 mL 菌液以1:100 的转接比例加入至三角烧瓶,混合摇匀。于三角烧瓶中取3 mL 混合液加至5 mL EP 管中,标记为0,并记录取样时间。每隔1 h 取1 次样,依次编号,每次取的样品放在4 ℃冰箱暂存。所有的样品用分光光度计测定600 nm处的吸光度。以培养时间为横坐标,OD600nm值为纵坐标,绘制菌株的生长曲线。
1.2.4.2 菌株在不同盐度下的生长曲线测定
分别利用不稀释、1 倍稀释、2 倍稀释和3 倍稀释的海水配制的LB 培养基培养细菌,依据1.2.4.1 的方法测得不同盐度下的生长曲线。
1.2.4.3 菌株在不同温度下的生长曲线测定
将转接过的菌液分别置于37 ℃和28 ℃恒温培养箱振荡培养,依据1.2.4.1 的方法测定不同温度条件下菌株的生长曲线。
1.2.5 对养殖尾水中氨氮、COD 和总磷的降解效果研究
在养殖场收集的养殖尾水按照1:100 的体积比加入活性较好的菌液,分别测得加入菌液之前和菌液处理7 d 之后水样的氨氮、COD 和总磷的变化。
2 结果与分析
2.1 菌株鉴定结果
从固体平板上一共挑取了10 个单菌落进行菌株鉴定,其中1 号和4 号测序失败,5 号、7 号以及9 号克隆与弧菌Vibrio 相似性最高;2 号、3 号、6 号、8 号以及10 号克隆与交替假单胞菌属Pseudoalteromonas相似性最高。由于弧菌为水产养殖中常见的致病菌,因此将对分离到的交替假单胞菌进行进一步研究。
2.2 交替假单胞菌的生物学特征
2.2.1 形态和生理生化特征
分离到的交替假单胞菌在用无菌海水配制的LB 培养基中生长良好,固体平板上的细菌在37 ℃培养24 h 后出现单菌落,菌落呈圆形或椭圆形,颜色为暗黄色,中间厚两边薄,边缘带有透明光圈,表面光滑(图1 A)。菌体细胞为短棒状(图1 B),无芽孢,无荚膜(图1 C),有鞭毛,能在培养液中自由运动。细菌经革兰氏染色后在显微镜下观察呈紫色(图1 D),故分离到的交替假单胞菌为革兰氏阳性。

图1 菌落形态及菌液生理生化特征Fig.1 Colony morphology and physiological and biochemical characteristics
2.2.2 不同条件下的生长特性
通过生长曲线测定,该菌在接种后2~4 h 为指数生长期,接种后10 h 生长达到平台期,OD600nm最大可达到0.95,不同时间点的生长曲线见图2。菌液在不同稀释倍数的海水中培养,测得不同海水盐度下该菌的生长曲线,结果发现海水稀释倍数越低,菌株的生长速度越快,并在接种后2~4 h 生长速度差异明显(图3)。由此可见,本研究分离的交替假单胞菌生长需要一定的盐度,以正常海水盐度最适合其生长。此外,测定了交替假单胞菌在2 种不同温度下的生长曲线,由图4 可知,以海水的盐度分别在37 ℃和28 ℃条件下培养,37 ℃培养条件下的生长速度要比28 ℃快,由此可知,该交替假单胞菌生长的最适条件为未稀释海水盐度和温度为37 ℃。
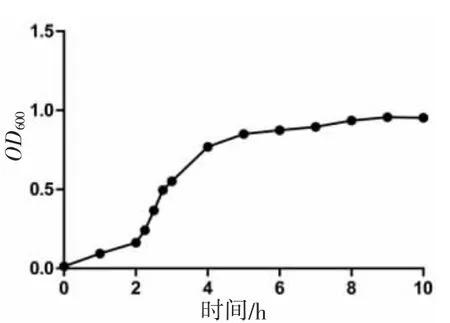
图2 交替假单胞菌的生长曲线Fig.2 Growth curve of Pseudoalteromonas
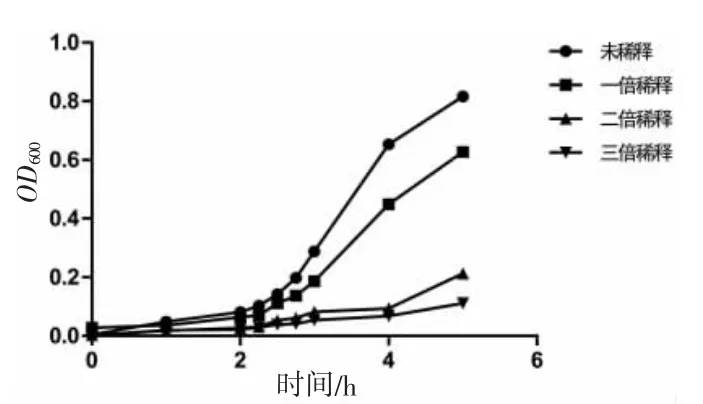
图3 不同稀释倍数海水条件下的生长曲线Fig.3 Growth curves under different dilution multiples of seawater
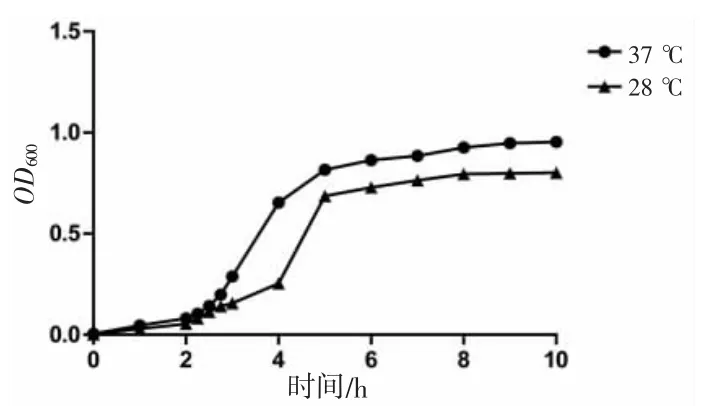
图4 不同温度条件下的生长曲线Fig.4 Growth curve under different temperature conditions
2.2.3 对养殖尾水的处理效果
分离的交替假单胞菌以1:100 的比例加入到养殖尾水中,处理7 d,测定处理前后水体中的氨氮、COD和总磷的变化,结果见表1。
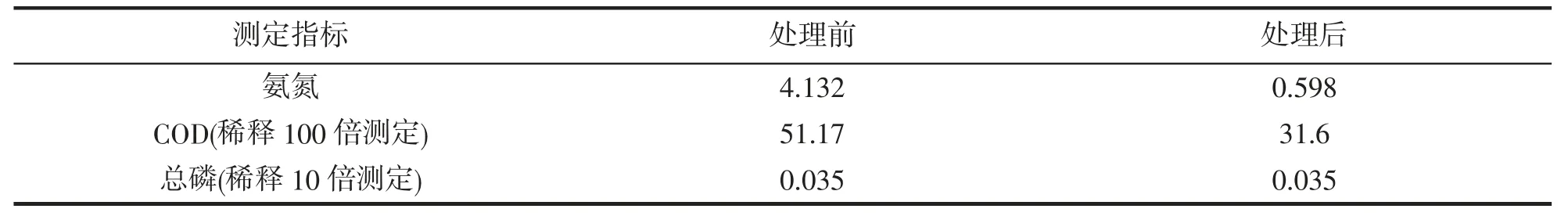
表1 交替假单胞菌处理7 天前后尾水中氨氮、COD 和总磷指标Tab.1 Index of ammonia nitrogen,COD and total phosphorus in tail water before and after 7 days of treatment
数据显示,交替假单胞菌对于养殖尾水中的氨氮和COD 具有一定降解作用,在交替假单胞菌处理后,水样的氨氮值下降了86%,水样的COD 值下降了38%,但是对于总磷的处理没有效果。因此,该交替假单胞菌对养殖尾水中的氨氮和COD 的降解有一定的效果,但是对总磷的降解效果不明显。
3 讨论
随着养殖尾水污染海洋环境风险的加大,微生物修复技术成为研究热点。本研究从高密度养殖尾水中分离筛选出了1 株能降解氨氮和COD 的交替假单胞菌,该菌株在28 ℃、200 r·min-1的条件下,对养殖尾水中的氨氮和COD 降解效果较为明显,但对总磷的降解效果不明显。
假交替单胞菌是属于γ-变形菌纲的一类海洋特有细菌,在全球海洋广泛分布。该属的多样性很高,目前该属已有41 个种[7]。该属菌株可分泌多种胞外酶(嗜冷酶、海藻酸裂解酶、几丁质酶和琼胶酶等)以及胞外生物活性物质(抗菌溶菌物质、抗真菌物质、溶藻物质等),在海洋生物地球化学循环中发挥着重要作用,具有良好的生物化学应用前景[8]。
从生理生化性质上看,该属细菌可产生各种各样的生物活性物质,其中不产色素类群倾向于产生具有特殊活性的生物酶类或其他大分子物质[9-10],而产色素类群则更倾向于合成一些具有防污染活性[11]、抗菌活性的生物活性物质[12-15]。目前关于交替假单胞菌的分离及功能已有不少报道,已分离的该类菌株主要在降解石油烃类污染物[16]、抑制弧菌等致病菌[17]以及脱氨氮[18-19]方面具有明显效果。本研究分离筛选出1 株能够降解海水养殖尾水中氨氮和COD 的交替假单胞菌株,但对总磷的降解效果不明显,因此,关于该菌株对氨氮和COD 的降解最优化条件以及降解机制还有待于进一步深入研究,同时也有必要筛选更多能够降解尾水中总磷的菌株。
