沉香叶黄酮稳定性及对H2O2诱导HepG2细胞氧化损伤的保护作用
2021-08-04段宙位方宗壮何艾王世萍谢辉
段宙位 方宗壮 何艾 王世萍 谢辉
摘 要:研究沉香葉黄酮稳定性及对H2O2诱导HepG2细胞氧化损伤的保护作用。通过测定溶液吸光值,探讨温度、光照、金属离子、pH值对沉香叶黄酮稳定性的影响。建立H2O2诱导HepG2细胞氧化损伤模型,将细胞分为正常组、模型组以及沉香叶黄酮低、中、高剂量组,采用水溶性四唑盐法检测细胞增殖率,2′,7′-二氢二氯荧光黄双乙酸钠法(DCFH-DA)测定细胞内活性氧(ROS)水平,生化试剂盒检测细胞乳酸脱氢酶(LDH)释放量、丙二醛(MDA)含量、细胞内总超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活性。结果表明,沉香叶黄酮在温度70 ℃以下,pH 3~7范围内,Na+、K+、Mg2+、Ca2+金属离子中,黑暗环境与节能灯光中较稳定;能显著抑制H2O2造成的细胞死亡,降低胞内ROS与MDA的生成,减轻LDH向细胞外扩散程度,提高SOD、CAT、GSH-Px活性。沉香叶黄酮在低温、弱酸、部分金属离子、弱光条件下具有一定稳定性;对H2O2诱导HepG2氧化应激损伤具有保护作用,其作用可能与调节细胞氧化还原系统、清除胞内活性氧水平、提高细胞内抗氧化酶系活性有关。
关键词:沉香叶黄酮;稳定性;HepG2细胞;氧化应激
中图分类号:R285.5 文献标识码:A
Stability and Protection Against H2O2 Induced Oxidative Stress Injury in HepG2 of Flavonoids from Aloes Leaves
DUAN Zhouwei1,2 , FANG Zongzhuang1, HE Ai1, WANG Shiping1, XIE Hui1
1. Institute of Processing & Design of Agroproducts, Hainan Academy of Agricultural Sciences, Haikou, Hainan 571100, China; 2. Collage of Food Science and Technology, Huazhong Agricultural University, Wuhan, Hubei 430070, China
Abstract: The effects of temperature, light, metal ions, and pH on the stability of aloes leaves (FAL) were explored to evaluate the stability of the flavonoids from FAL and the protective effect against oxidative damage induced by H2O2 in HepG2 cells. A model of oxidative damage to HepG2 cells induced by H2O2 was established. Cells were divided into normal group, oxidative stress model group, and low-, medium- and high-dose FAL treatment groups. The cell proliferation rate was measured by the water soluble tetrazolium method (WST-1) assay. The intracellular reactive oxygen specisis (ROS) was determined by the dichloro - dihydro - fluorescein diacetate (DCFH-DA) assay. The content of lactate dehydrogenase (LDH), the level of malondiadehycle (MDA) and the activity of superoxidedimutase (SOD), glutathione peroxidase (GSH-Px) and catalase (CAT) were detected by biochemical kits. The results showed that FAL were more stable under temperature 70 ℃, pH 3-7, in the Na+, K+, Mg2+, Ca2+ metal ions, in the dark environment and energy-saving lighting. FAL significantly increased the cell viability and activity of SOD, CAT and GSH-Px in cells. In addition, FAL also effectively decreased the intracellular levels of ROS and MDA, reduced the spread of LDH out of the cell. FAL had certain stability under low temperature, weak acid, some metal ions, and low light conditions. Consequently, FAL could protect HepG2 cells against H2O2-induced oxidative damage, and its underlying mechanism maight be related to regulating the cellular redox system, scavenging intracellular ROS, and increasing the activities of intracellular antioxidant enzymes.
Keywords: flavonoids from aloes leaves; stability; HepG2 cells; oxidative stress
DOI: 10.3969/j.issn.1000-2561.2021.06.022
过多自由基会对机体造成损伤[1],加快炎症、癌症、糖尿病等疾病发展[2]。因此,国内外越来越重视开发天然抗氧化物质,以清除机体中过多自由基,维持其氧化动态平衡。农产品被认为是“天然产物”的自然宝库,从食品原料中发现营养组分,安全有效地清除自由基,日益受到人们的重视。
沉香(Aquilaria agallocha Roxb.)为瑞香科沉香属树含黑色树脂的木质部,是我国名贵中药和世界名贵香料,用于治疗胃寒、肾虚、胸闷等症状[3]。据统计,2018年海南的沉香种植面积约7000 hm2,其中胸径超过20 cm的沉香树约2333.33 hm2,近400万株,约占全国总数量的40%。沉香树种植过程中产生大量叶子,其叶中含有多糖、黄酮等[4-5]多种活性成分,常被当作废弃物丢弃。沉香叶黄酮具有抗炎、抗氧化和免疫调节等作用[6-10],如能加以利用,这对开发天然活性物质,提高沉香附加值具有非常重要的意义。
现阶段,开展了沉香叶黄酮提取纯化[11-12]、抗氧化性[12]及结构鉴定[13]等方面的研究。但以上研究仅采用化学试剂法测定沉香叶黄酮抗氧化性,未从细胞水平评价其抗氧化性,未对其稳定性进行研究。进一步深入研究沉香叶黄酮的稳定性与抗氧化性对其产业化应用非常重要。因此,本研究探讨温度、光照、金属离子、pH对沉香叶黄酮稳定性的影响,建立H2O2诱导HepG2细胞氧化应激损伤模型,探讨沉香叶黄酮对氧化损伤的保护作用,以期为天然抗氧化剂及功能性食品的开发提供依据。
1 材料与方法
1.1 材料
制取沉香叶干粉。于2019年6月18日在海南省文昌市南阳镇采摘沉香树鲜叶,洗净后50 ℃烘干,粉碎,过40目筛,制得沉香叶干粉。
胎牛血清,美国Gibco公司;过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)和丙二醛(MDA)试剂盒,碧云天生物技术研究所。
FACS Calibur型流式细胞仪,美国BD公司;FLBP-1000A型高速粉碎机,上海菲力博食品机械有限公司;C170型CO2培养箱,德国Eppendorf公司。
1.2 方法
1.2.1 沉香叶黄酮的制备 将沉香叶干粉,按照纤维素酶用量200 U/g,底物浓度3 g/100mL,加入70%乙醇,在55 ℃,pH为5的条件下浸提3 h[11],浓缩和干燥后,配成5.0 mg/mL粗提液,用0.45 μm微孔滤膜过滤,收集滤液,采用NKA-9树脂动态吸附,以1.5 mL/min速度将滤液上Φ16 mm× 500 mm层析柱,用70%(V/V)乙醇以2.0 mg/mL速度洗脱,收集滤液,55 ℃旋转蒸发浓缩,真空冷冻干燥,制得沉香叶黄酮(flavonoids from aloes leaves, FAL),纯度为76.58%±3.46%。
1.2.2 黄酮溶液吸光值的测定 采用硝酸铝显色法[12]测定。
1.2.3 FAL稳定性的测定 (1)温度对FAL稳定性的影响。取0.05 mg/mL FAL溶液5 mL,分别置于50、60、70、80、90、100 ℃下水浴2.0 h,测定吸光值。
(2)pH对FAL稳定性的影响。取0.05 mg/mL FAL溶液5 mL,分别用稀盐酸和氢氧化钠调节pH至1、3、5、7、9、11,于25 ℃下放置2 h,測定吸光值。
(3)光照对FAL稳定性的影响。取0.05 mg/mL FAL溶液5 mL,分别置于黑暗环境、紫外灯光、节能灯光、晴朗日光环境中放置2 h,测定吸光值。其中紫外灯光与节能灯光的功率均为40 W,灯与样品之间的距离为10 cm;晴朗日光环境光照强度为(8×104)~(10×104)lx;黑暗环境光照强度为0.001 lx。
(4)金属离子对FAL稳定性的影响。取0.10 mg/mL FAL溶液5 mL,分别加入5 mL 0.20 mg/mL的Na+、K+、Mg2+、Ca2+、Zn2+、Cu2+、Al3+、Fe3+溶液,25 ℃下放置2 h,测定吸光值。
1.2.4 HepG2细胞培养与分组 参照郭增旺等[14]方法。取对数期HepG2细胞分组,正常对照组:不加FAL和H2O2干预处理;模型组:不加FAL干预,加入H2O2干预;实验组:分别加入终浓度为50、100、200 ?g/mL沉香叶黄酮溶液(依次为FAL-L、FAL-M、FAL-H)干预24 h后,再加入H2O2干预。H2O2干预采用终浓度2 mmol/L的H2O2溶液作用于HepG2细胞1 h。对照组和模型组加入等量PBS溶液代替FAL。
1.2.5 细胞存活率的测定 参照马萍等[15]方法。
1.2.6 细胞内ROS水平的测定 参考Wang等[16]方法。
1.2.7 细胞内LDH、MDA水平和CAT、SOD、GSH-Px活力测定 参考刘亭等[17]方法,按照试剂盒说明书检测。
2 结果与分析
2.1 FAL稳定性的测定
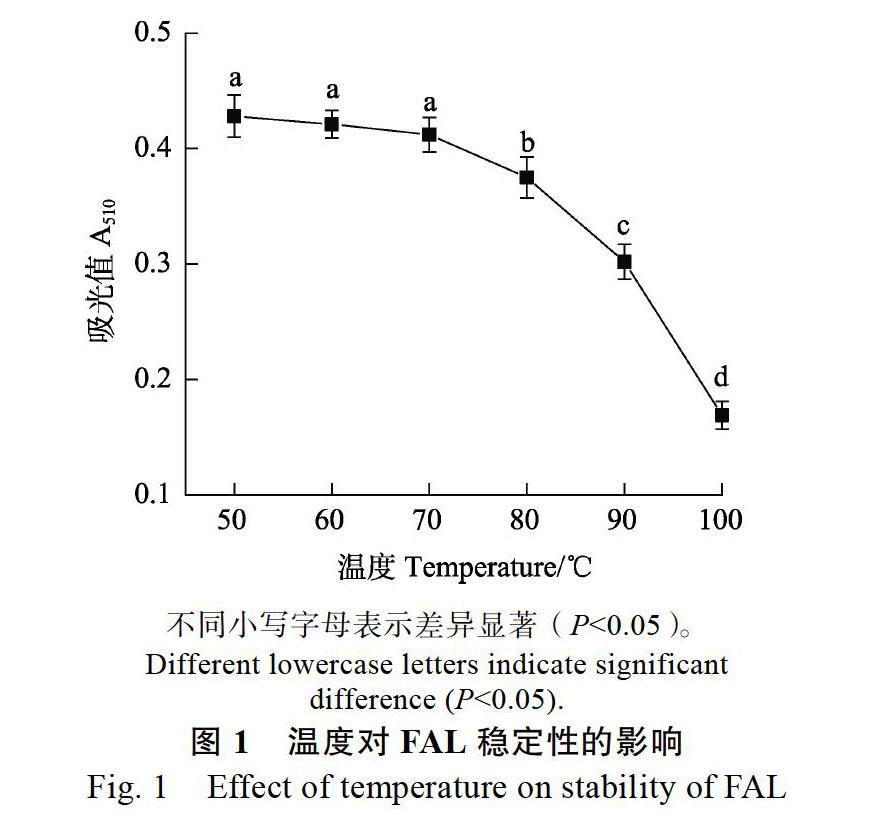
2.1.1 温度对FAL稳定性的影响 由图1可知,当温度低于70 ℃,随着温度升高,FAL溶液吸光值变化不大,说明FAL在70 ℃内较稳定;当温度大于70 ℃时,随着温度升高,FAL吸光值逐渐下降,温度越高降幅越大。由此可知,保存FAL应避免70 ℃以上高温。
2.1.2 pH对FAL稳定性的影响 由图2可知,FAL溶液在pH 3~7条件下,吸光值较高;pH小于3或者大于7,吸光值均降低,说明FAL在较强酸性或者碱性环境下易受到破坏。保存FAL应避免强酸或碱性环境。
2.1.3 光照对FAL稳定性的影响 由图3可知,不同光照条件下,FAL溶液吸光值:黑暗环境>节能灯光>晴朗日光>紫外灯,说明FAL在黑暗环境和节能灯光环境下具有较高稳定性,对紫外线敏感,FAL应置于棕色瓶中避光保存。
2.1.4 金属离子对FAL稳定性的影响 由表1可知,Na+、K+、Mg2+、Ca2+对FAL溶液吸光值影响较小;Zn2+、Cu2+、Al3+、Fe3+对FAL影响较大,可能是黄酮化合物中羟基或羧基,可与某些金属离子发生络合反应,降低了吸光值。保存FAL时应避开含有Zn2+、Cu2+、Al3+、Fe3+的溶剂或容器。
2.2 FAL对H2O2诱导HepG2细胞存活率的影响
细胞存活率反映了细胞受外界环境损伤的程度。氧化应激环境能对HepG2细胞造成氧化损伤,诱导细胞凋亡[18]。由图4可知,与正常组相比,模型组细胞存活率显著下降,说明造模成功。经FAL-L、FAL-M、FAL-H处理细胞存活率达到67.82%±2.15%、75.65%±2.56%、86.56%±2.35%,与模型组相比细胞存活率显著提高,且呈量效关系。说明FAL能够显著提高受损HepG2细胞存活率。
2.3 FAL对H2O2诱导HepG2细胞内ROS水平的影响
正常细胞内ROS生成和清除处于动态平衡。在外界刺激时胞内ROS升高,高浓度ROS直接损伤细胞膜、蛋白质和DNA,诱导细胞凋亡[19]。由图5可知,与正常组相比,模型组中胞内ROS水平显著上升。经FAL-L、FAL-M、FAL-H处理ROS水平为6.76%±0.39%、4.85%±0.36%、1.66%± 0.15%,与模型组相比显著降低,且呈量效关系。说明FAL能显著减缓损伤HepG2细胞内ROS水平升高,减轻细胞氧化损伤。
2.4 FAL对H2O2诱导HepG2细胞内LDH释放水平的影响
LDH是糖酵解和糖异生的重要酶,广泛分布于细胞质中,细胞损伤时,胞内LDH释放到培养基中,其释放水平与细胞损伤程度呈正相关,因此LDH释放水平可反映细胞受损程度[20]。由图6可知,与正常组相比,模型组的胞内LDH水平显著上升。经FAL-L、FAL-M、FAL-H处理LDH水平为(1241.35±102.02)、(934.45±61.98)、(555.68± 32.12)U/L,与模型组相比显著降低,且呈量效关系。说明FAL能显著减少细胞内LDH外漏,减轻细胞膜受损程度。
2.5 FAL对H2O2诱导HepG2细胞内MDA含量的影响
机体自身抗氧化调节系统能够抵抗外界一定程度氧化应激刺激[21],但当氧化应激程度较强烈,机体抗氧化系统不能完全调控时,细胞就会受到氧化损伤。MDA是脂质发生过氧化反应生成的重要代谢产物,其含量高低可反映细胞受自由基损伤程度[22]。由图7可知,与正常组相比,模型组胞内MDA浓度显著上升。经FAL-L、FAL-M、FAL-H处理ROS水平为(14.18±0.65)、(11.28± 0.72)、(7.35±0.58)nmol/L,与模型组相比显著降低,且呈量效关系。说明FAL能显著减轻自由基对机体的氧化应激损伤。
2.6 FAL对H2O2诱导HepG2细胞内SOD活力的影响
SOD是细胞内源性抗氧化物酶[23],能清除机体内过多的ROS和MDA,其活力對细胞氧化与抗氧化平衡起着重要作用[24],具有保护机体的作用,是抵御氧化应激刺激的第一道防线。由图8可知,与正常组相比,模型组组胞内SOD活力显著降低。经FAL-L、FAL-M、FAL-H处理SOD活力为(180.78±15.72)、(225.65±18.72)、(280.56±16.68)U/mg,与模型组相比显著升高,且呈量效关系。说明FAL能显著提高HepG2细胞氧化应激损伤后胞内SOD活力。
2.7 FAL对H2O2诱导HepG2细胞内CAT活力的影响
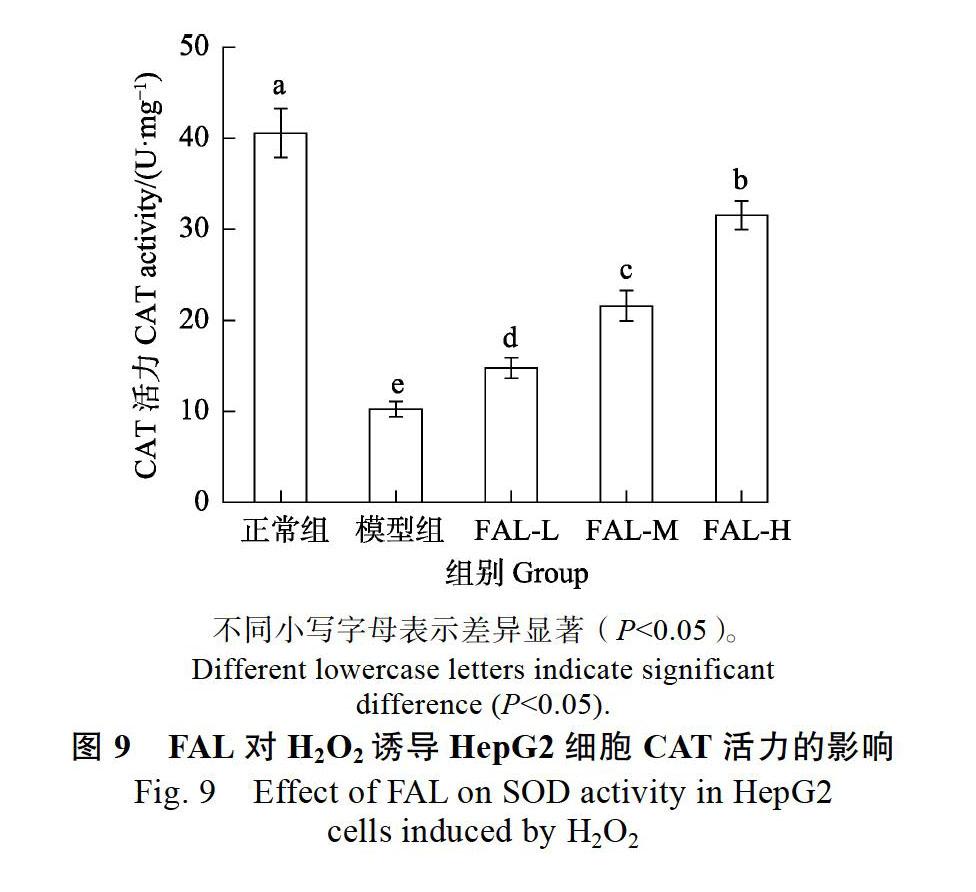
CAT是内源性抗氧化酶,能有效清除各种活性氧基团,防止其损坏细胞膜系统[25]。由图9可知,与正常组相比,模型组胞内CAT活力显著降低。经FAL-L、FAL-M、FAL-H处理CAT活力为(14.78±1.12)、(21.58±1.68)、(31.56±1.58)U/mg,与模型组相比显著升高,且呈量效关系。说明FAL能显著提高HepG2细胞氧化应激损伤后胞内CAT活力。
2.8 FAL对H2O2诱导HepG2细胞内GSH-Px活力的影响
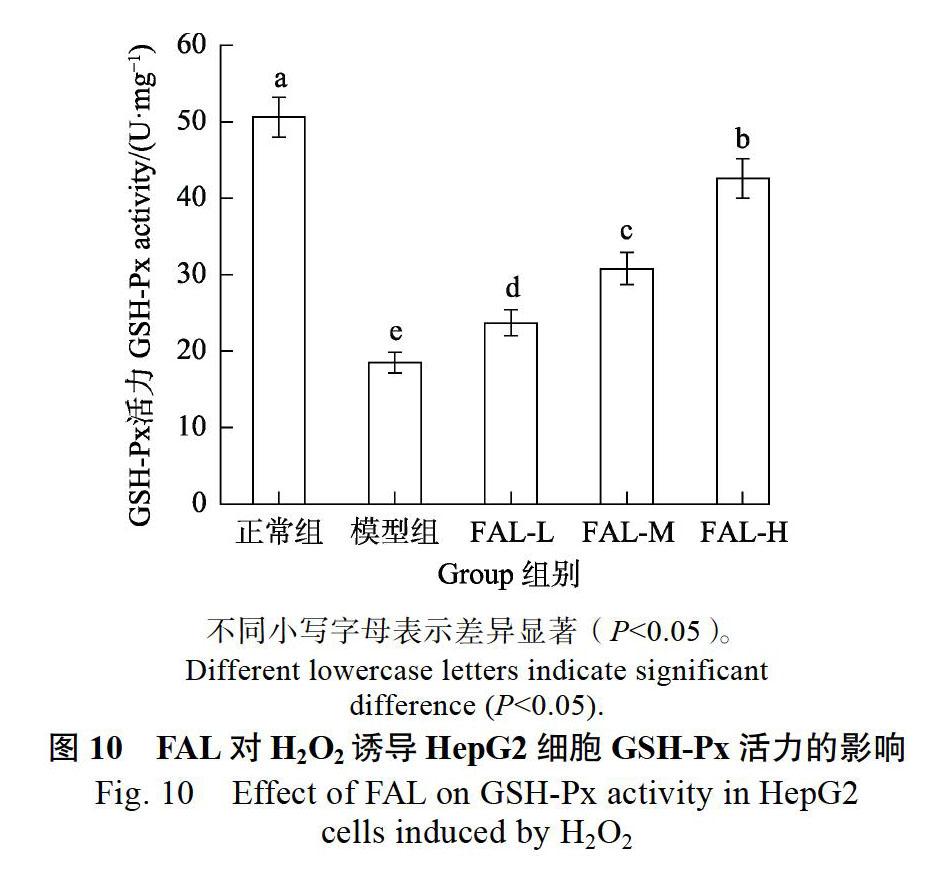
GSH-Px能催化GSH变为氧化型谷胱甘肽(GSSG),将过氧化物还原成羟基化合物;与CAT促进H2O2分解,以保护细胞膜结构与功能[26]。由图10可知,与正常组相比,模型组胞内GSH-Px活力显著降低。经FAL-L、FAL-M、FAL-H处理CAT活力为(23.68±1.68)、(30.78±2.12)、(42.58± 2.58)U/mg,与模型组相比显著升高,且呈量效关系。说明FAL能显著提高HepG2细胞氧化应激损伤后胞内GSH-Px活力。
3 讨论
黄酮的稳定性对其保存及产业化应用非常重要。从温度、pH、金属离子、光照环境4个方面探讨FAL稳定性。结果表明,FAL溶液在温度70 ℃以下,pH 3~7范围内,Na+、K+、Mg2+、Ca2+金属离子中,黑暗环境与节能灯光中较稳定。这与葛水莲等[27]研究太行菊黄酮对温度、pH、金属离子、光照的稳定性变化趋势类似,但各指标存在差异,这可能是不同植物中黄酮的结构与含量不同,表现出稳定性差异。
氧化應激是ROS水平和内源性抗氧化能力之间细胞氧化还原失衡,超出自身调节范围,引起的机体损伤。H2O2是一种重要ROS,可转变为羟自由基作用于细胞引起氧化损伤[28],常用于细胞氧化损伤研究。HepG2细胞与人正常肝实质细胞含有同源性的生物转化代谢酶,保留了该酶的稳定性和完整性,广泛用于实验研究[29]。当机体受到氧化应激损伤时,加速自由基和ROS形成,引发脂质过氧化反应生成大量MDA;改变细胞膜通透性,加速细胞质中LDH向外释放;引发自由基链反应,消耗大量SOD、CAT、GSH-Px等抗氧化剂,引起细胞凋亡[21, 30],降低细胞存活率。大量研究表明[15],补充抗氧化成分,能够帮助机体维持氧化动态平衡。因此,研究开发天然抗氧化物质日益受到人们的重视。
前期研究结果表明[12],沉香叶黄酮具有较强清除DPPH自由基、ABTS自由基能力,但未从细胞水平评价其抗氧化性,阐述其作用机制。为进一步研究沉香叶黄酮抗氧化性,本研究建立H2O2诱导HepG2细胞损伤模型研究FAL的保护作用。模型组中细胞存活率显著降低,ROS、LDH、MDA含量显著升高,SOD、CAT、GSH-Px活力显著下降,表明造模成功。不同质量浓度的FAL作用于损伤的HepG2细胞时,能显著提高HepG2细胞存活率,且其呈量效关系,说明FAL对HepG2细胞氧化损伤具有保护作用。FAL可抑制细胞中MDA和ROS生成,降低脂质过氧化物和ROS含量,减轻LDH向外扩散程度,提高SOD、CAT、GSH-Px 3种重要内源性抗氧化物酶活性。这与郭增旺等[14]研究小米糠黄酮保护H2O2诱导HepG2氧化应激损伤时,ROS、MDA、SOD、CAT、GSH-Px指标变化趋势类似,但各指标存在差异。说明不同物质提取的黄酮对氧化应激的调控能力不同,这可能与黄酮的种类、含量,以及黄酮单体之间表现出协同或者拮抗作用有关。
一方面,FAL通过降低机体中MDA含量,减缓细胞膜系统氧化损伤,保持细胞结构与功能完整性,减轻LDH向细胞外扩散程度;另一方面,通过提高细胞中SOD、CAT、GSH-Px活力,增强抗氧化系统防御能力,清除机体中过多ROS和MDA,保护细胞氧化损伤。由此推测,FAL对氧化应激损伤细胞保护作用可能与其调节细胞氧化还原系统,清除胞内ROS水平,提高细胞内抗氧化酶活性,维持细胞膜系统稳定性有关。在今后的研究中,应从分子层面对FAL参与调控特定信号通路,保护细胞氧化应激损伤机制方面开展深入研究。
参考文献
[565] Feng Ruo, Zhai Wen Long, Yang Hai Yan, et al. Induction of ER stress protects gastric cancer cells against apoptosis induced by cisplatin and doxorubicin through activation of p38 MAPK[J]. Biochemical and Biophysical Research Communications, 2011, 406(2): 299-304.
[566] Chaudhary A, Sharma U, Vig A P, et al. Free radicalscavenging, antiproliferative activities and profiling of variations in the level of phytochemicals in different parts of broccoli (Brassica oleracea italica)[J]. Food Chemistry, 2014, 148(4): 373-380.
[567] 梁寒峭, 温 欣, 张大为, 等. 白木香内生真菌发酵产物抑制HIV-1整合酶活性筛选[J]. 中国药学杂志, 2013, 48(16): 1352-1358.
[568] Watanabe C, Shu G L, Giltiay N V, et al. Regulation of B-lineage cells by caspase 6[J]. Immunology & Cell Biology, 2018, 96(10): 1072-1082.
[569] Cai H K, Chen X, Zhang J B, et al. 18β-glycyrrhetinic acid inhibits migration and invasion of human gastric cancer cells via the ROS/PKC-α/ERK pathway[J]. Journal of Natural Medicines, 2018, 72(1): 252-259.
[570] Shih K C, Lam K S, Tong L.A systematic review on the impact of diabetes mellitus on the ocular surface[J]. Nutrition & Diabetes, 2017, 7(3): e251.
[571] Baliga M S, Shivashkara A R, Hanianka R, et al. Phytochemistry, nutritional and pharmacological properties of Artocarpus heterophyllus Lam (jackfruit): A review[J]. Food Research International, 2011, 44(7): 1800-1811.
[572] Wang S L, Hwang T L, Chung M I, et al. New flavones, a 2-(2-phenylethyl)-4H-chromen-4-one derivative, and anti-inflammatory constituents from the stem barks of Aquilaria sinensis[J]. Molecules, 2015, 20(11): 20912-20925.
[573] Shen N, Huang X D, Li Z W, et al. Effects of Hemerocallis citrine baroni flavonids on CCl4-induced liver fibrosis of rats[J]. Acta pharmaceutica Sinica, 2015, 50(5): 547-551.
[574] Paukle A, Nolder M, Schubert M, et al. St. Johns wort flavonoids and their metabolites show antidepressant activity and accumulate in brain after multipleoral doses[J]. Pharmazie, 2008, 63(4): 296-302.
[575] 何 艾, 李维国, 窦志浩, 等. 纤维素酶辅助提取沉香叶黄酮及其抗氧化性活性测定[J]. 食品科技, 2015, 40(5): 233-237.
[576] 段宙位, 李维国, 窦志浩, 等. 沉香叶黄酮类化合物的提取及其抗氧化活性[J]. 食品科学, 2015, 36(6): 45-50.
[577] 吕开原, 雷智冬, 刘元瑞, 等. 沉香的倍半萜类化学成分研究[J]. 中草药, 2020, 51(9): 2390-2394.
[578] 郭增旺, 樊乃境, 田海芝, 等. 小米糠黄酮对H2O2致HepG2氧化应激损伤的保护作用[J]. 食品科学, 2020, 41(5): 159-165.
[579] 马 萍, 程天赋, 郭增旺, 等. 紫花芸豆肽修复H2O2对HepG2细胞的氧化应激损伤[J]. 食品科学, 2020, 41(1): 175-182.
[580] Wang W, Mao S H, Yu H L, et al. Pinellia pedatisecta lectin exerts a proinflammatory activity correlated with ROSMAPKs/NF-κB pathways and the NLRP3 inflammasome in RAW264.7 cells accompanied by cell pyroptosis[J]. International Immunopharmacology, 2019, 66: 1-12.
[581] 刘 亭, 吴 琼, 刘香香, 等. 荭草花醇提物对H2O2诱导的H9c2细胞氧化损伤的保护作用机制研究[J]. 天然产物研究与开发, 2018, 30(2): 299-303.
[582] Zhang Z, Ren Z, Chen S, et al. ROS generation and JNK activation contribute to 4-methoxy - TEMPO - induced cytotoxicity, autophagy, and DNA damage in HepG2 cells[J]. Archives of Toxicology, 2018, 92(2): 717-728.
[583] Konig J, Wells J, Cani P D, et al. Human intestinal barrier function in health and disease[J]. Clinical and Translational Gastroenterology, 2016, 7(10): e196.
[584] Li B, Zani A, Martin Z, et al. Intestinal epithelial cell injury is rescued by hydrogen sulfide[J]. Journal of Pediatric Surgery, 2016, 51(5): 775-778.
[585] 申迎賓. 四种谷物多酚抗氧化、降血脂作用评价研究[D]. 无锡: 江南大学, 2016.
[586] Bedoya R D, Cilla A, Contreras C, et al. Evaluation of the antioxidant capacity, furan compounds and cytoprotective/cytotoxic effects upon Caco-2 cells of commercial Colombian coffee[J]. Food Chemistry, 2017, 219: 364-372.
[587] 郭玉文, 曹婧然, 何立杰. 细胞水平的抗氧化机制研究进展[J]. 医学综述, 2016, 22(1): 13-16.
[588] 罗 磊, 张冰洁, 马丽苹, 等. 金银花叶黄酮体外抗氧化能力及对H2O2诱导RAW264.7巨噬细胞损伤的保护作用[J]. 食品科学, 2018, 39(11): 139-145.
[589] 宋家乐, 钱 波, 王程强, 等. 紫芜菁乙醇提物对Caco-2细胞氧化损伤的保护作用[J]. 现代食品科技, 2018, 34(6): 32-38.
[590] Casimirri E, Stendardo M, Bonci M, et al. Biomarkers of oxidative-stress and inflammation in exhaled breath condensate from hospital cleaners[J]. Biomarkers, 2016, 21(2): 115-122.
[591] 葛水蓮, 陈建中, 刘 娜, 等. 太行菊总黄酮抗氧化活性及稳定性研究[J]. 食品科技, 2019, 44(10): 241-245.
[592] Tanaka Y, Kirita M, Abe Y, et al. Metabolic stability and inhibitory effect of O-methylated theaflavins on H2O2 - induced oxidative damage in human HepG2 cells[J]. Bioscience, Biotechnology, and Biochemistry, 2014, 78 (7): 1140-1146.
[593] 刘 艳, 张海欣, 魏 颖, 等. 小麦低聚肽对H2O2所致HepG2细胞氧化损伤的保护作用[J]. 食品与生物技术学报, 2015, 34(6): 599-604.
[594] 戴应和, 张丽梅, 杨淑贤, 等. 松花粉对H2O2诱导HepG2细胞氧化损伤的保护作用[J]. 中国实验方剂学杂志, 2017, 23(19): 167-173.
责任编辑:谢龙莲
