枳橙四倍体与二倍体干旱生理应答及水通道蛋白基因表达分析
2021-08-04李晓妍陈芝琳钟八莲
彭 滢,李晓妍,陈芝琳,彭 婷,2,钟八莲,2,肖 璇,2
(1 赣南师范大学生命科学学院,江西赣州,341000;2 国家脐橙工程技术研究中心,江西赣州,341000)
干旱是影响柑桔产量最重要的非生物胁迫因素之一。我国柑桔大部分集中在南部和东南部地区,受季节性干旱胁迫的问题较突出[1]。柑桔作为嫁接繁殖为主的果树,选择抗逆性和适应性更强的砧木对生产有重要影响[2]。与二倍体相比,多倍体植株通常在形态、组织结构、生理代谢等方面发生明显变化,具有更强的抗逆性[3-5]。近年来柑桔研究者通过实生选种方法已发掘大量多倍体砧木资源[6-7]。研究表明,枳四倍体成熟叶片可积累更多的柠檬酸、苹果酸、延胡索酸等初生代谢产物[8],干旱胁迫下枳四倍体具有更高的活性氧清除能力并可积累更多的可溶性糖[9]。近年来,部分水通道蛋白(aquaporin,AQPs)已被证实参与植物对水分的运输[10-11]。根据序列的同源性及亚细胞定位差异可将AQPs分为4大类[12]:(1)细胞质膜水孔蛋白(PIP),(2)根瘤菌和豆科植物的共生膜上的类Nod26 膜水孔蛋白(NIP),(3)液泡膜上小分子碱性膜水孔蛋白(SIP),(4)泡膜水孔蛋白(TIP)。目前,关于柑桔四倍体砧木资源耐旱性鉴定、生理应答及水通道蛋白基因表达方面研究仍较少。枳橙[Citrussinensis(L.) Osb.×Poncirustrifoliata(L.) Raf.]是甜橙与枳的杂种,具多胚性,为柑桔主要砧木之一。笔者以枳橙二倍体为对照,对干旱胁迫下枳橙四倍体植株叶片失水表型、生理响应以及水通道蛋白基因表达差异进行分析,对枳橙四倍体耐旱能力进行评价和初步解析。
1 材料与方法
1.1 试验材料及处理
研究于2019年6月在国家脐橙工程研究中心进行。供试材料为2年生的枳橙二倍体和同源四倍体。枳橙同源四倍体为本课题组从枳橙实生苗筛选获得,经SSR分子标记鉴定其来源可能为二倍体母本珠心组织基因组加倍[13]。采用盆栽控水自然干旱方式进行干旱胁迫处理。塑料圆盆直径15 cm、高22 cm,基质为果园10 cm深处园土和营养土等体积混和而成。6月下旬盆栽定植于遮雨网室,自然光、温条件,试验前每天浇透水1次,连续3 d,最后一次浇透水后进行自然干旱胁迫处理。分别在最后一次浇透水后当天(0 d)及3 d、6 d、9 d、12 d、15 d及复水5 d后取样(连续自然干旱15 d后开始复水,复水后每天均浇透水1次)。每个取样日,于上午9点定时采摘当年新梢从上向下数第4—6节位叶片(干旱胁迫前均为完全舒展的健康叶片),进行相关生理生化指标测定及总RNA提取。叶片离体脱水试验取正常浇水的健康叶片,具体参照Wei等[9]方法进行。每3株采摘叶片混为一组,重复测定3次。
1.2 测定方法
超氧化物歧化酶(Superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)含量、脯氨酸(Proline,Pro)含量及相对电导率的测定参照李合生[14]的方法,过氧化物酶(Peroxidase,POD)活性采用愈创木酚法[15]。
RNA提取参照Trizol试剂盒(Life Technologies,Inc.,Carlsbad,CA,USA)方法进行。采用NanoDrop 2000超微量核酸蛋白分析仪(Thermo Scientific,USA)测定RNA浓度。采用TaKaRa的PrimeScriptTMRT reagent Kit将RNA反转录为cDNA,统一稀释至150 ng/μL,作为荧光定量的模板。以β-actin基因为内参[16]。实时定量PCR所用水通道蛋白基因引物参照冯芳芳[11],由北京擎科生物技术有限公司合成,具体见表1。应用 SYBR Green 荧光染料法在Roche公司Light Cycler®480荧光定量PCR仪上进行扩增分析。采用2-△△ct法分析基因相对表达量[17]。

表1 针对各水通道蛋白基因进行Real-time qPCR 的引物序列
叶片离体脱水试验中相对失水率计算公式如下:相对失水率(%)=[(W0-Wn)/W0]×100%,W0为叶片离体失水处理前叶片鲜质量,Wn为叶片离体失水处理n小时后的质量。
1.3 数据分析
试验数据用Excel 2016进行整理,用SPSS 21.0进行显著性差异分析。
2 结果与分析
2.1 干旱胁迫下的形态差异
干旱处理前,两种倍性枳橙的叶片均呈绿色、自然舒展状(图1A);干旱8 d,二倍体植株失水明显,整株叶片呈萎蔫状,部分叶片失绿黄化;与之不同的是,四倍体植株仅呈轻度萎蔫状,叶片黄化不明显(图1B);干旱15 d,二倍体植株的叶片失水严重,整株叶片黄化枯萎(图1C),四倍体植株仅梢端嫩叶萎焉严重。从干旱胁迫后盆栽植株及叶片表型来看,四倍体枳橙比二倍体枳橙具更强的耐旱性。

注:A.干旱0 d,B.干旱8 d,C.干旱15 d;在图A、B、C中,左为二倍体,右为四倍体。
2.2 离体叶片的失水率差异
叶片离体脱水试验结果看出,随着叶片离体脱水时间的增加,二倍体和四倍体枳橙叶片相对失水率均不断上升,但同一时间四倍体和二倍体的相对失水率差异均不显著(图2)。
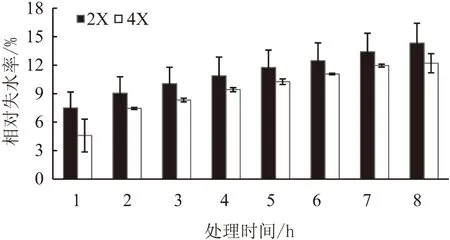
图2 离体不同时间后枳橙二倍体和四倍体叶片的相对失水率
2.3 干旱胁迫下的叶片相对电导率差异
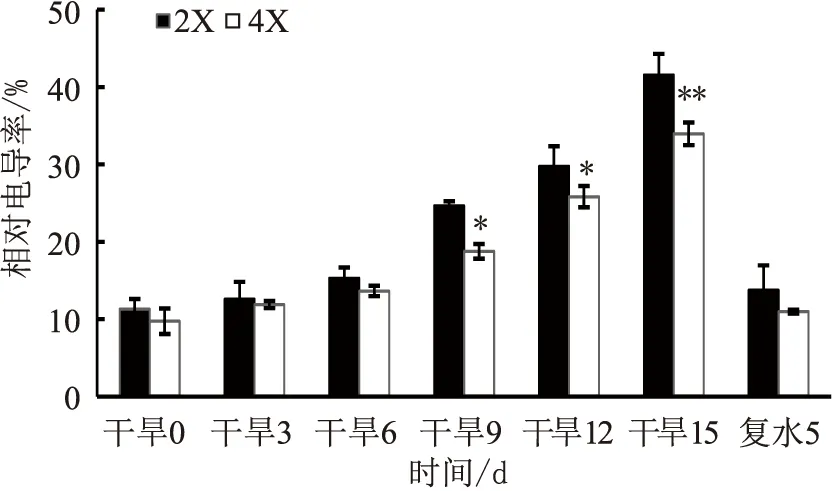
干旱处理前期,两种倍性叶片的相对电导率相差不显著;随着干旱的进行,二倍体和四倍体叶片的相对电导率均呈上升趋势,且从干旱9 d开始有显著性差异(p<0.05),二倍体叶片的相对电导率始终高于四倍体;复水后5 d,两者的相对电导率均迅速下降,且两者差异不显著(见图3)。说明,在干旱胁迫下四倍体叶片的细胞质膜受损要小于二倍体。
2.4 干旱胁迫下的叶片MDA含量差异
随着干旱胁迫的进行,二倍体和四倍体叶片的MDA含量均呈上升趋势,说明两种倍性植株叶片组织细胞膜受损程度不断加重。从干旱胁迫12 d开始,二倍体叶片的MDA含量显著高于四倍体(p<0.05)。复水后5 d,两种倍性叶片的MDA含量都迅速下降,但二倍体仍显著高于四倍体(见图4)。
注:“*”表示差异达显著水平(p<0.05);“**”表示差异达极显著水平(p<0.01)。图4至图7同。

图4 干旱胁迫对两种倍性枳橙叶片MDA含量的影响
2.5 干旱胁迫下的叶片活性氧去除相关酶活性差异
随着干旱胁迫的进行,两种倍性枳橙叶片SOD活性表现为先升后降;二倍体在干旱6 d达到最大值,四倍体在干旱9 d达到最大值;自干旱胁迫9 d开始,四倍体的SOD活性始终高于二倍体(见图5)。随着干旱胁迫的进行,两种倍性枳橙叶片POD活性总体也呈先升后降趋势;在干旱6 d均达到最大值,但此时四倍体的POD活性显著高于二倍体,其他时期均无显著差异(见图6)。复水后5 d,两种酶活均接近于正常状态,四倍体恢复速率较二倍体快(见图5和图6)。

图5 干旱胁迫对两种倍性枳橙叶片SOD活性的影响

图6 干旱胁迫对两种倍性枳橙叶片POD活性的影响
2.6 干旱胁迫下的叶片Pro含量差异
随着干旱胁迫的进行,两种倍性的叶片Pro含量均有所上升;复水后5 d,两者Pro含量均有所下降。在干旱9 d时四倍体的Pro含量高于二倍体(p<0.05),其他时期两者无显著差异(见图7)。
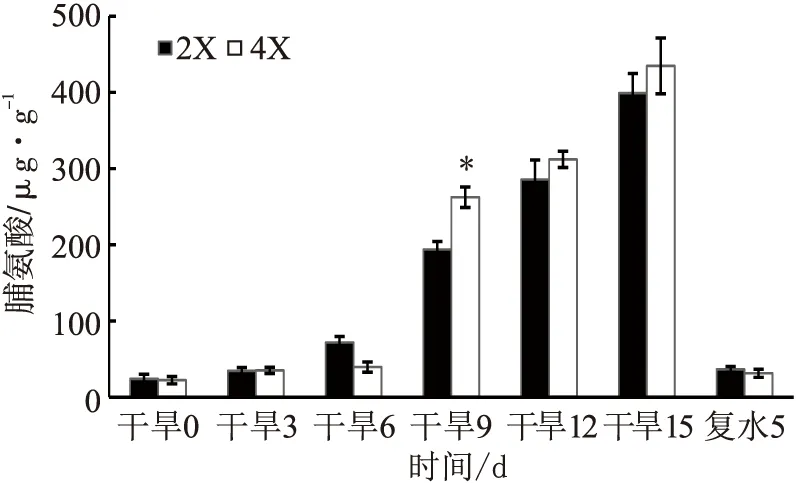
图7 干旱胁迫对两种倍性枳橙叶片Pro含量的影响
2.7 干旱胁迫下的叶片水通道蛋白基因表达差异
植物水分跨膜运输主要是由水通道蛋白(AQPS)所主导。从干旱胁迫下二倍体和四倍体叶片中9个水通道蛋白基因表达模式来看,干旱胁迫会引起水通道蛋白基因表达的变化,且PIP、NIP、TIP、SIP4种类型基因在两种倍性叶片中表达量的变化情况不一致。在干旱胁迫条件下,二倍体叶片中PtrPIP1;2、PtrPIP1;3、PtrPIP2;2、PtrNIP1;2、PtrTIP1;3、PtrTIP4;1、PtrSIP1;1、PtrSIP1;2表达量总体呈下调趋势,其中PtrTIP4;1表达量持续下调,其他都是先上调再下调;PtrNIP1;1表达量则呈总体上调趋势。在干旱胁迫条件下,四倍体叶片中PtrNIP1;1、PtrNIP1;2、PtrTIP4;1、PtrSIP1;2表达量总体下调;PtrPIP1;2、PtrPIP1;3、PtrPIP2;2、PtrTIP1;3、PtrSIP1;1表达量上调,除了PtrSIP1;1外,均在干旱15 d达到最大值。在干旱胁迫15 d时,9个水通道蛋白基因中,只有PtrNIP1;1的表达量是二倍体高于四倍体,其余8个基因均是二倍体中的表达量低于四倍体(见图8)。
3 讨论
干旱胁迫下,植物在表型上会出现一系列的失水症状。本研究中,干旱胁迫下二倍体枳橙叶片萎蔫、黄化比四倍体枳橙更为严重,表明四倍体枳橙的耐旱性更强。两者在耐旱性上的差异,可能与其在干旱应答生理及水分运输相关的水通道蛋白基因表达差异有关。
3.1 干旱胁迫下生理响应差异对耐旱性的影响
四倍体植物在形态、生理代谢等方面的变化通常表现出比二倍体更加耐旱的特性[18-19]。相对失水率可反映植物叶片的持水能力,相对失水率越小,其持水能力则越高,耐旱性越强。相对电导率则反映植物组织细胞质膜在逆境胁迫中受损的程度,从而作为植物抗逆性的一个生理指标。MDA是膜脂过氧化的主要产物之一,MDA含量越高同样表明细胞膜受伤害程度越大[20]。本研究表明,在干旱处理过程中,四倍体枳橙叶片的相对失水率、相对电导率及MDA含量均低于二倍体,说明四倍体的质膜受损程度较二倍体要轻,四倍体的抗旱性更强。这与邓敏捷等[21]在泡桐四倍体抗旱性研究中的结果类似。

注:不同小写字母表示相同材料不同干旱时间处理之间的相对表达量差异达显著水平(p<0.05)。
干旱胁迫下,植物体内活性氧含量会急速增加,可导致膜脂过氧化甚至膜蛋白的降解[22]。超氧化物歧化酶(SOD)和过氧化物酶(POD)是植物体内清除活性氧重要的保护酶之一,能清除活性氧自由基,减轻活性氧对植株造成的伤害,维持细胞膜的稳定[23]。脯氨酸(Pro)含量的增加可有效调节细胞质内渗透过程,防止细胞脱水,是重要的抗旱生理指标[24]。本研究表明,在干旱胁迫过程中,二倍体枳橙和四倍体枳橙叶片的SOD、POD含量表现为先升后降趋势,但干旱胁迫后四倍体的SOD及POD活性基本都高于二倍体,说明干旱胁迫下四倍体的活性氧清除能力比二倍体更强;干旱胁迫后期SOD、POD酶活性有所下降,其原因可能与干旱胁迫导致细胞受损有关[25]。本研究中,干旱处理前6 d,两种倍性枳橙叶片Pro含量均缓慢增加且两者含量差异不显著;在干旱9 d时Pro含量迅速增加,四倍体Pro显著高于二倍体,表明干旱胁迫下四倍体渗透调节能力更强。这些结果与尚小红等[26]研究四倍体木薯耐旱的生理响应类似,进一步表明四倍体枳橙对干旱胁迫有更强的调节适应能力。
3.2 干旱胁迫下水通道蛋白基因表达对耐旱性的影响
植物水通道蛋白基因(AQPs)主要参与植物体内的水分运输、渗透调节以及对养分的吸收[27]。受干旱环境的影响,AQPs可增强细胞的水分跨膜运输能力[28]。本研究对枳橙叶片部分AQP基因进行了分析,结果显示干旱胁迫中大部分基因在四倍体中是显著上调且表达量高于二倍体,这一结果与薛浩等[29]类似。植物水通道蛋白与生理特征是密切相关的[30],在逆境胁迫下两者共同调控和发挥作用,应对环境变化。
在干旱胁迫下,二倍体和四倍体两种倍性枳橙生理应答及水通道蛋白基因表达分析结果,与两种倍性枳橙叶片离体脱水及盆栽植株自然干旱鉴定的结果基本一致。植物的抗旱性是一个复杂的过程,本研究从干旱生理应答与水通道蛋白基因表达角度对枳橙二倍体和四倍体抗旱能力差异进行比较分析,进一步加深了对枳橙四倍体抗旱机制的认识。关于植物水通道蛋白基因在枳橙干旱胁迫中的具体功能及作用机制还有待进一步的深入解析。
