乌灵胶囊对卒中后抑郁大鼠海马P13K/Akt/mTOR通路和神经递质的影响*
2021-08-04孙微王一帆李贺刘影
孙微,王一帆,李贺,刘影
(1.深圳市萨米医疗中心,广东 深圳518118;2.北华大学,吉林 吉林132013;3.上海市松江区中心医院,上海201600)
卒中后抑郁是最常见的一种卒中相关情绪障碍,主要是指在脑卒中后发生的由多种复杂因素导致的一种情感障碍性疾病[1-2]。临床调查显示,卒中后抑郁发病率呈不断上升趋势,严重影响人们生活质量[3]。卒中后抑郁不仅直接影响神经功能,而且会增加脑卒中的致残率及病死率,给社会和家庭带来沉重负担[4]。卒中后抑郁具体发病机制较为复杂,其中神经递质在卒中后抑郁中发挥重要作用,认为神经递质与记忆、睡眠及情感等密切相关,其功能或水平下降,是抑郁症发病的生物学基础[5]。近年来中医药在卒中后抑郁方面有较大进展,且获得良好效果,乌灵胶囊是一种中成药,具有养心安神、清心化痰、补肾健脑功效,用于抑郁症方面获得良好效果[6]。因此,本文研究通过探讨乌灵胶囊对卒中后抑郁大鼠海马P13K/Akt/mTOR 通路和神经递质的影响,为治疗卒中后抑郁及其相关作用机制的研究提供参考,现报道如下。
1 材料与方法
1.1 实验动物和药物
健康SD 大鼠48 只,体重(200±20)g,雌雄各半。适应性饲养1 周,自由饮食饮水。SD 大鼠购自中国中医科学院实验动物中心,动物生产许可证号:SCXK2018-0001,动物使用许可证号:SYXK2018-0001。乌灵胶囊购自浙江佐力药业股份有限公司,规格0.33 g,国药准字Z19990048。
1.2 主要试剂
大鼠去甲肾上腺素(Norepinephrine, NE)和多巴胺(Dopamine, DA)试剂盒购自北京博蕾德生物科技有限公司,大鼠5-羟色胺(5-hydroxytryptamine, 5-HT)购自北京博蕾德生物科技有限公司,P13K 抗体、p-Akt 抗体、p-mTOR 抗体购自美国Abcam 公司。
1.3 方法
1.3.1 卒中后抑郁模型的复制采用改良Zea-Longa 法复制大脑中动脉缺血大鼠模型(MCAO 模型),具体方法:术前大鼠禁水、禁食24 h,腹腔注射0.35 ml/100 g 的8%水合氯醛麻醉,大鼠麻醉成功后取仰卧位,将其固定于操作台,常规备皮消毒,沿大鼠颈正中行1.5~2.0 cm 纵行切口,切口处皮下组织采用钝行分离,沿大鼠右侧颈前肌群和胸锁乳突肌间分离右侧颈内动脉(internal carotid artery,ICA)、颈外动脉(external carotid artery, ECA)和颈总动脉(common carotid artery, CCA),分离颈外动脉和颈内动脉分叉处的迷走神经。ICA 和CCA 采用微动脉夹暂时夹闭,在ICA 近心端置一根丝线,再于ECA 和CCA 分叉3 mm 处剪开一小口,再取鱼线插入ICA 且轻推,最后将微动脉夹取掉。手术完成后逐层缝合并消毒,术后大鼠腹腔注射40 000 u/(次·d)青霉素,共3 d,以预防电解质紊乱和感染。模型复制成功后于第2 天大鼠单笼饲养,皮下注射利血平复制卒中后抑郁模型,4 mg/kg,1 次/d,连续15 d;对照组等量皮下注射相同天数的生理盐水。
1.3.2 实验分组及干预方法48 只大鼠随机分为对照组、模型组、低剂量组和高剂量组,每组12 只,雌雄各6 只。对照组和模型组予以等剂量双蒸水灌胃;低剂量组于模型复制成功后第2 天开始将40 mg 乌灵胶囊溶于1 ml 双蒸水灌胃,1 次/d;高剂量组于模型复制成功后第2 天开始将80 mg 乌灵胶囊溶于1 ml 双蒸水灌胃,1 次/d。各组大鼠灌胃21 d。
1.4 检测指标
1.4.1 行为学检测采用大鼠Zea Longa 神经行为学评分:无任何神经功能缺损症状为0 分(无缺损);抓取尾部提拎大鼠离开地面,大鼠前爪无法完全伸展为1 分(轻度缺损);大鼠左前肢肌力减弱,及大鼠行走时向左侧旋转为2 分(中度缺损);大鼠向左侧倾倒或无法行走为3 分(重度缺损);大鼠意识丧失昏迷为4 分(无神经功能)。评分越高表示神经功能损伤越严重。
1.4.2 Western blotting 检测大鼠海马组织海马组织PI3K、p-Akt 和p-mTOR 蛋白相对表达量采用RIPA 裂解液匀浆提取总蛋白,蛋白定量测定采用BCA 蛋白浓度测定试剂盒。聚丙烯酰胺凝胶电泳后将蛋白转印至PVDF 膜,加入5%脱脂奶粉,置于室温条件下封闭1 h。采用TBST 溶液洗涤3 次,8 min/次,分别加入PI3K(1∶200)、p-Akt(1∶500)、p-mTOR一抗(1∶1 000)及GAPDH(1∶3 000),4℃条件下孵育过夜。采用TBST溶液洗脱3次,10 min/次,加入IgG 二抗(1∶3 000)室温条件下孵育1 h,再以TBST 溶液洗涤3 次,8 min/次。ECL 化学发光试 剂盒处理后凝胶成像仪显影,采用Image Lab 图像处理软件分析条带灰度值。
1.4.3 海马组织神经递质水平检测取大鼠脑组织,快速剪取右侧海马组织,称重大鼠海马组织后放置于液氮速冻,置入-80℃冰箱冷冻保存待测。取海马组织加入二羟基苯甲酸,于冰浴上超声匀浆30 s,半径15 cm,15 000 r/min 离心12 min,取上清液,采用高效液相色谱法测定海马组织NE、DA 和5-HT 含量。
1.5 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差(±s)表示,比用方差分析,进一步两两比较用SNK-q法,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠海马区组织病理损伤程度
对照组大鼠海马CA1 区神经元结构正常,数量丰富,并且细胞形态规则染色均一,胞质丰富清亮;模型组大鼠海马CA1 区神经元数量明显减少,且脑组织结构松散,细胞染色浅及排列紊乱不对称;低剂量组和高剂量组大鼠海马CA1 区神经元数量较模型组增加,且脑组织结构好转,细胞数量较模型组增加。见图1。
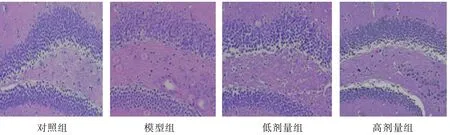
图1 各组大鼠海马CA1区组织病理损伤程度 (HE染色×200)
2.2 各组大鼠Zea Longa评分比较
对照组、模型组、低剂量组和高剂量组大鼠Zea Longa 评分分别为(0.00±0.00)分、(2.70±0.43)分、(2.04±0.2)分和(1.12±0.26)分,经方差分析,差异有统计学意义(F=68.511,P=0.000)。进一步两两比较结果:模型组、低剂量组和高剂量组高于对照组(P<0.05);低剂量组和高剂量组低于模型组(P<0.05);高剂量组低于低剂量组(P<0.05)。
2.3 各组大鼠海马组织PI3K、p-Akt 和p-mTOR蛋白相对表达量比较
对照组、模型组、低剂量组和高剂量组大鼠海马组织PI3K、p-Akt 和p-mTOR 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:模型组、低剂量组和高剂量组低于对照组(P<0.05);低剂量组和高剂量组高于模型组(P<0.05);高剂量组高于低剂量组(P<0.05)。见表1。
表1 各组大鼠海马组织PI3K、p-Akt和p-mTOR蛋白表相对表达量比较 (n=12,±s)
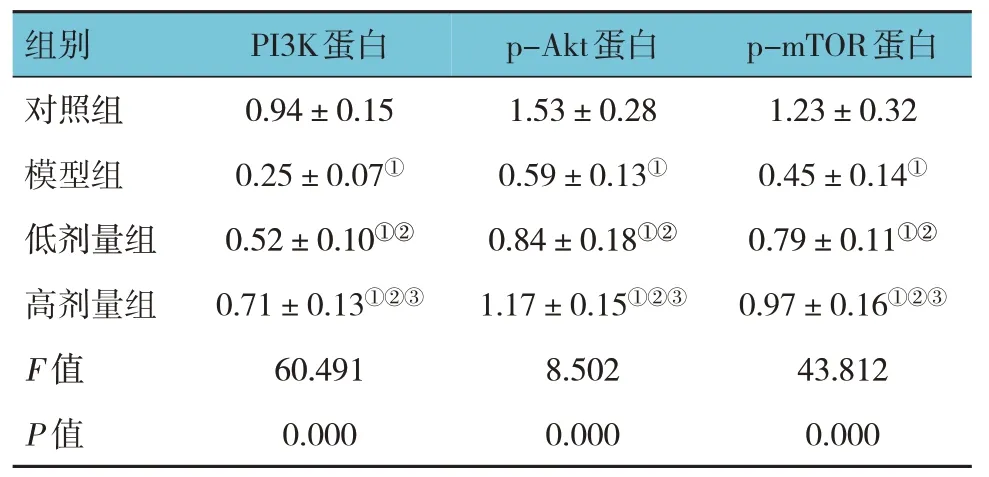
表1 各组大鼠海马组织PI3K、p-Akt和p-mTOR蛋白表相对表达量比较 (n=12,±s)
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05;③与低剂量组比较,P<0.05。
组别p-mTOR蛋白PI3K蛋白p-Akt蛋白对照组模型组低剂量组高剂量组F 值P 值1.23±0.32 0.45±0.14①0.79±0.11①②0.97±0.16①②③43.812 0.000 0.94±0.15 0.25±0.07①0.52±0.10①②0.71±0.13①②③60.491 0.000 1.53±0.28 0.59±0.13①0.84±0.18①②1.17±0.15①②③8.502 0.000
2.4 各组大鼠海马组织NE、DA和5-HT含量比较
对照组、模型组、低剂量组和高剂量组大鼠海马组织NE、DA 和5-HT 含量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:模型组、低剂量组和高剂量组NE、DA 和5-HT 含量低于对照组(P<0.05);低剂量组和高剂量组NE、DA 和5-HT 含量高于模型组(P<0.05);高剂量组NE、DA 含量高于低剂量组(P<0.05);高剂量组5-HT 含量低于低剂量组(P<0.05)。见表2。
表2 各组大鼠海马组织NE、DA和5-HT含量比较(n=12,ng/ml,±s)
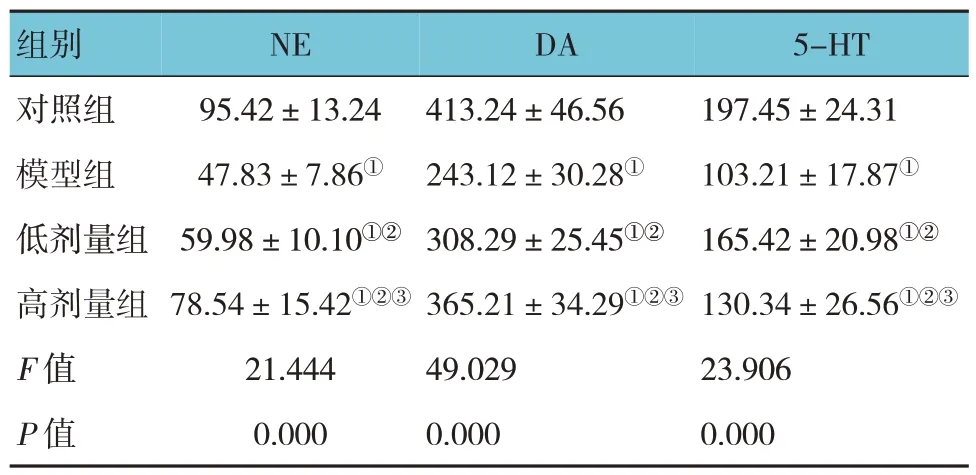
表2 各组大鼠海马组织NE、DA和5-HT含量比较(n=12,ng/ml,±s)
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05;③与低剂量组比较,P<0.05。
5-HT 组别NE DA 197.45±24.31 103.21±17.87①165.42±20.98①②130.34±26.56①②③23.906 0.000对照组模型组低剂量组高剂量组F 值P 值95.42±13.24 47.83±7.86①59.98±10.10①②78.54±15.42①②③21.444 0.000 413.24±46.56 243.12±30.28①308.29±25.45①②365.21±34.29①②③49.029 0.000
3 讨论
卒中后抑郁发病机制较为复杂,尚未完全阐明,主要指脑卒中后发生的抑郁状态,相比于普通抑郁症,卒中后抑郁几乎均有神经功能缺损体征,且患者日常生活能力明显下降,给生活质量带来严重影响,故而卒中后抑郁引起广泛关注[7-11]。乌灵胶囊主要由单一成分乌灵菌粉构成,从真菌乌灵参中分离获得的菌种。乌灵胶囊成分包括含赖氨酸、GABA、Glu、Asp 等多种氨基酸,以及微量元素、鸟苷、腺嘌呤、腺苷等[12-13]。现代药理研究表明,乌灵胶囊可促进GABA 和Glu 进入脑内,激活GABA 受体[14-16]。本研究结果表明,低剂量组和高剂量组大鼠Zea Longa 评分低于模型组,提示乌灵胶囊可改善卒中后抑郁大鼠行为。
细胞自噬主要是对包括神经系统在内的组织结构与功能产生影响。LC3 是重要的自噬标记蛋白,Beclin1 是自噬活化的一种关键因子,自噬形成时LC3B-I 会降解一小段多肽转变为LC3B-Ⅱ,而其中LC3B-Ⅱ/Ⅰ能够衡量细胞自噬水平。而其中mTOR 是自噬发生的抑制性激酶之一,其激活后能够抑制细胞自噬。PI3K/Akt/mTOR 是自噬关键的调节作用。本研究结果表明,卒中后抑郁模型大鼠PI3K、p-Akt 和p-mTOR 蛋白相对表达量降低,而给予乌灵胶囊可上调PI3K、p-Akt 和p-mTOR 蛋白的表达,但其具体作用机制尚未完全明确,还需后续增加样本量进一步研究。
大脑皮质与人的高级神经活动、抽象思维及情绪相关,是脑内重要的一种情感整合中枢。“海马区”是大脑皮质的一个内褶区,在许多病理解剖学和结构影像学中发现,抑郁症患者以海马区为主的边缘结构出现体积萎缩、神经减退等病理现象。海马区的功能在抑郁症发病过程中严重减退,甚者可发生体积明显缩小。卒中后抑郁发病与社会心理因素、环境因素和遗传因素有关,原发性内源性学说是其重要的发病机制。现代药理研究发现,脑卒中损害干扰神经透射,造成单胺类神经递质包括NE、5-HT 含量变化及功能缺陷,导致抑郁症发生。抑郁症存在前额皮质体积减小,而前皮质改变与抑郁症发生有关[17-18]。NE 和5-HT都有神经纤维上行透射至海马,NE 和5-HT 能神经元胞体位于皮质,可影响区域内NE 和5-HT 的神经通路,使海马区NE 和5-HT 含量下降而造成抑郁。本研究结果表明,低剂量组和高剂量组大鼠海马组织NE、DA 和5-HT 含量高于模型组,提示乌灵胶囊可通过上调海马组织NE、DA 和5-HT 含量而调节神经递质水平。在今后的工作中,需进一步探讨单胺类神经递质与神经元损伤及卒中后抑郁行为改变的关系,深入阐明乌灵胶囊治疗卒中后抑郁的作用机制。
综上所述,乌灵胶囊可改善卒中后抑郁大鼠行为,且可调节海马P13K/Akt/mTOR 通路,调节神经递质水平。
