珠蛋白的氧化还原酶活性与肿瘤的关系*
2021-08-04马文倩杨心治
马文倩, 杨心治, 莫 靓, 游 咏△
(1南华大学衡阳医学院转化医学研究室/蛋白质结构与功能实验室,湖南衡阳421001;2南华大学附属第一医院胸外科,湖南衡阳421001)
珠蛋白是一类结构保守的血红素蛋白家族,大部分生命中均有表达[1]。它们具有紧凑的螺旋构象和附着血红素的能力,允许气态双原子分子可逆结合,包括氧(oxygen,O2)、一氧化氮(nitric oxide,NO)和一氧化碳(carbonic oxide,CO)等[1],在机体中主要承担氧的储存和运输功能。已知的珠蛋白主要有红细胞特异性血红蛋白(hemoglobin,Hb)、肌肉中的肌红蛋白(myoglobin,Mb)、神经元和神经内分泌组织中的脑红蛋白(neuroglobin,Ngb),以及各种器官中普遍存在的胞红蛋白(cytoglobin,Cygb)。4 种珠蛋白具有相似的结构,因此也具有相近的生物学活性,其中氧化还原酶活性是珠蛋白生物学活性研究中的重要内容。近期研究发现Cygb 的氧化还原酶活性在肿瘤的发展与治疗中具有重要作用,而Ngb 可通过其氧化还原酶活性清除自由基从而预防神经退行性疾病。Hb/Mb 可通过其氧化还原酶活性降低NO的合成,从而调节NO 对血管的扩张作用,降低肿瘤组织的血流量,限制肿瘤细胞的营养来源达到限制肿瘤细胞生长的作用[2]。然而,调控这些珠蛋白氧化还原功能的机制尚不清楚,珠蛋白的潜在功能仍有待进一步深入研究[3]。
活性氧簇(reactive oxygen species,ROS)是有氧代谢的产物,包括超氧阴离子(superoxide anion,过氧化氢(hydrogen peroxide,H2O2)和羟自由基(hydroxyl radical,·OH);活性氮簇(reactive nitrogen species,RNS)是 NO 与包括 ROS 在内的化合物相互作用衍生出的一系列具有高度氧化活性的自由基和硝基类化合物,包括超氧亚硝酸根离子(peroxynitrite ion,ONOO-)及其质子形式过氧亚硝酸(peroxynitrous acid,HOONO)[4],还有三氧化二氮(dinitrogen trioxide,N2O3)和二氧化氮(nitrogen dioxide,NO2)。ROS 和RNS 的水平确立了细胞内的氧化还原状态。ROS/RNS 在机体内可通过其含量的变化而调节、诱导肿瘤细胞增殖或凋亡相关信号分子表达,对肿瘤细胞的生长产生调节作用。研究发现珠蛋白可通过氧化还原酶活性调节 ROS/RNS 的浓度[3],在肿瘤细胞中,珠蛋白是否也可通过这一活性影响细胞的增殖与凋亡可能为肿瘤的防治提出新的思路。本文将从珠蛋白的结构及其由结构决定的氧化还原酶生物学活性继而清除ROS/RNS的功能和与肿瘤的关系进行探讨。
1 4种珠蛋白结构的异同
生理条件下,珠蛋白的多肽链会盘绕折叠成球形,将血红素分子包裹在球体内部,而辅基血红素是卟啉环与Fe2+的络合物。珠蛋白之间结构的差异主要表现在血红素中心铁的配位状态、血红素结合腔的微环境、血红素与蛋白肽链之间作用的方式等。(1)Hb 由2 个α 亚基和2 个 β 亚基组成,而每个亚基都是由1 条多肽链和4 个含Fe2+的血红素分子构成。血红素是4个吡咯分子生成一个卟啉环,再结合1个Fe2+组成的一个小分子。卟啉环中心是吡咯的4 个氮原子与 1 个 Fe2+配位结合。(2)Mb 的主链与 Hb 的α链和β链折叠形成的三维结构非常相似,是由一条盘曲的肽链和一个血红素辅基组成的具有三级结构的球状蛋白质单体结构,与氧分离的状态下包含5个配位键,易与氧气结合。(3)Ngb 是一种具有典型螺旋折叠的珠蛋白,它与Hb 和Mb 的区别在于血红素铁配位的几何构型不同:Ngb是一种六配位血红蛋白,没有外源配体的情况下,远端组氨酸直接与铁配位,使铁和脱氧亚铁血红素铁呈低自旋六轴[3]。(4)Cygb 的血红素结构在性质上与Ngb 相似,在没有外源配体的情况下也以六配位与铁连接。
氧结合蛋白Hb 和Mb 在没有外源配体的情况下是高自旋五配位的,远端组氨酸不能与铁形成离子键,而是形成氢键来稳定氧结合,如图1 所示。珠蛋白通过与铁结合或形成氢键发生电子的转移变化,从而具有氧化还原酶的活性。
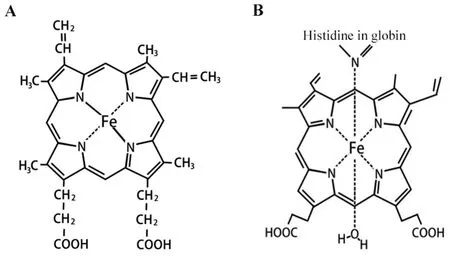
Figure 1.Heme structure diagram of Hb/Mb(A)and Ngb/Cygb(B).图1 Hb/Mb及Ngb/Cygb的血红素结构图
2 珠蛋白的结构决定清除ROS/RNS 的氧化还原酶活性
珠蛋白的活性中心血红素/铁,不仅有氧化酶活性,也有促进脂质过氧化的作用。病理情况下机体细胞内产生大量的ROS/RNS,羟自由基增多,珠蛋白释放出血红素和游离的铁离子,与H2O2发生反应。此反应是Fe2+或(和)Fe3+与H2O2反应生成超价血红素铁:
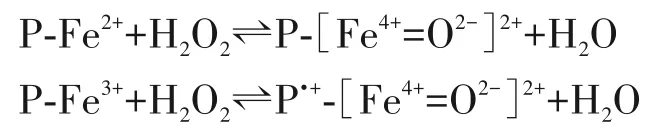
(其中P 表示蛋白质,P·+表示蛋白质阳离子自由基)
以上反应主要在病理条件下发生,当自由基迁移到整个蛋白质或非预期的底物上,铁基也可引发底物如脂质的氧化[3]。Fe4+可通过自身还原或氧化其他底物与Fe2+反应生成Fe3+。H2O2持续稳定地与P-Fe2+/P-Fe3+反应使珠蛋白失去携氧能力,与此同时Fe4+通过Fe2+发生Fe4+与Fe3+的氧化-还原反应循环。细胞内存在的氧化自由基防御系统可以很快将Fe3+还原成Fe2+。
血红素和蛋白质之间的共价键是由血红素在酸性条件下通过铁-铁氧化还原循环形成[8-10]。作为Mb/Hb 氧化还原循环的一种稳定而特异的产物,血红素和蛋白质之间的共价键有可能在体内发挥其先前氧化还原化学标志物的作用。发生横纹肌溶解(肌肉损伤)后,动物模型的肾脏和人类患者的尿液中,均可检测到血红素-蛋白质交联的Mb;蛛网膜下腔出血后,在脑脊液中也能检测到Hb 的这种共价修饰,这些都是珠蛋白参与氧化还原反应的直接证据[3]。
3 ROS/RNS在肿瘤中的作用及其机制
氧化应激是由于氧化剂过量或抗氧化能力不足造成的氧化与抗氧化作用的失衡,肿瘤细胞内的氧化应激主要由大量 ROS 积聚产生造成的[4]。ROS 可以通过调节细胞内的信号分子进而调控包括增殖、分化、凋亡和迁移等各种生理过程[11]。ROS 可促进肿瘤细胞的增殖:(1)抑癌蛋白PTEN 的催化活性受到ROS的调节,其磷酸酶活性会被氧化应激抑制[12]。磷脂酰三磷酸肌醇(phosphatidylinositol-3,4,5-trisphosphate,PIP3)是磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)通路的第二信使,细胞内ROS升高PTEN失活导致细胞内PIP3水平升高,PIP3聚集在质膜上,并激活下游的PIP3靶标,包括蛋白激酶 B(protein kinase B,PKB/AKT)[13]。此外,活化的PI3K/AKT 信号会导致与细胞生存相关基因的表达增加如抗凋亡因子Bcl-2[13-14]。抗氧化处理抑制了细胞内磷酸化的PTEN 失活和随之而来的AKT 激活。有研究表明,在Brca1缺陷型乳腺癌中,PTEN 的过量表达会抑制PI3K/AKT 的信号通路,降低肿瘤细胞对ROS 耐受的阈值,从而到达治疗的作用[17]。线粒体中PTEN 的增加可进一步促进细胞内ROS 的产生。实验证明PTEN的半胱氨酸残基会被H2O2氧化失活,而PI3K/AKT 信号通路会被失活的PTEN 激活,从而有利于肿瘤细胞的存活和生长[13,15-16]。(2)还有实验证明中低水平的ROS 可激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外信号 调 节 激 酶(extracellular signal-regulated kinase,ERK)的磷酸化,促进细胞周期蛋白cyclin D1 表达,从而诱导肿瘤细胞的表达[17]。氧化应激水平的增加导致蛋白质、脂质等大分子损伤,参与动脉粥样硬化、糖尿病和肿瘤等疾病的发生发展[18]。另一方面ROS抑制肿瘤细胞的增殖与存活:(1)ROS可通过激活细胞凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)/c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路从而诱导细胞的衰老和死亡。H2O2可氧化硫氧还蛋白1(thioredoxin 1,TRX1)半胱氨酸残基,导致与TRX1 结合的ASK1 的活化,活化的ASK1 又可以依次激活JNK 和p38 MAPK 途径,抑制抗凋亡因子,从而促使细胞凋亡[19]。有实验证明,在小鼠B 淋巴瘤细胞中,膜免疫球蛋白诱导H2O2的产生并激活ASK1/JNK途径,导致细胞凋亡[20]。(2)ROS 还可通过抑制核因子 E2 相关因子 2(nuclear factor E2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号从而影响核因子κB(nuclear factor-κB,NF-κB)信号通路传导,抑制肿瘤细胞的增殖发展[21]。已有研究表明,抑癌基因p53可促进ROS 的产生,并参与诱导细胞凋亡。PI3K/AKT/PTEN 通路是细胞衰老和凋亡的关键决定因素,细胞内ROS 的产生介导了PI3K/AKT/PTEN通路的发生[13]。
NO 及其衍生物RNS 对肿瘤细胞的作用也表现出双重作用。一方面NO 可促进肿瘤细胞增殖和迁移:(1)NO 可诱导AKT 的磷酸化,在小鼠纤维肉瘤模型中,NO 通过AKT在869位半胱氨酸的硫醇氧化还原机制抑制细胞凋亡信号调节激酶1 的活性,启动细胞凋亡保护。(2)在肿瘤细胞中缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)可通过增加遗传不稳定性,从而改变细胞代谢和下调促凋亡蛋白提高肿瘤细胞的耐药性。NO 浓度在100~400 nmol/L时,通过稳定HIF-1α 的结构,导致PI3K 活化从而促进癌细胞的存活和增殖[22]。(3)NO 浓度低于 400 nmol/L 可导致p53基因的突变,致使p53 失去对肿瘤细胞的抑制作用从而促进肿瘤细胞的增殖生长[23]。(4)NO 通过介导血管内皮生长因子(vascular endothelial growth factor,VEGF)而促进肿瘤血管生成,从而促进肿瘤细胞的迁移[24-25]。另一方面NO 可抑制肿瘤细胞的增殖和存活:(1)高浓度的NO 可以稳定p53基因,导致细胞周期停滞和细胞生长抑制,抑制肿瘤细胞的增殖[25]。(2)NO 的浓度接近或超过 1 μmol/L 时,可通过蛋白质亚硝化、硝化和烷基化导致细胞凋亡[25]。N2O3是一种强亚硝化剂,可以使DNA碱基脱氨基,导致DNA 突变。N2O3也可通过烷基化与仲胺反应形成致癌的N-亚硝胺,破坏DNA。强氧化剂 ONOO-可引发脂质过氧化和裂解 DNA[25]。(3)NO 可以通过活化巨噬细胞杀伤肿瘤细胞[26]。见图2。

Figure 2.The mechanism of ROS/NO in tumor cells.图2 ROS/NO在肿瘤细胞中的作用机制
不同水平的ROS/RNS 对肿瘤细胞表现出不同的影响,ROS/RNS 在肿瘤细胞中的作用机制也尚待完善,当前在高水平ROS/RNS 对肿瘤细胞的作用及由此产生的与氧化应激相关的癌症治疗方面需要更多的研究,以便于更好地理解氧化应激相关的癌症机制,并对于提高选择性杀伤肿瘤细胞有极大的帮助。
4 珠蛋白在细胞中的表达
不同的应激条件如缺氧、氧化应激、葡萄糖剥夺以及脂多糖都会增加珠蛋白的表达,这表明珠蛋白作为应激反应传感器可以将应激状态转移到信号转导途径[27]。这些发现表明珠蛋白有两种不同但是相互关联的功能:当细胞内ROS 浓度过高时珠蛋白对细胞有保护作用,同时珠蛋白还会参与对内外氧化应激的激活反应。此外,珠蛋白的表达受到内源性因素的促进,包括激素和生长因子。在不同的激素(如血管内皮生长因子和促红细胞生成素)中[28],17-雌二醇(17β-estradiol,E2)通过雌激素受体 Erβ 和ERβ 诱导高水平的珠蛋白表达,主要参与E2激活的细胞的抗凋亡途径。其中,Ngb在线粒体中的定位要求很高,因为它具有对抗氧化应激的抗凋亡功能。在H2O2诱导的应激条件下,只有E2 诱导的线粒体重新分配的Ngb 与细胞色素C(cytochrome C,Cyt-C)的胞浆释放相互作用并损害Cyt-C 的释放,从而阻止随后的凋亡途径的激活。多种协同的细胞机制支持E2诱导的珠蛋白表达。生理浓度的E2在ERα存在的情况下,迅速激活PI3K/AKT 途径,进而阻止蛋白酶体和溶酶体珠蛋白的降解,并通过核转录因子CREBP的磷酸化增强珠蛋白基因的转录[29-30]。Ngb 上调是E2/ERα 复合物通过在线粒体水平阻止凋亡级联反应来保护乳腺癌细胞免受氧化应激的关键机制之一[29-30]。在肝癌细胞HepG2 中也报道了类似的E2诱导的抗凋亡功能[29]。Fiocchetti 等[31]的实验证明了氧化应激主要通过像E2类似的诱导蛋白抑制溶酶体蛋白降解和提高蛋白转化率来增加Ngb 水平。在乳腺癌细胞中,氧化应激瞬时激活了PI3K/AKT 信号级联反应,最终导致Ngb 上调,并将其主要定位在细胞质,在那里它可以作为直接的ROS清除剂,是ROS水平增加的第一屏障[30]。综上所述珠蛋白可以直接影响肿瘤细胞的凋亡控制肿瘤的进程,或者通过其氧化还原酶活性清除或抑制ROS/RNS的表达间接影响肿瘤细胞。以上发现给珠蛋白在肿瘤防治方面发挥作用提供了理论基础,目前还需要大量的实验数据证明这一理论的可实施性,为珠蛋白应用到临床中防控肿瘤奠定基础。
5 珠蛋白对肿瘤的预防和治疗
Hb 是运输和储存O2的主要载体,其他三类蛋白质也作为氧气的载体,在应激状态下释放氧气,补充细胞所需要的氧气。生理条件下携氧珠蛋白浓度直接影响人体血氧含量,以及在肿瘤细胞中的供氧。除此之外,Meyer 等[2]的研究发现 Hb 通过调节 NO 的浓度,减轻NO 对血管的扩张,降低乳腺癌中肿瘤组织的血流量,从而限制肿瘤细胞生长所需的营养来源。曲俊杰等[32]的研究表明Hb 被包裹在脂质体中,将O2输送到肿瘤,促进了肿瘤部位微环境中缺氧的逆转。HIF-1α和血管内皮生长因子的高表达可促进肿瘤的增殖和血管生成[33-34],下调它们的表达从而抑制肿瘤的生长。
Mb 可通过清除或产生NO 分子来维持肌肉中NO 动态平衡[35],参与调节血管舒张反应,保护呼吸链不受抑制[36]。Mb 的功能还包括合成过氧化物[37]、清除反应性 O2物种[38]和脂肪酸结合[39]。Mb 在各种肿瘤中都有表达,包括髓母细胞瘤[40]、胸腺脂肪瘤[41]、急性白血病[42]和促结缔组织增生性小圆细胞肿瘤[43]以及肺部肿瘤等[44]。Kristiansen 等[45]的实验发现Mb 在部分乳腺癌病例中大量表达。Mb 的表达与雌激素受体(estrogen receptor,ER)的存在有很强的相关性,这解释了与缺乏Mb 的肿瘤相比,Mb 阳性的肿瘤通常预后更好[45]。有研究发现Mb 前列腺癌中的表达校高,它受到缺氧的调节,与在乳腺癌中表达一样,表现出显著的转录复杂性[46-47]。有研究表明在上皮性肿瘤中脱氧Mb 可提高细胞NO 水平,促进p53 磷酸化。还会导致ROS 水平增加,通过ROS 影响p53 的稳定进而影响肿瘤细胞的状态[48]。以上研究表明如果可以控制Mb的表达,那么就可以通过调节Mb从而调节肿瘤细胞的状态。
Ngb 可通过改变ROS/RNS 的三维结构,影响蛋白质与包括氧在内的内源气态配体的亲和力来感知细胞内的氧化还原状态或信号级联的激活/失活状态,并合理地调节Ngb 与蛋白质的相互作用和细胞内的定位的功能特性[49]。在神经细胞衍生的细胞中,渡边等研究证明了氧化应激使Ngb 可与质膜上的Flotillin1相互作用,有利于其抑制Gαi蛋白和随后的氧化应激诱导的细胞凋亡,从而作为氧化应激感受器能够影响细胞的反应[27]。在恶性肿瘤细胞中也发现了类似的氧化应激敏感活性,例如上文提到的实验在肝癌细胞中,研究发现Ngb 作为O2/ROS 感受器,在肝细胞癌(hepatocellular carcinoma,HCC)中发挥肿瘤抑制作用。Ngb 通过将O2/ROS 信号与致癌的Raf/MAPK/ERK 信号联系起来起到控制HCC 发展的作用[17]。还有Oleksiewicz 等[50]的研究表明在原发性肺癌标本中,NgbmRNA 的上调与HIF-1α 表达的增加呈现正相关。并且有报道指出Ngb 过表达在肺癌的细胞中起到肿瘤抑制的作用,其中Ngb 充当O2/ROS 信号与细胞增殖之间的信号联系[26,50]。由于Ngb 在神经和非神经性癌症中都是E2 诱导蛋白,所以根据受体ERα 和ERβ 的平衡状态E2 在癌症中发挥的作用也是双向的[51]。这些数据表明脑红蛋白可能成为癌症治疗的新靶点。
Cygb 在低氧条件下表达增多,表明Cygb 潜在的氧结合/传感、清除 ROS/RNS 的还原酶功能[3]。启动子甲基化下调Cygb 在口腔癌(100 例)、头颈部鳞状细胞癌(101 例)和非小细胞肺癌(127 例)中的表达,观察到Cygb作为肿瘤抑制基因发挥作用[52]。Cygb缺陷小鼠已被发现会促进癌症的发生,当暴露于致癌物质如二乙基亚硝胺时,还会促进肺和肝脏的癌变[53]。Xu等[9]通过对临床上的胶质瘤患者研究证明Cygb 可以作为预后的独立预测因子,它的缺失可能导致胶质瘤的肿瘤复发和较差的预后。在鳞状细胞癌中,Cygb 的 mRNA 表达与 HIF-1α 相关,表明 Cygb的mRNA 表达受缺氧的调节,而Cygb 的mRNA 表达增加了肿瘤的侵袭性[54]。Cygb基因对角质形成细胞的增殖也有保护作用,在常氧条件下,防止外源性过氧化氢氧化损伤细胞[55]。这类研究表明,p63转录因子蛋白ΔNp63靶向调节Cygb基因,导致Cygb 表达上调,从而抑制氧化应激诱导的角质形成细胞的凋亡。这种机制也存在于肺和乳腺癌细胞系,说明Cygb 介导的清除反应性氧在上皮性肿瘤和肺癌中也有作用。此外,在人类肺癌数据集中,CygbNp63 和ΔNp63 基因的相互作用显著降低了患者的存活率[55]。因此在 Cygb 与防癌研究中可以看出,Cygb 可以抑制肿瘤的进程[56-57]。上述机制的总结见表1。

表1 珠蛋白与肿瘤的相关机制及参考文献Table 1.The mechanism and references of globin and tumor
2012 年在人类身上又发现了第5 种珠蛋白——雄球蛋白(androglobin,Adgb),这进一步扩大了人们对珠蛋白生物学活性和功能的兴趣。Adgb 具有1667个氨基酸序列,包括钙蛋白酶样域、血红蛋白结构域和 IQ 钙调蛋白结合基序[58]。Adgb作为癌基因促进细胞增殖作用的发现在癌症研究中具有重要意义[59],然而,人们对这种多结构域蛋白知之甚少,还需要大量的研究去探索发现它的潜在作用。
6 总结与展望
ROS 和抗氧化剂激活系统之间的平衡建立了细胞内氧化还原的水平,而这种平衡的精细调节是细胞正常功能和生存必需的[60]。在细胞水平上,清除ROS 在很大程度上依赖于酶的激活,如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、谷胱甘肽还蛋白和硫氧还蛋白,这些酶总体上构成了细胞的抗氧化防御机制[60]。当细胞内的抗氧化能力不足以清除ROS 时,细胞保护机制被激活,珠蛋白清除部分ROS/RNS 从而削弱由于氧化损伤造成的细胞死亡。
珠蛋白的各种功能,包括氧气传感、运输和储存;以及基于血红素的氧化还原酶活性的ROS/RNS的合成和清除;及其在肿瘤发生发展过程中的作用表明珠蛋白很可能成为肿瘤治疗的新靶点。胞内珠蛋白直接参与肿瘤细胞建立的抗氧化系统,对抗ROS 的增加,细胞内不同的珠蛋白可能通过不同的机制协同作用,以提高肿瘤细胞的存活率,促进细胞对应激肿瘤微环境的适应。在这一点上,任何能够改变珠蛋白水平、细胞内定位和反应性的刺激都可能增加肿瘤细胞对氧化应激诱导的细胞死亡的易感性。未来破译这些珠蛋白的生物学活性、在疾病中的作用机制将有望在许多疾病的防治上发挥重要作用。
