塞舌尔角毛藻的形态学再描述和分子系统学分析
2021-08-04牛彪彪翟梦怡李扬
牛彪彪, 翟梦怡, 李扬
华南师范大学生命科学学院, 广东省水产健康安全养殖重点实验室, 广东 广州 510631
角毛藻属(ChaetocerosEhrenberg)是海洋浮游硅藻中物种多样性最为丰富的大属之一, 广泛分布于全球海域(Tomas et al, 1997)。依据角毛中是否含有色素体可划分为两个亚属: 有色角毛藻亚属Phaeoceros和无色角毛藻亚属Hyalochaete(Hernández-Becerril,1996)。角毛藻是海洋浮游植物的优势类群(Tomas et al, 1997; Shevchenko et al, 2006), 也是重要的藻华生物(Tomas et al, 1997)。
塞舌尔角毛藻(C. seychellarusG.Karsten)隶属于有色角毛藻亚属, 是全球罕见种, 最初报道于印度洋(Karsten, 1907), 此后多年未见报道, 而近二三十年来在北美加利福尼亚沿岸、墨西哥湾以及印度洋开始有零星报道(Hernández-Becerril, 1993; Hernández-Becerril et al, 1998)。韩国近年亦曾有报道, 该报道中研究者利用光镜在自然样品中观察到了少数群体,所提供的有效形态特征相对有限(Lee, 2011)。以往对于塞舌尔角毛藻的认知多限于普通光学显微镜观察, 因而对其形态学了解得不够全面, 导致在分类学上出现争议, 如塞舌尔角毛藻与金色角毛藻是否为同种异名(Taylor, 1966)的问题。对于塞舌尔角毛藻在系统学划分上也存在一些疑问, 有学者将塞舌尔角毛藻归入北方组SectionBorealia(Taylor, 1966),也有学者将其单独成组, 并命名为塞舌尔组SectionSeychellari(Hernández-Becerrilet al, 2001)。
为全面界定塞舌尔角毛藻的物种信息, 本文从台湾海峡和海南岛三亚海域分离并建立了单克隆培养株系, 利用光镜和扫描电镜(scanning electron microscopy, SEM)进行了较为详尽的形态学观察,首次扩增了该种的核糖体大亚基D1~D3区序列, 构建并分析了其分子系统树。相关研究成果丰富了我国海洋硅藻的分类学资料, 也为硅藻系统学研究提供了基础数据。
1 材料与方法
1.1 样品的采集
通过搭载国家自然科学基金委2016年度台湾海峡春季共享航次, 采集了浮游植物活体样品, 此外在海南岛三亚海域也开展了相关样品的采集。采样时, 使用浮游植物网(孔径10µm)进行水平拖网,并同步记录水温、盐度等水文参数, 回到实验室后进行目标藻株的分离、纯化和扩大培养。
1.2 单克隆培养株系的建立
利用毛细玻璃管分离法在生物倒置显微镜(Mshot MI-12)下挑取目标藻细胞, 经多次复洗后快速转移至滴有L1培养液的48孔培养板内, 待其存活并繁殖达到100个细胞, 再转移到250ml三角瓶中进行扩大培养。藻株保存于光照培养室内, 培养条件是恒温22±2℃、光暗周期比12∶12, 光照强度约50~80µmol·m-2·s-1。建立的塞舌尔角毛藻培养株系共5个, 详细信息见表1。

表1 塞舌尔角毛藻培养藻株信息Tab. 1 Information of monoclonal strains used in this study
1.3 休眠孢子的诱导
在上述培养条件下, 分别吸取5mL处于对数生长期的藻液, 转移到100mL三角瓶中, 以L1培养液(缺氮)诱导休眠孢子(Kooistra et al, 2010)。每个藻株均诱导 3 次以上, 每次诱导时间持续两周, 期间观察休眠孢子的产生。
1.4 形态学特征的观察
光镜观察: 取5µL处于对数生长期的藻液, 置于载玻片上, 压片后在显微镜(Olympus BX53)下进行微分干涉(differential interference contrast, DIC)观察, 并使用Olympus DP27数码相机记录其形态特征。
扫描电镜观察: 取3mL处于对数生长期的藻液,加入等体积浓硫酸(>95%), 酸化10min, 以去除有机质, 用灭菌双蒸水(ddH2O)多次洗涤至中性。将藻细胞过滤到滤膜上, 放置在避光干燥处待其晾干后,利用碳导电胶贴于SEM样品台, 喷金后置于扫描电镜(Zeiss Ultra 55)下观察和记录其形态特征。
1.5 分子系统学研究
利用离心法收集藻细胞, 提取总DNA, 扩增核糖体大亚基基因D1~D3区(Lundholm et al, 2002; Xu et al, 2020)。LSU rDNA引物为D1R-F(5’-ACC CGC TGA ATT TAA GCA TA-3’)和D3B-R (5’-TCG GAG GGA ACC AGC TAC TA-3’)。采用50µL的PCR反应体系: 25µL的PCR Mix, 正、反向引物各1µL,21µL灭菌ddH2O和 2µL目标藻株总DNA。扩增条件为: 首先94℃预变性5min; 然后进行如下36个循环: 94℃变性30s, 56℃复性30s, 72℃延伸45s; 之后72℃再延伸7min。PCR产物于4℃保存, 并送往华大基因公司(The Beijing Genomics Institute, BGI)进行测序。从美国国家生物信息中心(National Center for Biotechnology Information, NCBI; https://www.ncbi.nlm.nih.gov/)下载角毛藻物种的 LSU nrDNA序列, 运用BioEdit软件进行比对和矩阵分析(Nylander, 2004)。基于MrModeltest 2.3选择最适模型, 分别用RAxML-HPC2(Miller et al, 2010)和MrBayes 3.2(Ronquist et al, 2012)构建最大似然树(Maximum Likelihood, ML)和贝叶斯推理树(Bayesian Inference, BI)。选用冕孢角毛藻C.diadema(EF42 3433)作为群外对照。
2 结果
2.1 塞舌尔角毛藻的形态学描述Chaetoceros seychellarusG.Kasten
Kasten, 1907: 987, Fig.4a~e; Hustedt, 1920: Pl.327, Fig.12~13; Hendey, 1937: 296; Simonsen, 1974:32; Hernández-Becerril, 1993: 121, Fig.16~27;Hernández-Becerril et al, 2001: 400, Fig.1~15.
根据镜下显示(图1), 塞舌尔角毛藻细胞链直、粗壮, 常形成6~23个细胞不等的长链(图1a), 也有单细胞(图1c)。细胞和角毛内散布有数量众多的颗粒状色素体(图1a、1c—f)。细胞宽环面观为矩形, 壳面长轴短于贯壳轴, 壳面长轴介于12.85~14.73µm(中位值±标准差: 13.15±0.60µm), 贯壳轴高 20.51~45.51µm (中位值±标准差:28.55±6.27µm)。窗孔呈矩形(图 1e、1f), 高2.56~4.61µm(中位值±标准差: 3.22±0.73µm)。壳套较高, 高度大于贯壳轴的三分之一, 与环带相接处有明显凹沟(图1d—f、1i、1j)。角毛粗壮, 壳面观时角毛长度较为一致, 向四周呈辐射状(图1b)。壳面和壳套上布满细小孔纹(图1g—i), 壳面孔纹散布, 角毛基部孔纹明显密集(图1h)。壳面呈圆形或近圆形(图1h)。

图1 塞舌尔角毛藻(株系编号: MC2054)a. 群体环面观; b. 群体壳面观; c. 单细胞; d. 上壳面; e. 下壳面; f. 链中细胞(箭头指示壳套与环带连接处); g. 链中相邻壳面(箭头指示唇形突); h. 内壳面观; i. 上壳面; j. 下壳面; k、l. 角毛; m. 角毛截面Fig.1 Chaetoceros seychellarus (MC2054). a: Chain in girdle view; b: chain in valve view; c: solitary cell; d: terminal anterior valve; e:terminal posterior valve; f: intercalary cells and arrows showing connection between mantle and bands; g: sibling valves and arrows showing two rimoportulae; h: valve; i: terminal anterior valve; j: terminal posterior valve; k-l: setae structure; and m: setae section
链中角毛相交于基部, 融合后向外延伸, 末端向链端弯曲(图1a、1e、1f)。链状群体的两个链端壳面形态不同(图1a、1d、1e), 上壳面角毛先向壳面中心延伸, 彼此相交之后再分离(图1a、1d、1i), 下壳面角毛不相交, 从壳面伸出即向两侧延伸(图1a、1e、1j)。单细胞两个壳面亦为异形(图1c)。角毛呈四棱形(图1m), 每条棱上分布有箭头状的刺, 大小介于0.70~3.00µm(中位值±标准差: 1.74±0.59µm),密 度 为 0.121~0.166 个·µm-1(中 位 值±标 准 差:0.150±0.118个·µm-1)。角毛上有两种孔纹, 一种是沿着角毛径向排列的大孔, 密度为0.574~0.890个·µm-1(中位值±标准差: 0.739±0.092个·µm-1); 另外一种是横向排列的小孔, 密度为6.3~9.3个·µm-1(中位值±标准差: 7.6±1.2个·µm-1) (图1k、1l)。
每个壳面均有两个唇形突, 在壳面短轴两侧呈对称分布(图1g、1h)。其在外壳面具有短的外管, 末端呈嘴唇状结构(图1g、1i); 而在内壳面上则为裂缝状, 呈“工”字形(图1h)。
未见休眠孢子。
2.2 塞舌尔角毛藻的生态分布
本文藻株采自我国台湾海峡(117°48'36"E,22°42'38"N; 120°20'24"E, 25°33'00"N)与三亚海域(111°54'00"E, 19°45'94"N)。根据已有的研究报道,塞舌尔角毛藻分布于印度洋(Karsten, 1907)、北美加利福尼亚沿岸、墨西哥湾(Hernández-Becerril, 1993;Hernández-Becerril et al, 1998)和韩国沿海(Lee, 2011)等。塞舌尔角毛藻为罕见的暖水种(Hernández-Becerril et al, 2001), 因此主要分布在热带和亚热带海域。
2.3 基于LSU nrDNA部分序列构建的分子系统树分析
使用NCBI的blast (https://blast.ncbi.nlm.nih.gov/Blast.cgi)功能, 检索塞舌尔角毛藻邻近物种的LSUnr DNA D1~D3区序列, 得到31条邻近物种和外类群序列, 另外本文研究获得1条塞舌尔角毛藻藻株序列, 因此共有32条序列用于最终的分子系统学分析。基于核糖体大亚基DNA(LSU nrDNA)部分序列构建的ML和BI系统进化树显示, 两者具有相似的拓扑结构, 其中ML树拓扑结构在本文中展示(图2)。
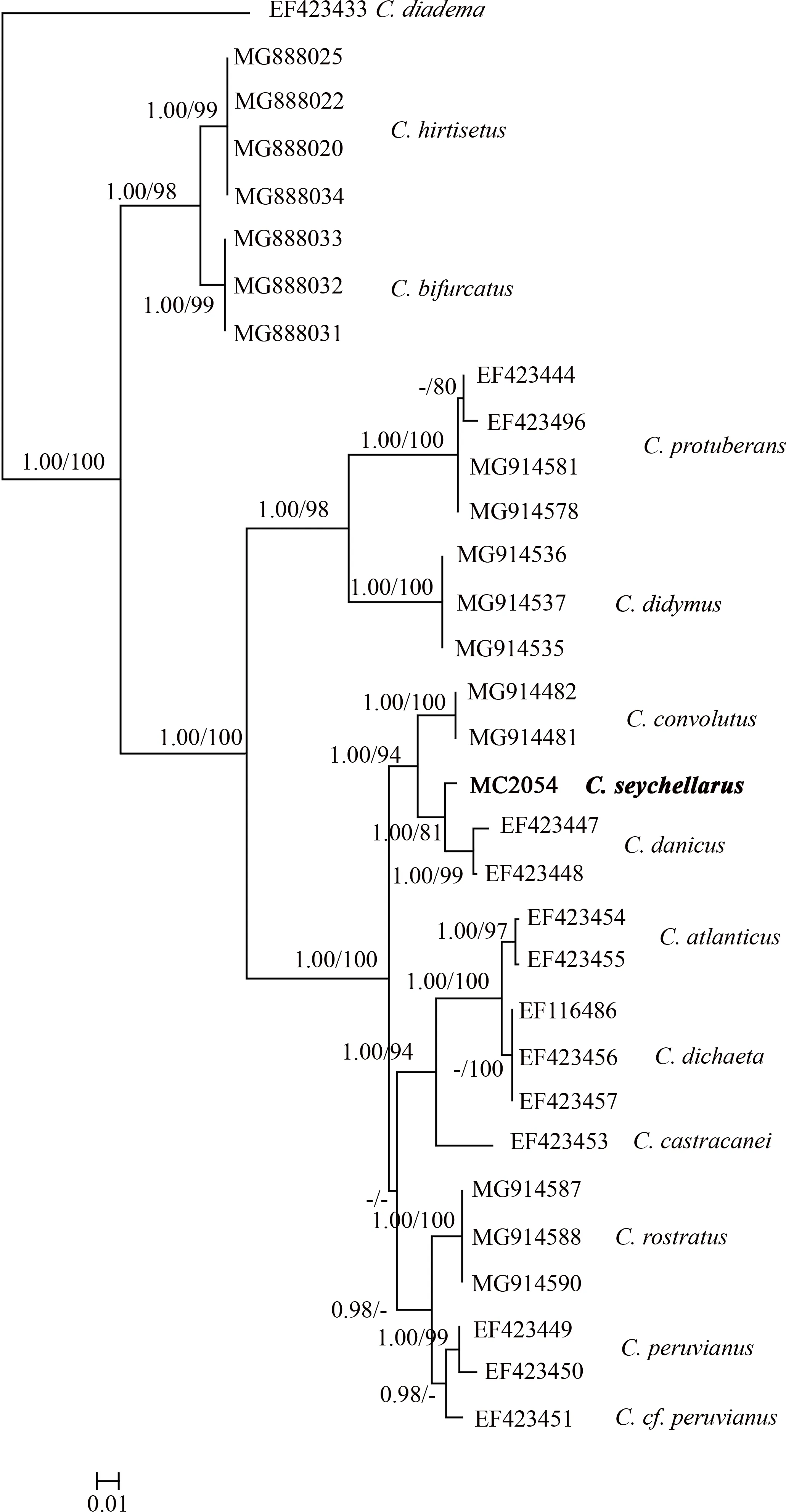
图2 基于核糖体大亚基部分序列构建的系统发育树斜杠左侧值为BI, 右侧值为ML, -表示BI值<0.9或者ML值<80 Fig.2 Phylogenetic analysis inferred from LSU partial sequences
该分子系统树与De luca等(2019)的报道一致,有色角毛藻亚属的物种聚集在一个大的分支上, 反映出较好的单系起源(BI/ML=1.00/100)。塞舌尔角毛藻首先与丹麦角毛藻(C. danicus)聚在一起(BI/ML=1.00/81), 之后与扭曲角毛藻(C. convolutus)聚在一个分支(BI/ML=1.00/94)上, 说明它们之间具有较近的遗传关系。
3 讨论
3.1 塞舌尔角毛藻的形态学研究
塞舌尔角毛藻的典型特征是链端壳面异形, 即上壳面与下壳面的特征不一致, 单细胞的上、下壳面亦为异形(图1c), 这一特征也见于秘鲁角毛藻(C.peruvianus)和均等角毛藻(C. aequatoralis) (Hernández-Becerril, 1993; Tomas et al, 1997; Hernández-Becerril et al, 2001)。此外, 本研究还观察到另一新的形态学特征——链中角毛的走势。当从壳面观察漂浮状态群体时, 角毛并非整齐地排列在两侧, 而是以细胞为中心向四周呈放射状(图1b)。角毛走势也是角毛藻物种鉴定的重要依据(Tomas et al, 1997; Hernández-Becerril et al, 2001), 角毛走势作为物种鉴定依据在聚生角毛藻复合群(C. socialiscomplex)(Chamnansinp et al, 2013)和柔弱角毛藻复合群(C. debiliscomplex)(Xu et al, 2020)中已有成功应用, 因此本文建议将链中角毛的走势纳入到塞舌尔角毛藻的识别特征中。
本文构建的分子系统树显示(图2), 塞舌尔角毛藻与丹麦角毛藻具有最近的亲缘关系, 它们也具有较多相似的形态特征, 如壳套较高、窗孔狭窄、壳套上有硅质增厚带等(Hernández-Becerril, 1993)。两者之间的形态学差异主要在于: 1) 塞舌尔角毛藻可形成长链状群体, 也可单细胞生活(图1c), 而丹麦角毛藻则常为单细胞生活, 偶见2~3个细胞的短链群体; 2) 塞舌尔角毛藻的链端壳面异形(图1a、1d、1e、1i、1j), 丹麦角毛藻的链端壳面同形; 3) 塞舌尔角毛藻的每个壳面均具有两个唇形突, 而丹麦角毛藻仅具有一个(Hernández-Becerril, 1996)。此外, 塞舌尔角毛藻的相似物种还有北方角毛藻和密连角毛藻, 上述形态学差异也同样适用于塞舌尔角毛藻与后两者之间的区别。
金色角毛藻(C. aurivillius)与塞舌尔角毛藻的形态特征基本一致, 尤其是链端壳面异形。学者们根据优先原则认为塞舌尔角毛藻是金色角毛藻的同种异名(Taylor et al, 1966; 郭玉洁 等, 2003), 同时两者也具有细微的差异, 如塞舌尔角毛藻壳套和环带相接处有凹沟(图1d—f、1i、1j), 而金色角毛藻却没有。但是, 以往关于上述两个物种的研究多以光镜为观察手段, 尤其是金色角毛藻, 其在电镜下的超微形态特征至今未见报道, 有关其分子系统学的研究更是空白。因此有学者持保留观点, 认为在获得详尽的形态特征之前, 仍将它们作为独立的物种(Manguin, 1957; Hernández-Becerril et al, 2001)。本研究并未建立金色角毛藻培养株系, 故未获得其形态学和分子生物学数据, 建议暂时仍将金色角毛藻与塞舌尔角毛藻作为两个独立物种, 待后续研究获取充分的物种信息后再进行分析。
3.2 塞舌尔角毛藻的系统学研究
根据形态特征, 有色角毛藻亚属被划分为7个组(section), 其中塞舌尔角毛藻被划分到北方组SectionBorealia, 该组的典型特征是: 1) 细胞和角毛中含色素体; 2) 直链状或单细胞生活; 3) 宽环面呈矩形; 4) 壳面呈椭圆形或圆形; 5) 角毛具刺和孔纹; 6) 窗孔狭窄; 7) 唇形突无明显外管(Hernández-Becerril, 1996)。塞舌尔角毛藻也表现出上述典型特征。本文的分子系统学研究中, 引用了3个北方组物种: 塞舌尔角毛藻、丹麦角毛藻和卡氏角毛藻(C.castracanei), 分子系统树显示它们不在一个分支上。虽然塞舌尔角毛藻与丹麦角毛藻聚在一个分支上, 但是卡氏角毛藻(EF423453)却位于另一个分支,两分支之间被其他有色角毛藻亚属的物种分割, 如大西洋角毛藻(C. atlanticus)和双刺角毛藻(C.dichaeta)。根据系统树显示, 北方组并非单系起源,目前该组的划分可能仍存在问题, 后续需要引入更多的分子数据来加以完善和修订。
鉴于塞舌尔角毛藻的每个壳面均具有两个唇形突, 显著区别于北方组的其他物种, Hernández-Becerril等(2001)建议将塞舌尔角毛藻单独划分为塞舌尔组(SectionSeychellari)。该组的典型特征为:1) 适中或较长的链状群体; 2) 链状群体两端细胞不同; 3) 窗孔为窄矩形状; 4) 群体中每个壳面具有两个唇形突, 对称地位于壳面短轴末端, 相邻壳面的唇形突位于相同位置(Hernández-Becerril et al, 2001)。根据本文构建的系统树显示, 塞舌尔角毛藻与丹麦角毛藻相邻, 表明两者之间有较近的亲缘关系。但是, 丹麦角毛藻并不具有上述特征,以往报道的北方组物种亦不具有上述特征, 因此本文认为上述特征可能是塞舌尔角毛藻独有的特征, 并非其隶属小类群的共有特征, 因而不足以成为系统划分的形态学依据, 更为复杂的复合特征或许能够解答它们之间的系统学关系。至于塞舌尔角毛藻是否应该独立成组, 目前尚不能给出结论, 后续还需要有色角毛藻亚属物种更多分子数据的引入。
