Gd-EOB-DTPA增强MRI对直径≤1 cm HBV相关小肝癌发生肝内转移风险的预测价值
2021-08-04李雪芹潘子昂王杏赵大伟林栋栋杨光刘晖任美吉夏振营李宏军李德春
李雪芹,潘子昂,王杏,赵大伟,林栋栋,杨光,刘晖,任美吉,夏振营,李宏军,李德春
肝细胞性肝癌(hepat ocel l ul ar car cinoma,HCC)是常见的肝脏原发性恶性肿瘤,在全球癌症致死原因中位列第三[1]。HCC早期精确诊断是完善治疗方案及提高患者生存质量、延长患者生存期的关键。由于肿瘤的双重血供,治疗后患者常出现转移,影像学检查是判断肿瘤转移的重要方法。随着研究技术的发展,钆塞酸二钠(gadoliniumethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)作为新型肝细胞特异性对比剂被广泛应用于肝脏的研究,提升了小HCC的检出率与确诊率。Hope等[2]研究发现,Gd-EOB-DTPA增强MRI能够提高肝脏病变的定性诊断能力及检出率。许多研究均证实Gd-EOB-DTPA增强MRI对小肝癌的检出率与诊断准确率比常规增强MRI高[3],但无论通过何种方法确诊的HCC均有转移的风险,因此早期识别HCC肝内转移的危险因素有助于改善患者预后,提高患者生存率,而目前很少有研究关注发生肝内转移的小肝癌的早期影像表现。本文旨在总结有肝内转移风险的小HCC在Gd-EOB-DTPA增强MRI图像上的影像学特征,探究其影像特征对乙型病毒性肝炎(vir al hepat it is t ype B,HBV)相关的直径≤1 cm HCC发生肝内转移的预测价值。
1 材料与方法
1.1 一般资料
本研究经过首都医科大学附属北京佑安医院医学伦理委员会批准(批准文号:ky2018-086),免除受试者知情同意。回顾性分析了2016年9月至2019年3月在北京佑安医院经病理确诊的45例术前无肝内转移且无门静脉主干或一级分支瘤栓、切缘充分的单发直径≤1 cm HBV相关小HCC患者的临床、影像数据。纳入标准:(1)年龄>18岁。(2)手术前未行介入治疗。(3)具备术前Gd-EOB-DTPA增强MRI影像资料。(4)肝脏其他部位影像学未发现肝硬化结节。(5)病理诊断明确的HCC。排除:(1)Gd-EOB-DTPA增强MRI检查间隔大于1个月。(2)未能定期接受规律随访。最终45例[中位年龄55(IQR 32~82)岁,32例男性(71.1%)]患者被纳入本研究。所有患者在术前均行一次Gd-EOB-DTPA增强MRI检查,所有患者在诊断明确后均已行肝细胞癌切除治疗,转移组治疗后通过中位时间13个月(IQR 7~18,r ange 2~36)的随访。随访方法:所有接受肝切除术的HCC患者均在术后每2~3个月复查腹部CT或MRI,术后转移时间均以影像学检查发现明确肿块存在为检出依据。诊断标准:将距离原发灶超过0.2 cm且直径小于0.2 cm的转移灶定义为微转移[4]。检出病灶后均进一步行肝动脉碘油造影检查,有明显肿瘤染色及碘油浓聚是肿瘤存在的确诊依据。如影像学证据不足,则进一步行穿刺或手术进行病理检查。病理诊断标准:肝内转移是指复发肿瘤与原发肿瘤相比,同属中或低分化,或比原发瘤分化程度更低[5]。最终15例患者发生了HCC肝内转移。30例未转移患者通过中位时间6个月(IQR 2~15,r ange 1~36)的随访。据此将患者分为转移组(n=15)和未转移组(n=30),比较两组间的人口学特征,HCC分化程度、病理分级以及Gd-EOB-DTPA增强MRI不同时期与序列上的影像特点。
图像技术采用机型为西门子Trio Tim3.0 T超导型扫描机,对比剂为Gd-EOB-DTPA(德国拜耳先灵公司,10 mL/瓶,0.2 5 mol/L)。Gd-EOB-DTPA增强MRI扫描:患者取仰卧位,头先进,扫描范围为膈顶至肝下缘,行常规横断面T1WI、T2WI、化学位移成像(正反相位T1WI)和扩散加权成像(dif fusion-weighted imaging,DWI)(b=0、50、600 s/mm2)。TR 3.3 6 ms,TE 1.6 2 ms,矩阵240×240,FOV 350 mm×284 mm,层厚5 mm。增强扫描采用高压注射器肘前静脉注入对比剂,Gd-EOB-DTPA以2.0 mL/s的流率注射对比剂(Gd-EOB-DTPA,0.0 25 mmol/kg),注射对比剂后以20 mL生理盐水冲管。后行动态增强多期扫描:注射对比剂后进行扫描:动脉期27 s、动脉晚期37 s、门静脉期50 s、过渡期2 min,于注射对比剂后20 min采用相同序列和方位行肝胆期扫描。过渡期结束后在等待肝胆特异期间隙行T2WI和DWI扫描。T2WI采用轴面呼吸门控增强快速自旋回波脂肪抑制序列,DWI采用自由呼吸自旋回波-平面回波扩散加权成像序列。增强扫描采用轴面三维T1高分辨率各向同性容积激发序列。
1.2 图像分析
所有图像均传输至图像存储与传输系统,由两位具有10年以上经验的腹部影像医师在不知晓临床随访结果的情况下独立分析,观点不一致时通过协商或者咨询一位具有30年阅片经验的腹部影像医师最终判定结果。首诊时肝内为单发病灶,其他部位影像学未发现肝硬化结节,随访时以肝脏其他部位出现病灶视为肝内转移。所有入组患者均未见弥漫性肝硬化。Gd-EOB-DTPA MRI图像中分析了T1WI、T2WI、DWI序列上HCC病灶的信号,信号高等低以同序列周围正常肝实质为参照,分析了动脉期是否强化及强化形式,门脉期和过渡期是否廓清。肝胆特异期HCC病灶的信号特点,肝胆特异期低信号病灶中局部出现稍高信号视为高低混杂信号。
1.3 统计学方法
连续变量先通过Kol mogor ov-Smir nov法检验正态性,如果符合正态分布则用t检验比较组间差异并用均数(标准差)表示,如果不符合正态分布则用Mann-Whit neyU非参数检验比较组间差异并用中位数(四分位数)表示。分类变量采用卡方或Fisher精确检验进行分析。通过Kapl an-Meier单因素分析决定HCC肝内转移预测因素,单因素分析P<0.1 的因素进行多因素Cox回归分析并校正性别、年龄、病理分级以发现HCC肝内转移的独立危险因素。Cox回归中分类变量的比例风险假定(pr opor t ional hazards assumpt ion)通过累计风险函数图示判定。所有统计学分析通过SPSS 25.0 实现,统计图通过Gr aphPad Pr ism 7(Gr aphPad Sof t war e;San Diego,CA,USA)绘制。
2 结果
2.1 组间比较
转移组和未转移组在年龄、性别等基线特征上无显著差别,HCC分化程度和Edmondson分级亦无显著差异(表1)。在术前Gd-EOB-DTPA增强MRI图像中(表2),转移组在T1WI序列上多表现为低信号[9(60.0 %)vs.6(20.0 %),P=0.0 42];在DWI序列上多表现为高信号[12(80.0 %)vs.7(23.3 %),P<0.0 01];转移组病灶动脉期多为不均匀强化[10(66.7 %)vs.7(23.3 %),P=0.0 17];在过渡期多表现为低信号[12(80.0 %)vs.6(20.0 %),P=0.0 01];在肝胆特异期多为低信号[9(60.0 %)vs.5(16.7 %),P=0.0 16],肝胆特异期极低信号范围多>1/2[14(93.3 %)vs.11(36.7 %),P<0.0 01];肝胆特异期最高信号值较非转移组低[250 (212.0 0~325.0 0) vs. 322 (251.2 5~399.2 5),P=0.0 36]。
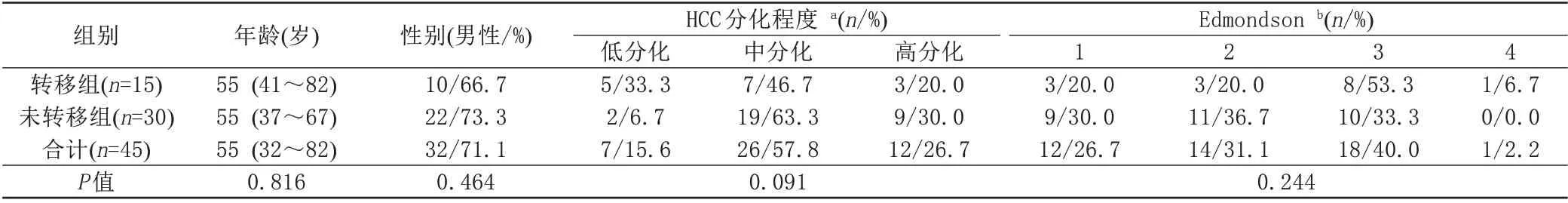
表1 HCC患者临床特征及病理检查结果

表2 术前Gd-EOB-DTPA增强MRI的影像学特征
2.2 风险分析
表3为Gd-EOB-DTPA增强MRI的影像学特征对HCC肝内转移预测作用的单因素和多因素分析结果,在Kapl an-Meier单因素分析中,DWI高信号相比于等信号是转移的危险因素(HR=3.5 7,95%CI:1.3 3~9.5 6,Log-rank检验,P=0.0 23,图1A);过渡期低信号相比其他信号类型是转移的危险因素(HR=6.0 0,95%CI:2.1 3~16.8 3,P<0.0 01,图1B);肝胆特异期极低信号范围>1/2也是转移的危险因素(HR=5.1 1,95%CI:1.8 9~13.7 8,P=0.0 11,图1C)。进行多因素Cox回归分析时,纳入所有单因素分析P<0.1 的因素并校正了年龄、性别、HCC分化等级、Edmondson分级,发现过渡期低信号(HR=6.1 9,95%CI:1.7 3~22.1 6,P=0.0 05)是HCC转移的独立危险因素。

图1 Gd-EOB-DTPA增强MRI特征单因素分析风险曲线图

表3 Gd-EOB-DTPA增强MRI的影像学特征对HCC转移的预测作用:单因素和多因素分析
3 讨论
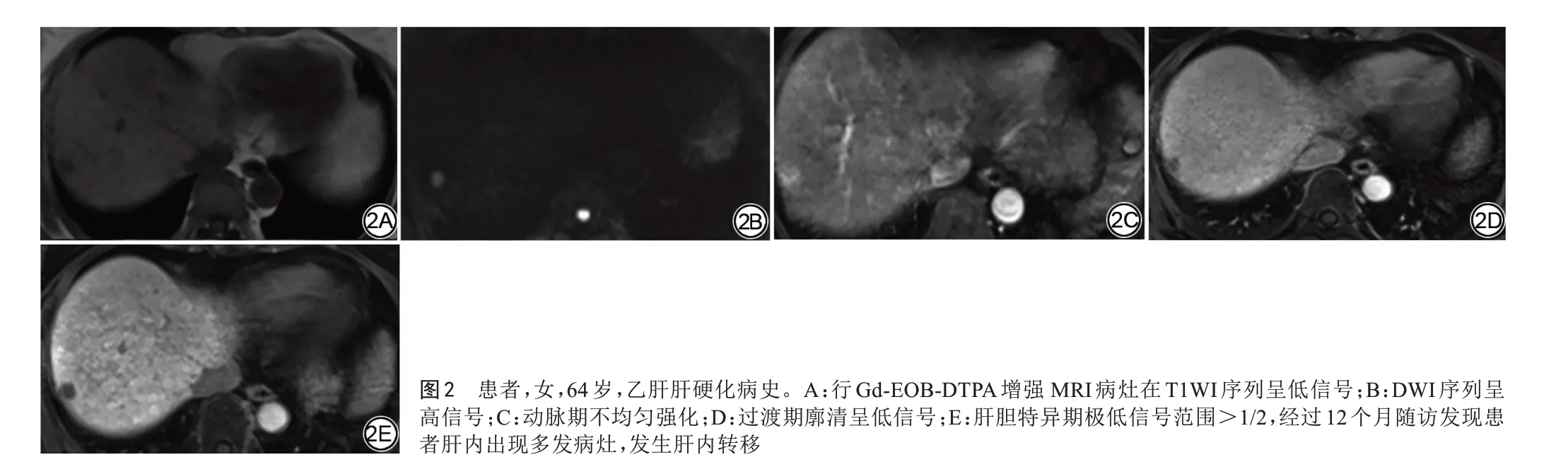
HCC早期出现转移大多和肿瘤本身及手术因素有关。本研究sHCC发生转移时间多出现在2~36个月,可能与早期sHCC结节小动脉新生血管未完全形成有关。本文关于sHCC转移主要有三大发现:(1)与未转移组相比,发生肝内转移的sHCC在Gd-EOB-DTPA增强MRI图像中T1WI序列上多表现为低信号(图2A),DWI序列上多为高信号(图2B),动脉期病灶多为不均匀强化(图2C),过渡期廓清多表现为低信号(图2D),肝胆特异期多为低信号,肝胆特异期极低信号范围多>1/2(图2E);(2)早期出现DWI高信号,动脉期病灶不均匀强化,过渡期低信号,肝胆特异期低信号及肝胆特异期极低信号范围>1/2的HCC病灶通过随访更容易发生肝内转移。(3)过渡期低信号是HCC肝内转移的独立危险因素。
3.1 Gd-EOB-DTPA的特性
Gd-EOB-DTPA是一种特异性肝细胞对比剂,可被正常肝细胞通过有机阴离子转运多肽(or gni aniont r ans por t ing pol ypept ide,OATP)摄取。Gd-EOB-DTPA能同时获得MRI增强各期及肝胆特异期图像,在静脉注射Gd-EOB-DTPA后被有正常功能的肝细胞通过细胞膜上所表达的有机阴离子转运多肽1B3(OATP1B3)摄取[6],而后经肝细胞胆管面多耐药相关蛋白2(MRP2)排泄至胆管,肝实质强化程度在10~20 min后达最高峰,此时胆管亦成像[7],称为肝胆特异期。当在HCC的发生过程中,随着肝细胞异型性的增加,OATP表达下降,摄取Gd-EOB-DTPA减少[8-10],而癌变后的结节不含正常肝细胞,难以摄取Gd-EOB-DTPA,从而在影像图上显示低信号[11-12]。前期研究把肝胆特异期低信号结节视为危险结节,将来有癌变的风险[13]。
3.2 Gd-EOB-DTPA增强MRI的影像学特征对HCC转移的预测风险
本研究发现肝胆特异期低信号及肝胆特异期极低信号范围>1/2是sHCC肝内转移的高危因素,转移风险明显高于肝胆特异期极低信号范围<1/2的sHCC,推测与肿瘤内部成分有关。具有正常肝细胞的组织或者病变在肝胆特异期可以摄取对比剂呈高信号,而不具有正常肝细胞的肿瘤、肿瘤样病变或其他感染性病变不能摄取而呈低信号,sHCC不具有正常肝细胞,肝胆特异期不能摄取对比剂呈低信号。有文献[14]报道,少数分化较高的HCC肝胆特异期可以摄取部分对比剂呈高信号,可能是高、中分化的HCC仍然具有少部分正常的肝细胞,在肝胆特异期可以摄取普美显而显示出部分高信号。本研究显示发生肝内转移的肝胆特异期多表现为不均匀低信号,极低信号范围越大,恶性度越高,发生转移的风险越大。以往认为肝胆特异期信号与HCC分化程度和胆汁分泌相关,分化程度越高,正常细胞数量越多,信号越高[15],但Nar it a等[16]的研究表明肝胆特异期信号与分化程度和胆汁分泌无关,HCC对Gd-EOB-DTPA的摄取由OATP1B3蛋白表达水平决定。MRP2的表达可决定对比剂的积聚与排泄,如果MRP2位于正常细胞膜上,对比剂能够排泄进入胆管,HCC则表现为低信号[17]。如果肿瘤细胞因为胆管的缺失导致MRP2并不起作用或者表达量下降,MRP3可为高表达,虽然其排泄率减低,但OATP1B3的摄取率仍存在或增加,导致肿瘤HBP也可呈等或高信号,且更多见于中分化HCC[18],推测肝胆期低信号不能准确地反映分化程度,因此无法仅从肝胆期低信号预测风险程度,而本研究结果显示肝胆特异期极低信号范围超过1/2预示转移风险较大。此外,HCC肝胆特异期的信号亦可能受地区和种群影响,以往将低信号结节视为风险病灶的多为欧美国家的研究[18]。sHCC增强动脉期强化不均匀肿瘤属于不均质性,部分结节见相应的肝动脉血管增粗,部分病变内见迂曲增粗的病理血管。由于肿瘤新生血管结构紊乱扭曲,基底膜欠连续,导致渗透性增加,Gd-EOB-DTPA在病灶中的分布及代谢不同于正常组织,部分病灶动脉期易形成不均匀强化。基于此病理基础,Gd-EOB-DTPA经过后处理可获得一系列药代动力学参数(Ktrans、Vp、Kep),以 此 来 反 映 病 灶 微 血 管 密 度(microvessel densit y,MVD)的状态,恶性病变灌注量的变化与微血管密度及分布密切相关,肿瘤恶性程度越高,其内微血管密度越高,转移风险越大。Kudo等[19]研究指出HCC动脉血供增加和门脉血供减少提示肿瘤生长速度加快。Wang等[20]通过对30例肝癌患者进行动态增强扫描发现,在病灶明显强化的病例中其血管内皮生长因子呈高表达,提示磁共振动态对比增强可以反映肝癌的血管生成状况。本研究结果显示动脉期不均匀强化10例发生转移,故动脉期明显不均匀强化的sHCC应高度重视其转移风险。
本研究显示过渡期明显廓清呈低信号易发生肝内转移。前期研究表明过渡期比门脉期能更好地反映肝硬化肝癌的廓清情况[21]。与传统的含钆细胞外对比剂不同,Gd-EOB-DTPA属于肝胆对比剂,肝细胞对肝胆对比剂的摄取早在门脉期结束就开始了,所以过渡期低信号除了由于廓清以外还与肝细胞摄取肝胆对比剂减少有关,提示具备正常功能的肝细胞数量减少,分化等级低,恶性度高[22]。
Gd-EOB-DTPA能够从组织学角度对癌灶进行更为准确和有效的反应[23],可以提高对肝癌,尤其是对≤2 cm的小肝癌灶的检出率及诊断符合率。因肿瘤引起的分子扩散运动受限,在病变早期即可敏感地检出肿瘤病灶,DWI可以较为均匀地抑制肝脏背景信号(如血管、胆管),有利于肝脏局灶性病变的显示。国内外相关报道显示,在MRI检查中应用DWI扫描可有效区分良恶性病灶[24-25]。增强MRI联合DWI诊断可提高原发性肝癌检出率,且可准确鉴别肝脏病变类型,具有较高的诊断效能。T1WI无法清晰显示细小病灶,而通过运用增强MRI的“速升速降”曲线特征与DWI的信号相结合,更有助于诊断微小肝癌。DWI可选择不同的b值,定量测量ADC值鉴别病灶的良恶性。低ADC值表示扩散受限,提示细胞密度高;反之,高ADC值为自由扩散,说明细胞密度低,提示恶性度越高,转移风险越高。
本研究仍存在一些不足:(1)样本量不够大。(2)可能存在选择偏倚。(3)随访时间较短,以发生肝内转移视为随访终点,没有进一步随访关注发生肝内转移患者的生存情况。对于如何解释HCC在Gd-EOB-DTPA增强MRI各时期各序列的影像表现至今尚无定论,对于高危病灶的划定也有所不同,为了更好地评估HCC转移的风险,还需要多中心、大样本的随机对照试验以验证。
综上所述,Gd-EOB-DTPA增强MRI在HCC病灶检出、鉴别、预测等多方面均有显著优势。可以为临床早期制定治疗方案提供数据支持,进一步提高患者生存质量、延长患者生存期。
作者利益冲突声明:全体作者均声明无利益冲突。
