一种脑结构自动化测量方法应用于阿尔茨海默病诊断的初步探讨
2021-08-04李华兵唐湘祁陈远肖焕辉王思伦
李华兵,唐湘祁,陈远,肖焕辉,王思伦*
阿尔茨海默病(Al zheimer's disease,AD)是痴呆症的最主要病因,占到50%~75%,且发病率随年龄的增长而增加,65岁以后AD发病率每5年大约增加1倍[1]。AD类神经退行性疾病进展的一个常见生物学标记是脑结构的形态学改变,这种变化可以通过体积测量[2-4]或绘制脑结构萎缩的三维空间分布图来评估。基于全脑或者单一脑区解剖结构的纵向研究发现,脑萎缩在AD疾病进展过程中逐渐加速[5-7]。在病理学应用中,针对不同脑结构的体积测量已被确定为AD检测有效的影像学生物标志物[8]。此外,家族性AD研究中发现,左侧海马体和右侧海马体分别在AD诊断前9年和6年前就已经出现明显萎缩,而根据脑边界位移计算的全脑萎缩在AD诊断前的3~4年就已经发生[9]。
在针对AD脑结构估计的影像学方法中,人工勾画测量迄今仍然是量化大脑萎缩性变化的金标准,即基于对每个特定感兴趣脑区的位置和形状的知识基础进行手动勾画和计算体积[10-11]。此方法因为要在大量的MRI扫描影像中分离脑部结构,需要花费大量时间,而且依赖于专家技能和解剖学知识[12-13]。近年来自动化脑影像技术越来越多地被用于寻找中枢神经系统疾病的生物学标志物、以及用于诊断和预测病程进展[14]。目前大量的研究报道了一些用于脑部区域分割和体积计算的自动化分析系统[13,15-18]。
本前瞻性研究通过对脑部MRI影像数据的分析,旨在评估一种脑结构自动化测量方法,并与人工手动勾画方法分割脑影像的方式进行比较,确定脑结构自动化测量的准确性和可靠性。此外,在AD组和对照组人群中,利用脑结构自动化测量分析全脑47个脑区的体积变化,旨在评估脑结构自动化测量技术应用于AD诊断的潜在价值。
1 材料与方法
1.1 研究对象
收集自2016年1月至2017年4月在中南大学湘雅二医院扫描的240份头颅影像数据,被试年龄:18~80周岁。排除标准:①白质对比度不清晰,脑结构异常;②存在肿瘤、脑损伤、脑积水、大面积钙化灶等脑部实质性病变,或其他植入物等;③增强扫描(使用对比剂);④扫描没有覆盖全脑。最终入组204人的正常人群数据(男97人,女107人),年龄(45.5±13.1)岁。本研究是前瞻性分析,经过中南大学湘雅二医院伦理委员会批准,所有受试者均已通过口头通知并签署书面同意书。
AD组中34例(男16例,女18例)患者,年龄(58.2 ±8.2 )岁。所有AD病例均由中南大学湘雅二医院神经内科主治医生综合病史、量表进行评估[简易精神状态量表(Mini-ment al St atus Examinat ion,MMSE)和蒙特利尔认知评估量表]和其他系统性检查进行诊断且排除其他中枢神经系统疾病(帕金森症、亨廷顿舞蹈症等)的可能影响,疾病诊断参照美国精神疾病诊断及统计手册第四版及美国国立神经病语言障碍研究所阿尔茨海默病及相关疾病协会标准[19]。具体地,临床失智评分量表(Cl inical Dementia Rating Scal e,CDR)评分≥1,MMSE评分为18~24分。根据AD组的年龄和性别,在纳入的正常人群中匹配一组对照组(n=34,男11人,女23人),年龄(56.4±6.5 )岁。
1.2 MRI数据采集
采用Siemens以及Phil ips 1.5 T和3.0 T磁共振扫描仪对所有被试进行全脑T1加权三维磁化强度预备梯度回波序列(three dimensional magnetization pr epar ed r apid acquisit ion gr adient echo,3D MP-RAGE)序列采集。扫描方向:矢状位,TR:8.0 ms,TE:3.7 ms,层数:250,层厚:1.2 0 mm,翻转角度:8°,FOV:256 mm×256 mm,带宽:190 Hz,采集矩阵:252×227×250,体素大小:0.9 8 mm×0.9 8 mm×1.2 0 mm。
1.3 脑区体积的人工勾画测量
脑区体积的人工勾画测量由5年以上资质的2名经验丰富的临床医师,在MRI数据上采用3D Sl icer影像处理软件,借助结构核磁共振脑影像,选取左、右侧海马,左、右侧脑室,左、右侧尾状核,左、右侧壳核,左、右侧丘脑共10个特定感兴趣脑区用鼠标逐层勾画目标脑区轮廓结构并计算面积。面积乘以扫描层厚为该层面体积,逐层相加之和即为脑区的体积。为消除个体头颅大小对上述数据的影响,数据均进行标准化处理。体积标准化值=(原始数据/颅腔体积)×颅腔体积平均值;颅腔体积为颅腔左右径、前后径、上下径的乘积。
1.4 脑区体积的自动化测量
脑结构自动化测量使用MRI影像处理软件Dr.Br ain(脑医生,上海铱硙医疗科技有限公司)。软件应用Neur omor phomet r ics脑模板可以对MRI影像数据进行自动分割,自动得出多个脑部重要区域的体积数据,具体工作流程如图1所示。在本研究中包括了海马、脑室、丘脑、尾状核、壳核等在内的47个脑区的体积数据。单个脑区的绝对体积为对应分割区域的灰质和白质体积之和,单个脑区的相对体积为绝对体积除以脑实质总体积(脑灰质总体积+脑白质总体积)。
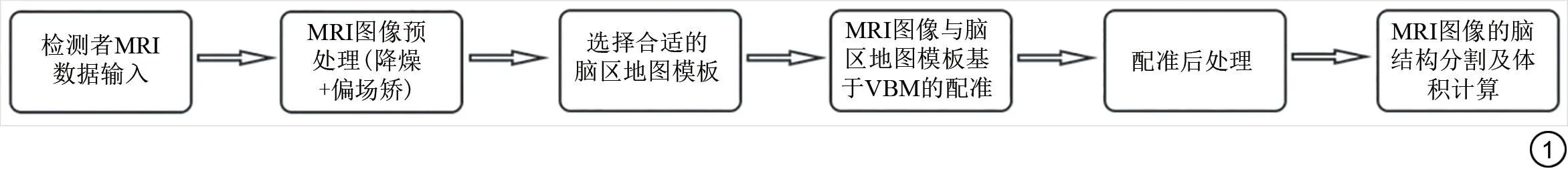
图1 Dr.Brain工作流程图Fig.1 Work flow sketch of Dr.brain software.
1.5 统计学分析
所有研究数据使用Matl ab 2018a(The MathWorks)和MedCal c 15.2.2 软件进行统计学分析,使用Pearson相关系数分析脑结构自动化分析和手动勾画测量的10个脑区体积结果的相关性,使用双侧Wil coxon秩和检验分析自动测量与手动测量的差异显著性,并利用Bl and-Al t man图评价自动测量方法与手动测量结果的一致性。使用D’Agost ino方法检验脑各组体积数据的正态性,对于符合正态分布的两组体积数据比较采用独立样本t检验,对于不符合正态分布的两组体积数据比较采用Mann-Whit ney检验。P<0.0 5表示差异具有统计学意义。
2 结果
2.1 脑结构自动化分析与人工勾画测量脑区体积的一致性和相关性分析
脑结构自动化分析与手动勾画测量10个脑区体积结果的Bl and-Al t man一致性分析(图2A)表明,两者对于脑区体积的测量具有同样的精准度,所有脑区测量差异的均值位于0点附近,变异系数均小于5%,可重现系数(测量差异算术平均+1.9 6×标准差)与两种测量方式结果均值的比率在7.6 %~13.6 %。
脑结构自动化分析与手动勾画结果的皮尔逊相关性分析显示,软件自动分割与手工勾画结果有较高的相关性(图2B),具体为左侧脑室相关性系数r2=0.9 9,左侧丘脑相关性系数r 2=0.9 5,左侧尾状核相关性系数r2=0.9 5,左侧壳核相关性系数r 2=0.9 6,左侧海马体相关性系数r2=0.9 2,右侧脑室相关性系数r2=0.9 9,右侧丘脑相关性系数r 2=0.9 5,右侧尾状核相关性系数r2=0.9 6,右侧壳核相关性系数r 2=0.9 4,右侧海马体相关性系数r2=0.9 1。Wil coxon秩和检验表明,在所考察的所有10个脑区中,手动勾画结果与自动测量的差异均不存在统计学意义(P>0.0 5)。所有结果表明,脑结构自动化测量与手动勾画测量的脑区体积之间具有良好的一致性和相关性。

图2 软件自动分割和计算与手动勾画测量脑区结构的一致性和相关性分析。A:Bland-Altman分析两种脑区体积分割测量方法检测ROI的一致性;B:皮尔逊相关性分析两种脑区体积分割测量方法检测ROI的相关性Fig.2 Consistency and correlation analysis between automatic segmentation by software and manual segmentation.A:ROI consistency assessment of the two segmentation methodsby using Bland-Altman analysis;B:ROIcorrelation assessment of thetwo segmentation methodsby using Pearson correlation analysis.
2.2 脑结构自动化分析与人工勾画测量脑区体积差异的分布
脑结构自动化分析与手动勾画测量脑区差异绝对值的分布,10个脑区的手动勾画和自动分割的差异相对比率(|手动-自动|/手动)的中位数均小于5%。10个脑区的分割差异相对比率的中位数分别为2.9 4%、3.0 8%、3.4 2%、2.9 0%、2.7 2%、3.2 0%、2.9 1%、2.8 4%、3.2 4%、3.3 9%。见图3。因此,脑结构自动化分析的脑区分割测量结果,能够在一定程度上准确地替代人工勾画测量。

图3 脑结构自动化分析与手动勾画测量10个脑区结构差异绝对值的分布。1:左侧脑室,2:左侧丘脑,3:左侧尾状核,4:左侧壳核,5:左侧海马,6:右侧脑室,7:右侧丘脑,8:右侧尾状核,9:右侧壳核,10:右侧海马Fig.3 Variation analysis of the 10 brain regions between automatic segmentation by software and manual segmentation.1:Left ventricle,2:Left thalamus,3:Left caudate nucleus,4:Left putamen,5:Left hippocampus,6:Right ventricle,7:Right thalamus,8:Right caudate nucleus,9:Right putamen,10:Right hippocampus.
2.3 AD组和对照组脑区绝对体积的比较
AD组患者中男16例,女18例,年龄(58.1 8±8.1 8)岁;对照组中男11例,女23例,年龄(56.4 4±6.5 3)岁。两组年龄和性别分布之间没有显著性差异(P>0.0 5)。采用脑结构自动化测量AD组和对照组全脑47个主要脑区(包括额叶、颞叶、顶叶、枕叶、岛叶、扣带回及其他)的体积结果表明,AD组脑室结构(包括侧脑室、第三脑室、第四脑室)体积显著高于对照组(P<0.0 5)。此外,AD组中的额中回、额下回、内侧前额叶、内侧额上回、眶部额下回、颞上回、颞中回、颞下回、颞极、颞横、缘上回、角回、楔前叶、顶盖、枕上回、枕中回、枕下回、楔叶、枕叶梭状回、舌回、距状回、前扣带回、中扣带回、后扣带回、伏隔核、杏仁核、海马体、壳核、丘脑、基底区域、内嗅区、海马旁回的绝对体积显著低于对照组(P<0.0 5,表1)。
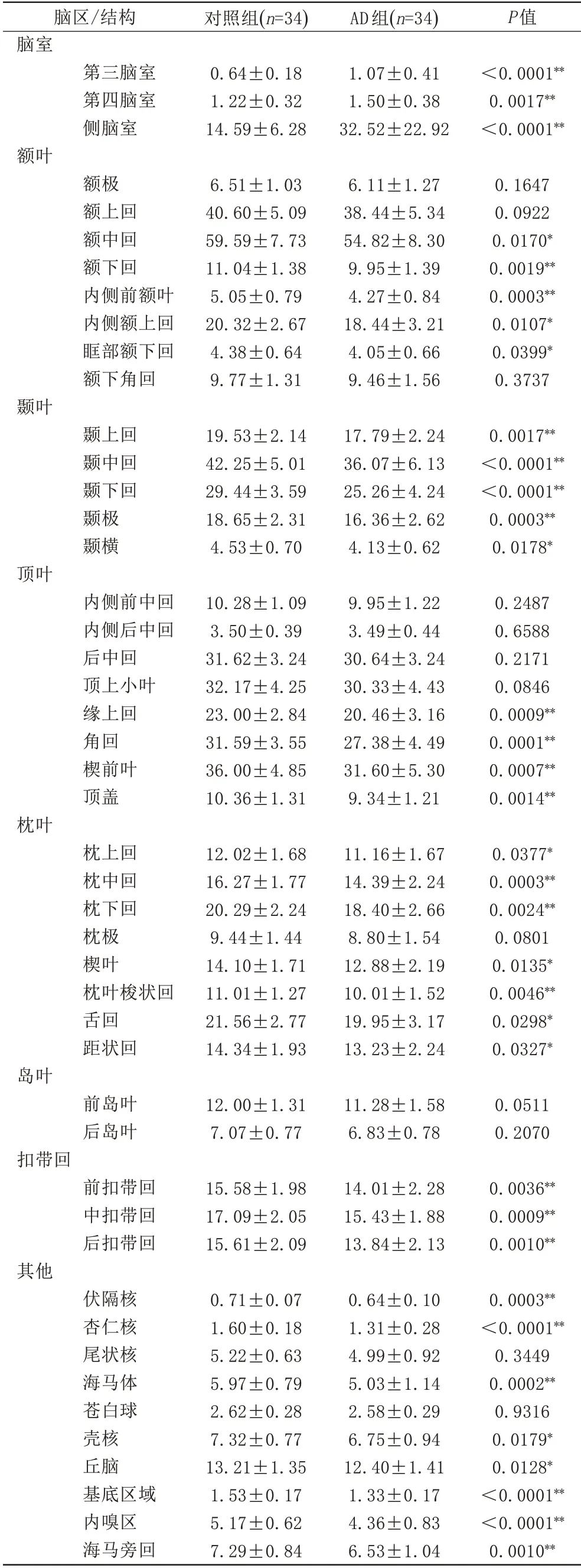
表1 对照组和AD组中各个脑区绝对体积的比较(mL)Tab.1 Comparison of absolute volume between control group and AD group(mL)
2.4 AD组和对照组脑区相对体积的比较
AD组和对照组脑区相对体积(脑区绝对体积/个体脑实质总体积)的比较分析显示,AD患者中11个脑区,包括内侧前额叶(P=0.0 009)、颞中回(P=0.0 003)、(P=0.0 012)、颞极(P=0.0 093)、角回(P=0.0 030)、楔前 叶(P=0.0 052)、后 扣 带回(P=0.0 157)、杏 仁 核(P<0.0 001)、海马体(P=0.0 016)、基底区域(P=0.0 022)、内嗅区(P=0.0 003)的相对体积显著低于对照组。见表2。
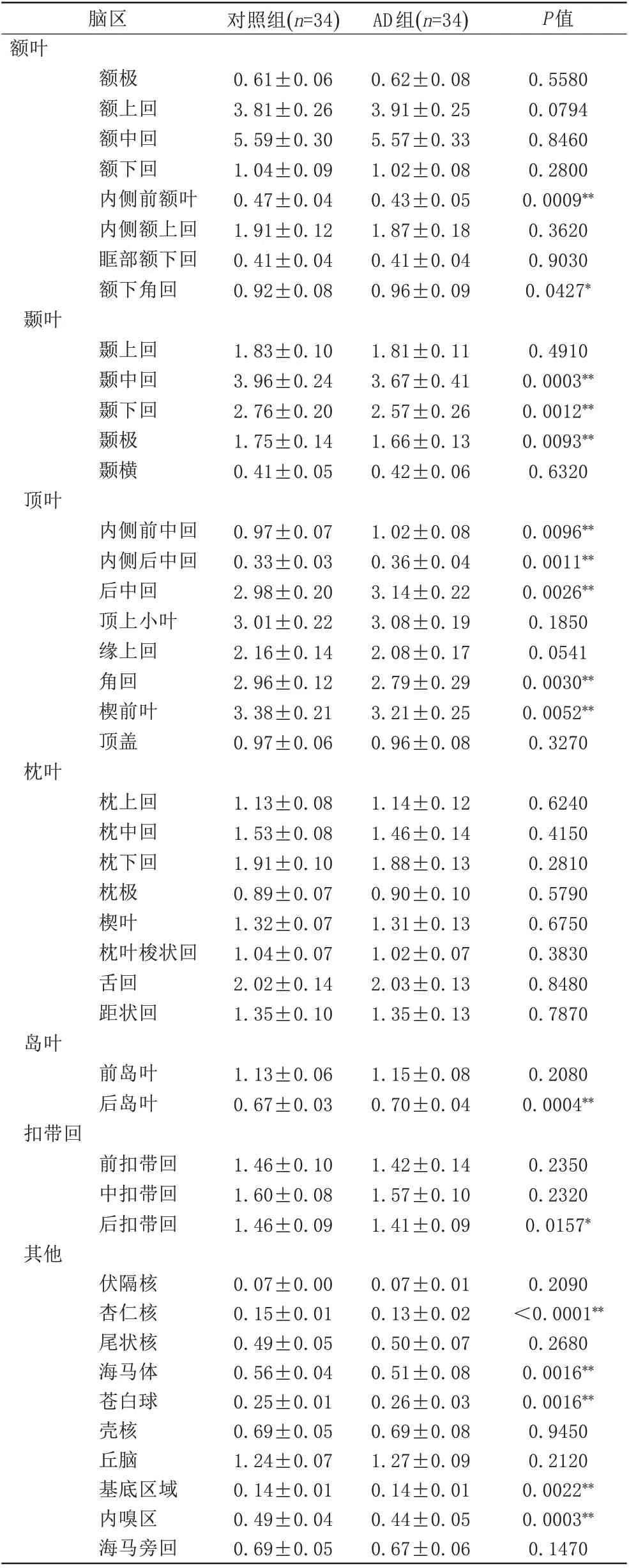
表2 对照组和AD组中各个脑区相对体积(绝对体积/实质总体积)的比较(%)Tab.2 Comparison of relative volume(absolute volume/parenchymal mass)between control group and AD group(%)
3 讨论
阿尔茨海默病是一种神经系统退行性疾病,主要的病理涉及脑部β-淀粉样蛋白(Aβ)的积累、神经元纤维缠结、葡萄糖代谢减退、突触功能障碍等。这些脑部神经变性过程在AD的进展过程中往往表现为某些局部脑区损伤更为严重。研究表明,结构性脑改变可以在AD患者临床认知功能下降前10年就已经出现[20],并且这些改变主要分布于受神经病理学影响的特定区域。本研究发现,利用脑结构自动化测量技术能够较为准确地进行脑区结构分割和体积测量,并且具有应用于AD诊断的潜在价值。
3.1 AD与脑室体积扩大
Godbol t等[9]在家族性AD纵向研究中发现,早在轻度认知障碍(mil d cognit ive impair ment,MCI)被诊断前的5年就已经出现脑室的明显扩大(扩大率约110%),而海马体在诊断前的6~9年也已经发生明显的萎缩。本研究中,AD组脑室3个结构体积相比较于对照组均有明显的扩大,分析的脑室系统包括侧脑室(扩大率122.9 %)、第三脑室(扩大率67.4 %)、第四脑室(扩大率22.9%),总体扩大率与报道的研究结果基本相同。
3.2 AD与内嗅区、海马和杏仁核体积萎缩
Chan等[21]发现AD患者大脑中内嗅皮层、海马和杏仁核出现对称性萎缩。Cavedo等[22]在包含36例AD患者的研究中,通过3D-建模和手工勾画的方法分别评估了杏仁核和海马体的结构变化,发现杏仁核相对于对照组发生17%~25%的体积萎缩,而海马体相对于对照组发生了13%~20%的萎缩。同样,本研究发现,AD患者双侧杏仁核和海马体发生了显著的体积缩小,双侧杏仁核萎缩18.1 %,双侧海马体萎缩15.7%,与已报道研究基本一致。大量研究表明,内嗅皮层是AD最早影响的脑结构之一,被认为是和AD发生密切相关的标志物[23-25],本研究发现AD组的内嗅区体积缩小15.7%。
3.3 AD与颞叶、顶叶和额叶体积萎缩
此外,本研究还发现AD中3个颞叶区(颞中回、颞下回、颞极)、2个顶叶区(角回、楔前叶)、1个额叶区(内侧前额叶)及后扣带回区属于典型的萎缩区域。大量文献报道了AD中的颞叶、顶叶、额叶的萎缩[26-27],但缺乏针对各个脑叶的萎缩区域细分,在此笔者针对典型的脑叶具体萎缩区域进行系统的报道。记忆力和语言功能下降是AD的重要临床症状,中后颞叶萎缩与这一临床症状直接密切关联[28]。Pengas等[29]在24例后来进展为AD的人群研究中,追踪了两个后扣带回区域(BA 23和BA 29/30)的变化,发现BA 23和BA 29/30都发生了明显萎缩,且萎缩模式与海马体相似,表明后扣带回是AD萎缩的关键区域。
3.4 AD与基底区域体积萎缩
除此之外,基底区域也是本研究发现的AD典型的萎缩结构。基底核内淀粉样蛋白积聚导致的胆碱能神经元退化和丢失是AD的病理特点之一[30-31]。一项多中心研究表明,针对基底区域的胆碱能系统的基于体素的形态测量中,AD组各亚区体积均明显缩小,以基底区域后部基底核最为明显,可以作为AD的生物标志物[32]。
3.5 脑结构自动化测量技术
AD患者的脑结构影像学变化,在患者最早症状出现时就开始了。Lehmann等[33]报道了针对AD脑萎缩模式研究,采用Fr eeSur f er软件和手工方法测量脑区体积并进行比较,表明采用自动化测量技术能够达到手工测量的精度。目前国际上存在的计算机辅助脑影像定量工具,例如Neur oQuant等,多以西方人脑结构作为标准计算。其脑萎缩程度的推导是基于西方人种大脑结构的正常范围计算的,而西方人与东方人脑结构体积的差异已被证实有统计意义。本研究中采用的脑结构自动化测量软件,以中国人群人脑结构作为标准计算,能够精确地分析计算中国人脑结构体积,该软件目前已获得NMPA认证。
为了验证自动定量分割方法和手工分割方法的一致性,及利用自动定量分割方法替换现有手工分割方法的可行性,本研究收集了不同磁场强度的(1.5 T和3.0 T)磁共振扫描仪所扫描的MRI图像。从研究结果来看,应用自动定量脑区测量技术与有经验的医生人工勾画测量具有良好的一致性。该研究中所采用的脑结构分析软件是基于体素形态学(voxel-based mor phomet r y,VBM)的测量方法,Mat suda等[34]报道了来自10个机构中心的624例患者中鉴别路易体痴呆和AD的研究,他们总结脑干背侧和内侧颞叶的基于VBM的方法分析有助于二者的鉴别,训练的识别精度可以达到73.4%。此外,Mar chewka等[35]也就不同磁场强度(magnet ic f iel d st r engt h,MFS)下对于AD人群基于VBM分析方法的影响进行了评估,研究结果指出在VBM方法的研究数据收集中,疾病状态和磁场强度(1.5 T和3.0 T)因素的影响可以被忽略。采集数据方式和机器的不同可能导致图像的质量不同,进而影响结果。但本文已对MRI图像进行人工勾画修正,因此将采集对结果的影响降到与其他论文类似的水平,采用自动定量脑区分割计算方法中,由多中心MRI图像采集过程对结果所造成影响可以参考类似论文[36],本文图像采集质量虽然不是最优,但与其他研究处于类似水平[37]。
3.6 研究的主要局限性
本研究还存在不足之处。研究发现,早发型AD和晚发型AD的脑结构变化存在差异[26],由于研究样本年龄和数量的限制,本研究没有区分开早发型AD和晚发型AD脑区结构变化上的差异。此外,针对认知正常期和MCI期的AD疾病进展阶段,缺乏一定数量的病例研究。
总之,脑结构自动化测量技术能够提供了一个可靠和快捷的自动化脑结构检测工具,对于多个脑区进行准确分割和体积测量,对于AD的诊断具有潜在的临床价值。本文通过前瞻性研究,报道了脑结构自动化测量软件在临床应用方面有广泛的前景,可以为AD的临床诊断和治疗方案的制定提供客观依据。
作者利益冲突声明:全体作者均声明无利益冲突。
