替米考星在养殖水体和鲫鱼组织中残留分布及代谢消减规律研究
2021-08-03崔雅楠徐锦华穆迎春
崔雅楠 乔 璐 徐锦华 韩 刚 程 波 穆迎春
(1.中国水产科学研究院,农业农村部水产品质量安全控制重点实验室,北京 100141;2.渤海大学食品科学与工程学院,辽宁锦州 121000)
渔药在降低水产养殖发病率和死亡率、提高饵料利用率、促进生长等方面发挥着重要作用,科学合理使用渔药是保证水产品质量安全的重要措施[1~2]。近年来渔用抗菌药的使用及其种类多样化发展,为水产品质量安全带来较大风险隐患[3~6]。2019年水产养殖“非药品”专项风险排查发现,替米考星(tilmicosin)检出率较高。替米考星是泰乐菌素衍生物,属于大环类抗生素,被广泛用于治疗牛、羊、鸡、猪等动物感染性疾病[7~9],且对畜禽呼吸道感染具有较好疗效[10~11]。替米考星对革兰氏阳性菌、某些革兰氏阴性菌、支原体、螺旋体等均有抑制作用,对胸膜肺炎放线菌、巴氏杆菌具有比泰乐菌素更强的抗菌活性[12~13]。此外,替米考星及其衍生物也被用于治疗和预防畜禽水产动物疾病,亚临床治疗剂量则用于促生长。但替米考星具有肝、肾毒性,可损害人体前庭和耳蜗神经,长期使用会引起耐药性的产生[14~17]。在水产养殖中使用替米考星,药物在达到治疗或促生长目标的同时,也会直接被水产养殖动物吸收而影响水产品安全。日本明确规定在有鳍鱼类自然比例带皮肌肉中替米考星的最大残留限量为50μg/kg[18]。我国尚未明确规定替米考星在水产品中的残留限量值,但我国GB 31650-2019《食品安全国家标准 食品中兽药最大残留限量》中规定,替米考星每日允许摄入量(Acceptable Daily Intake,ADI)为0~40μg/kg bw。目前,对替米考星在肉品中的研究多集中在禽肉检测,在水产品中的研究相对较少,其在水产动物体内的代谢消减规律研究缺乏。
彭泽鲫(Carassius auratusvar.Pengze),隶属于鲤形目鲤科鲫属,是一种广泛分布于淡水环境中的硬骨鱼类[19]。鲫鱼是以植物为食的杂食性鱼类,对养殖环境的适应能力强,主要分布在欧亚地区和我国的淡水地区[20]。本研究以彭泽鲫为实验对象,建立了替米考星在养殖水体及鲫鱼组织中残留量的高效液相色谱-串联质谱检测法,检测不同暴露时间和暴露浓度下替米考星残留水平,进而分析替米考星在鲫鱼组织中的代谢消减规律及药代动力学特征。
一、材料与方法
(一)药物与试剂替米考星(含量≥85%,上海源叶生物科技有限公司);替米考星标准品(纯度≥80.71%,德国Dr.Ehrenstorfer公司);罗红霉素内标物(德国Dr.Ehrenstorfer公司);乙腈、乙酸乙酯、甲醇、正己烷(均为色谱级,Fisher Chemicals公司);氯化钠、甲酸铵、磷酸氢二钠、磷酸二氢铵、EDTA钠盐(Na2EDTA)(均为分析纯,Biotopped公司);超纯水(600 L,中国屈臣氏)。
(二)仪器与设备电子天平(RL2002,瑞士Mettler Toledo);滤膜(0.45μm,中国津腾);针筒式滤膜过滤器(0.22μm,中国津腾);移液枪(10μL、20μL、1 000μL、5 000μL,德国Transferpette);固相萃取柱Oasis HLB(60 mg/3 mL,美国Waters公司);多试管涡旋混合器(Multi-Tube Vortexer MS200,杭州瑞诚仪器有限公司);涡旋混合器(IKA MS3 basic,德国IKA);自动高速冷冻离心机(Xiang Yi H-2050R,中国恒诺仪器);高效液相色谱-三重四极杆质谱仪,配有数据采集处理软件(TQS Quantum Access Max,美国Thermo Fisher Scientific);色谱柱:Intersil C18柱(150 mm×2.1 mm,3μm,美国Waters公司);1.5 mL棕色进样小瓶(1109-0520,美国安捷伦);试管(25 mL、50 mL,REF 430828,美国CORNING);无菌注射器(1 mL,中国KDL);氮吹仪(N-EVAPTM111,美国Organomation);超声波清洗机(SB-5200 DTN,宁波新芝SCIENTZ);医用低温保存箱(中国Haier)。
(三)实验动物从本地养殖场购进鱼体质量为(65±10)g的鲫鱼后,运输至中国水产科学研究院良乡实验基地,以2%氯化钠溶液消毒10 min,然后将其放置于已清洗并用高锰酸钾消毒处理的玻璃缸(300 L)中暂养1周。暂养期间养殖水体为持续供氧的淡水,水温24~26℃。每日8:00-9:00和16:00-l7:00各投喂1次鲫鱼饲料,日投喂总量为鱼体总质量的6%,且每天换水1次。暂养结束后,选择规格整齐、反应活跃、无明显病伤的个体鱼分别于0.15 mg/L和1.50 mg/L替米考星暴露浓度下养殖。
(四)实验方法
1.标准溶液配置。标准储备溶液:准确称取10 mg替米考星标准品溶于10 mL容量瓶中,用甲醇溶解并定容,混匀,配制成1 mg/mL的标准储备溶液,4℃保存。内标储备溶液:准确称取10 mg罗红霉素标准品溶于10 mL容量瓶中,用甲醇溶解并定容至刻度,混匀,配制成1 mg/mL的内标储备溶液,4℃保存。内标工作溶液:吸取10 μL内标储备溶液于10 mL容量瓶中,用甲醇稀释定容,配制成1.0μg/mL的内标工作溶液,现配现用。
2.样本采集。水样:水浴给药后,分别于0、6、24、48、96、144和192 h从各处理组采集水样,并于-80℃冷冻保存待测。鱼样:分别于4、6、8、9、10、12、15、18、23、28和33 d随机捕捞3条暴露养殖鲫鱼,并采集血液、鳃、肝脏、肾脏及肌肉样本,置于-80℃保存待测。
3.样品提取与净化。对比甲醇和乙腈提取剂,甲醇基质干扰大,峰形对称性差;乙腈可以沉淀蛋白,去除一部分杂质,因此选择乙腈进行提取。水样前处理:分别准确量取500 mL空白组和2组对照组,用抽滤装置过0.45μm滤膜,向过滤后的水样中加入10μL罗红霉素内标工作液和0.5 g Na2EDTA。用自动固相萃取仪过HLB小柱(甲醇3 mL、纯水3 mL活化)进行富集,样品上样流速15 mL/min(2滴/s),10 mL超纯水淋洗,抽干2 h以上,确保HLB柱填料完全干燥。然后用10 mL甲醇溶液洗脱,抽干,洗脱液置于玻璃试管中。洗脱液经氮吹仪40℃吹干,以1 mL甲醇定容,过0.22μm有机滤膜至进样小瓶中,待HPLCMS/MS检测。鱼样前处理:称取(2.00±0.01)g样品,置于25 mL离心管中,加入10μL内标工作液和15 mL乙腈,涡旋1 min,超声20 min,以4 200 r/min转速离心5 min,吸取8 mL上层有机液过Oasis HLB固相萃取柱,并用10 mL水和10 mL甲醇溶液洗柱,经真空泵抽干1 h,再用10 mL甲醇洗脱于15 mL氮吹管中,43℃下氮吹近干,用1 mL初始流动相复溶,过0.22μm滤膜至进样小瓶中,待HPLC-MS/MS检测。
(五)检测条件
1.色谱条件。色谱柱为Intersil C18柱(150 mm×2.1 mm,3μm),进样量为20μL,流速为0.5 mL/min,柱温为20℃,流动相A为0.1 mmol/L甲酸铵溶液,流动相B为乙腈。梯度洗脱参数见表1。
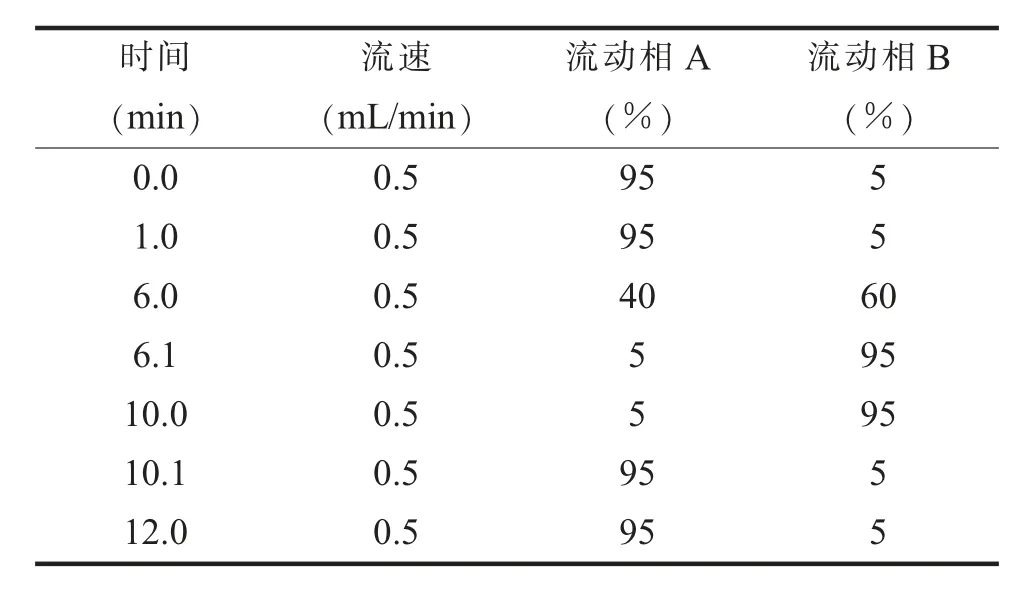
表1 梯度洗脱表
2.质谱条件。离子源:电喷雾离子(ESI)源、正离子模式,扫描方式为选择反应监测模式(SRM),电喷雾电压5 500 V,雾化气压力为0.069 MPa,气帘气压力为0.69 MPa,辅助气流速为0.414 L/min,离子源温度350℃,碰撞室出口电压为2.0 V,定性离子对(m/z) 为869.4/174.2和869.4/132.1,碰撞气能量为62 V和70 V,去簇电压90 V;定量离子对(m/z)为869.4/174.2,碰撞气能量为62 V,去簇电压90 V。替米考星标准物质的总离子图及定性离子和定量离子图见图1。
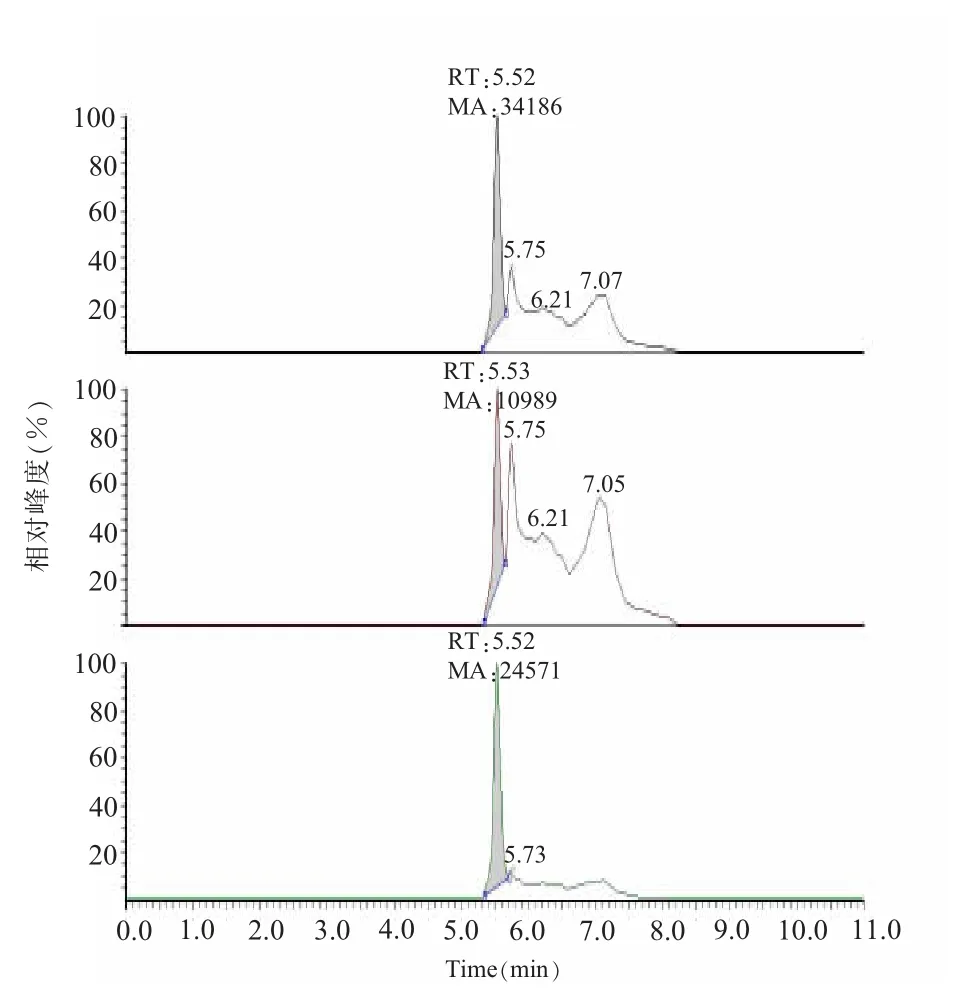
图1 替米考星标准物质的总离子图及定性离子和定量离子图
(六)标准曲线及回收率实验
1.标准曲线。配制1、2、5、10、20、50和100 ng/mL系列浓度基质标准工作溶液,进行HPLC-MS/MS检测,并以替米考星峰面积(A)为横坐标,浓度(C)为纵坐标,进行线性回归分析,得到标准曲线。
2.回收率实验。采用加标回收法,分别取鲫鱼空白血浆1.0 mL,空白组织鳃、肝脏、肾脏、肌肉各1.0 g,加入浓度为5、10、50 ng/mL的标准工作液,按照上述样品前处理方法处理样品,进样检测,获取不同浓度条件下的回收率。回收率=(基质添加峰面积/空白基质加标样品峰面积)×100%。
二、结果与分析
(一)标准曲线及回收率水样和鱼样中替米考星标准曲线如图2所示,水样标准曲线的回归方程为Y=14 659X+43 722(R2=0.996 9),鱼样标准曲线的回归方程为Y=25 539X+69 954(R2=0.996 2),养殖水体及鲫鱼中替米考星检出限为2.0 μg/kg。替米考星标准溶液在鲫鱼各个组织中的线性关系良好,鲫鱼各组织中替米考星标准曲线回归方程及回收率见表2,相关系数 (R2)范围为0.991 2~0.995 8,均>0.99,回收率为80.64%~89.41%。
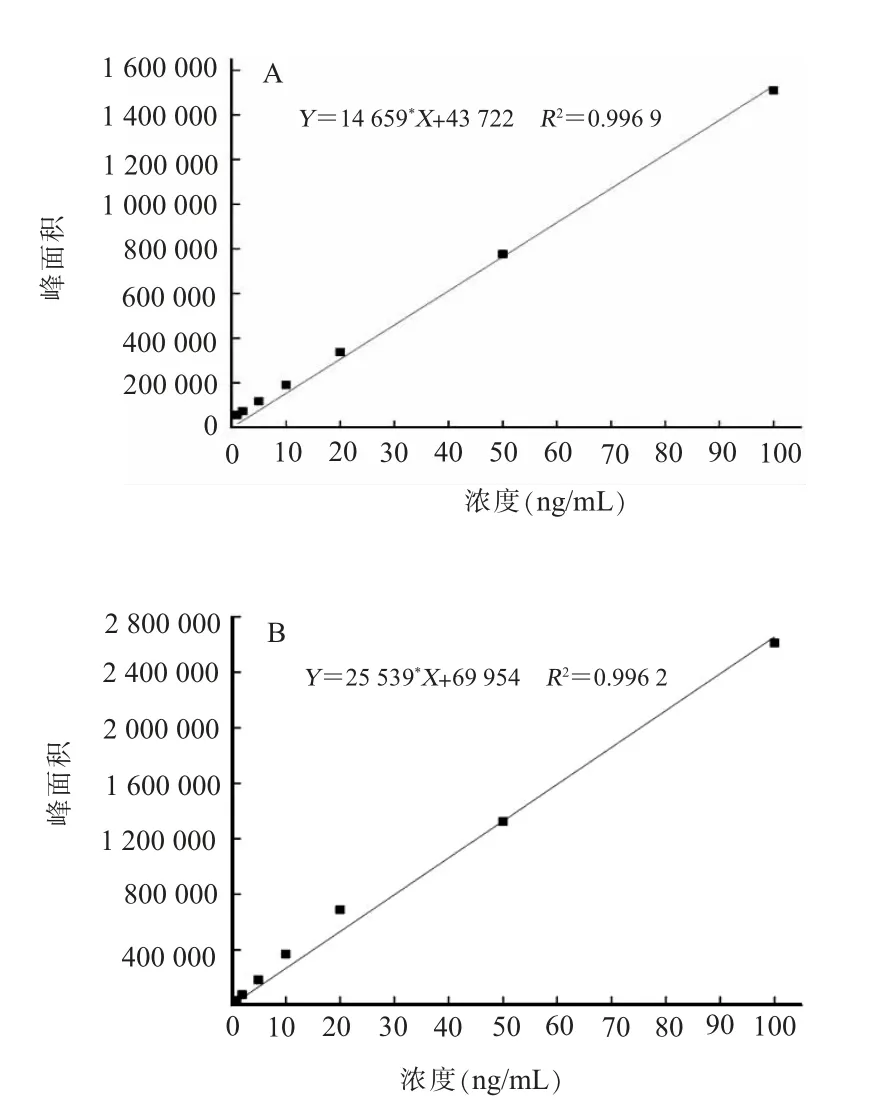
图2 水样和鱼样中替米考星标准曲线

表2 鲫鱼各组织中替米考星标准曲线回归方程及回收率
(二)替米考星在养殖水体中的残留变化规律依据上文所建方法,对实验组0、6、12、24、48、96、144和192 h时间点采集的水样进行上机检测。替米考星的残留浓度测定结果见图3,可以看出,在0.15 mg/L和1.50 mg/L 2种暴露浓度下的替米考星残留变化曲线基本一致,均出现2个峰值。养殖水体中替米考星残留量迅速下降,说明养殖水体中的替米考星被鱼体吸收富集;至96 h养殖水体中残留量呈现上升趋势是由于鱼体吸收的替米考星经胃肠排空和鱼体自身生物作用,部分替米考星以原药形式排出到养殖水体中。
由图3可见,0.15 mg/L替米考星暴露浓度下,自0~6 h,养殖水体中浓度下降至0.02 mg/L;6~12 h,替米考星浓度上升至0.07 mg/L,出现第1个峰值;至24 h浓度下降至0.02 mg/L,48 h时下降至0.01 mg/L;至96 h时养殖水体浓度再次上升至0.03 mg/L,出现第2个峰值;随后持续下降,144 h和192 h养殖水体中替米考星浓度分别为0.02和0.01 mg/L。0、12、24、48、96和192 h差异显著,其他时间差异不显著。
由图3可见,1.50 mg/L暴露浓度下养殖水体中替米考星的残留变化规律与0.15 mg/L暴露浓度下的规律一致。自0~6 h,养殖水体中替米考星浓度下降至0.74 mg/L;6~12 h上升至1.08 mg/L,出现第1个峰值;至24 h下降至0.51 mg/L,48 h时下降至0.40 mg/L;至96 h时养殖水体中替米考星残留浓度再次上升至0.95 mg/L,出现第2个峰值;至144 h和192 h养殖水体浓度持续下降至0.43 mg/L和0.38 mg/L。48 h、144 h和192 h差异不显著,其他时间差异显著。
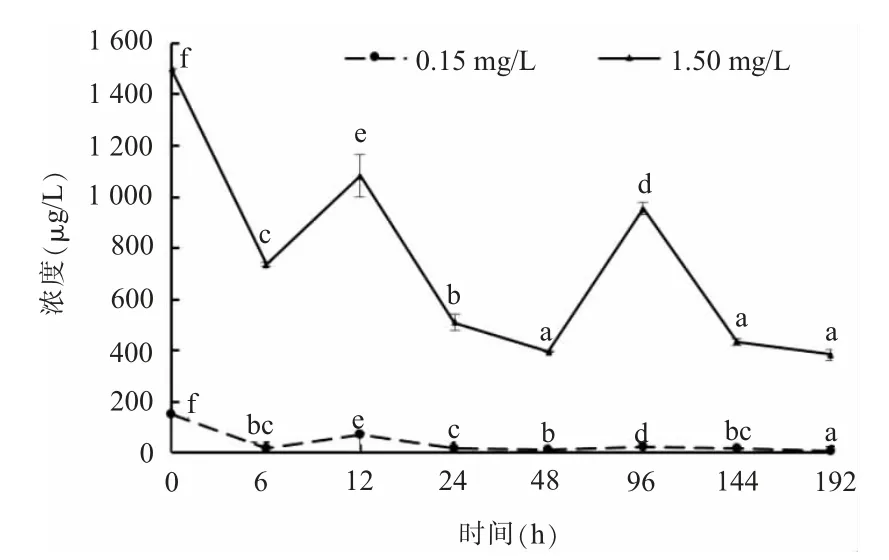
图3 不同暴露浓度下养殖水体中替米考星的药物浓度-时间曲线
(三)替米考星在鲫鱼组织中的代谢消减规律依据上文所建方法,对实验组第4、6、8、9、10、12、15、18、23、28和33 d时间点采集的鲫鱼各组织样本进行上机检测。2种暴露浓度下鲫鱼的鳃、肝脏和肾脏中替米考星的残留测定结果见图4~图6。结果显示,0.15和1.50 mg/L 2种暴露浓度下替米考星在3种组织中的代谢曲线变化基本一致,均呈现先升高后降低的趋势。
如图4所示,在0.15 mg/L和1.50 mg/L替米考星2种暴露浓度下,鲫鱼鳃中替米考星在第1个采集时间点的浓度分别为0.005、0.112 mg/kg;随后分别下降至0.002、0.036 mg/kg;然后明显上升,分别于8 d和9 d时达到最高浓度,浓度为0.089、0.502 mg/kg;之后迅速下降,在15 d和23 d时分别代谢完全。在0.15 mg/L替米考星暴露浓度下,第6、12和15 d差异性不显著,其他时间差异显著。1.50mg/L替米考星暴露浓度下,15 d与18 d的差异不显著,其他时间差异显著。
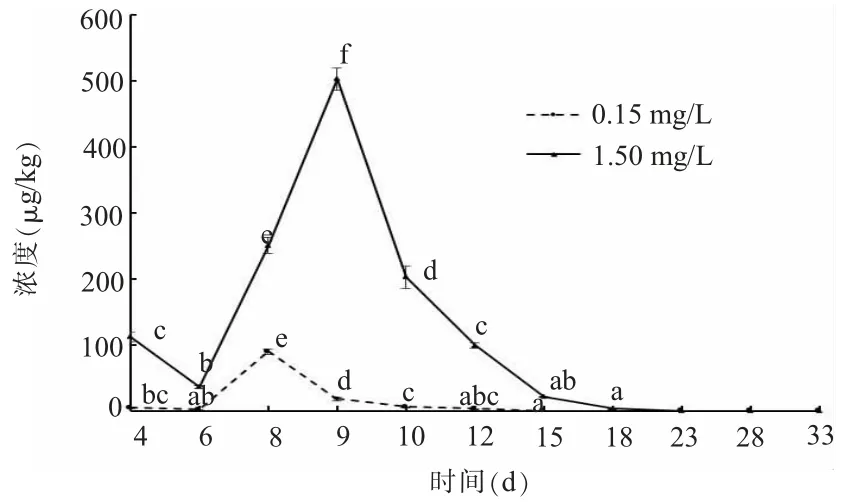
图4 不同暴露浓度下鲫鱼鳃中替米考星的药物浓度-时间曲线
如图5所示,肝脏中替米考星的变化趋势较明显,在2组替米考星暴露浓度下均于第8 d达到最高峰,低暴露组在8~9 d时下降趋势更明显,在第18 d检测到2组暴露浓度的含量均为0 mg/kg,说明替米考星在鲫鱼肝脏中代谢完全。在0.15 mg/L替米考星暴露浓度下,6、8、9 d的差异显著,其他时间差异不显著。在1.5 mg/L替米考星暴露浓度下,6、15、18 d的差异不显著,其他时间差异显著。
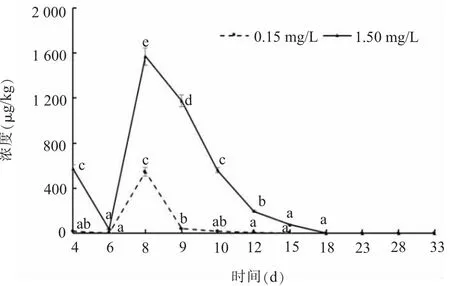
图5 不同暴露浓度下鲫鱼肝脏中替米考星的药物浓度-时间曲线
如图6所示,在2组替米考星暴露浓度下,4~8 d时鲫鱼肾脏中的替米考星浓度逐渐升高,在第8 d时达到最大值,含量分别为6.780和19.613 mg/kg,然后开始迅速下降。在不同暴露浓度下,替米考星在鲫鱼肾脏中的含量均远高于其他组织10倍至数十倍。在0.15 mg/L替米考星暴露浓度下,4、6、9、10、12、15和18 d差异不显著,其他时间差异显著。在1.50mg/L替米考星暴露浓度下,6、18 d差异不显著,其他时间差异显著。
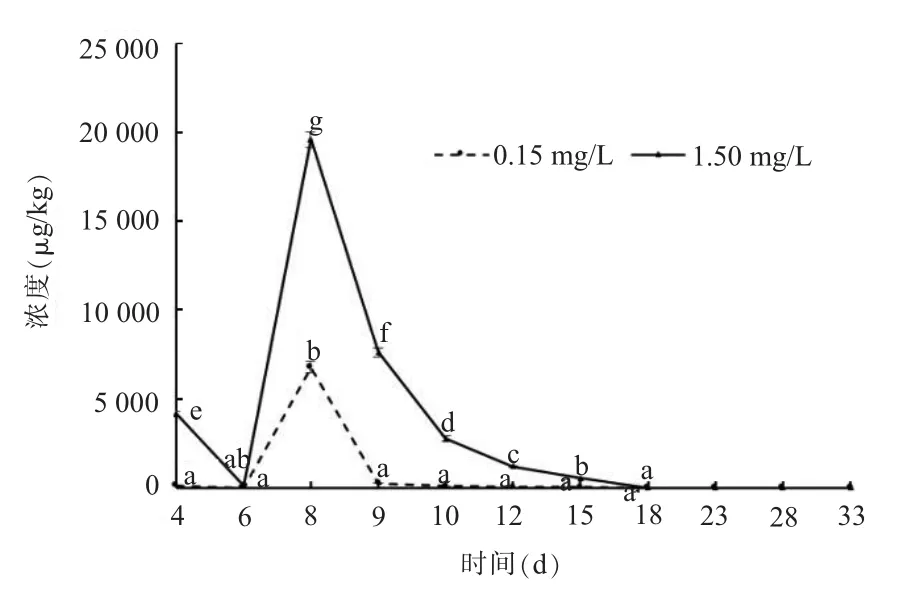
图6 不同暴露浓度下鲫鱼肾脏中替米考星的药物浓度-时间曲线
在替米考星暴露浓度为0.15 mg/L时,鳃、肝脏和肾脏中的浓度均于第8 d达到最高峰,峰值分别为0.089、0.544和6.780 mg/kg。随后3种组织中的替米考星含量均开始下降,并分别在第15、18和23 d时替米考星含量降低为0 mg/kg。在替米考星暴露浓度为1.50 mg/L时,鳃中的浓度于第9 d达到最高峰,肝脏和肾脏中的浓度均于第8 d达到最高峰,肾脏、肝脏、鳃中替米考星残留浓度峰值分别为19.613、1.571、0.502 mg/kg。随后3种组织中的替米考星含量均开始下降,并分别于23 d、18 d和23 d时降低为0 mg/kg。
(四)替米考星在鲫鱼组织中的药代动力学特征使用DAS 2.0药代动力学软件分析药代参数,结果见表3,在0.15 mg/L和1.50 mg/L替米考星暴露浓度下,鲫鱼鳃中替米考星最高浓度分别为0.089 mg/kg和0.502 mg/kg,药时曲线下面积为0.18(mg·d)/L和1.91(mg·d)/L,平均滞留时间为8.08 d和8.42 d,消除半衰期分别为0.51 d和1.25 d,达峰时间均为8 d。
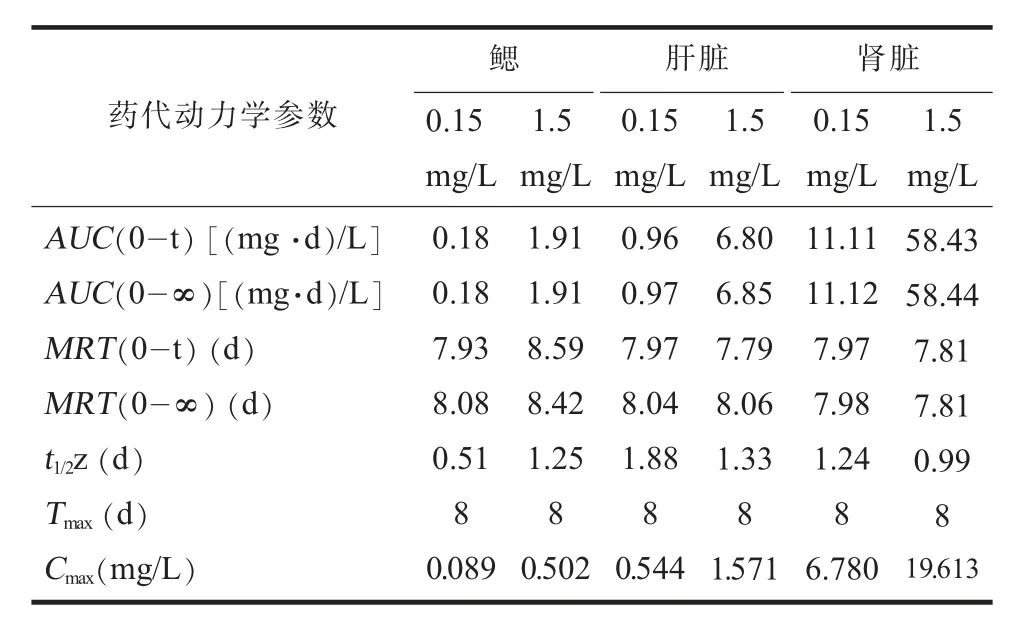
表3 不同浓度替米考星暴露下鲫鱼鳃、肝脏和肾脏中的药代动力学参数
鲫鱼肝脏中药时曲线下面积为0.97(mg·d)/L和6.85(mg·d)/L,平均滞留时间为8.04 d和8.06 d,消除半衰期分别为1.88 d和1.33 d;替米考星均在第8 d时达到最高峰,最高浓度分别是0.54 mg/kg和1.57 mg/kg,随后残留浓度迅速降低。
在0.15 mg/L和1.50 mg/L替米考星暴露浓度下,鲫鱼肾脏中替米考星药时曲线下面积为11.12(mg·d)/L和58.44(mg·d)/L,平均滞留时间为7.98 d和7.81 d,与鳃和肝脏的滞留时间差异不显著;消除半衰期分别为1.24 d和0.99 d,达峰时间均为8 d,与肝脏的达峰时间一致,最高浓度分别是6.78 mg/kg和19.61 mg/kg,肾脏是残留浓度最高的组织。
三、结论与讨论
(一)高效液相色谱-串联质谱法检测养殖水体和鲫鱼组织中替米考星残留目前常用的测定动物性食品中替米考星残留的方法主要有高效液相色谱法、液相色谱质谱联用法、酶联免疫法等,其中酶联免疫法具有快速、简便、灵敏等特点,且对仪器设备和检测人员要求相对较低,但该方法适用于基层大批量样品的快速筛查,若检测结果为阳性,应采用仪器方法(如高效液相色谱法、液相色谱质谱联用法等)进行定量确证。刘勇军和姜艳彬[21]建立了固相萃取-高效液相色谱法检测猪肉与鸡肉中替米考星残留量的方法,检出限为30μg/kg。曹忠君[22]应用高效液相色谱法对市场中64批次鸡肉样品中替米考星药物残留量进行检测,方法检出限为10μg/kg。易锡斌等[23]建立了测定禽肉组织中替米考星残留量的液相色谱-串联质谱方法,在禽肉不同组织中替米考星检出限为1.0~3.0μg/kg。吴婉琴等[24]建立了超高液相色谱-串联质谱法测定鸡肉中9种大环内酯类抗生素药物,其中替米考星检出限为2.5μg/kg。
本研究通过对提取剂的比较分析,建立了鲫鱼养殖水体中替米考星残留的前处理和检测方法,采用电喷雾离子源、正离子扫描模式,在多反应监测模式下测定各取样点养殖水体中替米考星含量。对于水产品,常用的提取试剂有Tris缓冲溶液、偏磷酸-甲醇、甲醇和乙腈等,本研究对鲫鱼血液、肌肉、肝脏、肾脏和鳃组织样品,用乙腈进行提取,并用Oasis HLB固相萃取柱净化。本研究采用高效液相色谱-串联质谱法测定鲫鱼及养殖水体中替米考星残留量,检出限为2.0μg/kg。液质联用法虽对仪器设备和技术要求高,但该方法检测替米考星灵敏度高、检测限低,且可以选择性地将分子量、分子结构等非常接近的物质分离开来,对其进行定性和定量。
(二)替米考星在养殖水体和鲫鱼不同组织中的残留分布特征在0.15 mg/L和1.50 mg/L替米考星药浴给药后,替米考星在水体中的含量逐渐下降,而暴露后一定时期内其在鲫鱼肾脏、肝脏、鳃中残留含量快速升高直到峰浓度,可见鲫鱼对水体中的替米考星具有较强的吸收和蓄积能力。养殖水体中的替米考星残留量均在96 h时出现反峰值,主要是由于鱼体在吸收养殖环境中的替米考星后,经胃肠排空和鱼体自身生物作用,部分替米考星以原药形式排出到养殖水体中。
以0.15 mg/L和1.5 mg/L浓度暴露后,替米考星在鲫鱼肾脏中残留量最高,肝脏、鳃次之,肌肉和血液中均未检出。鲫鱼不同组织中替米考星残留量于第8/9 d达到峰值,原因主要是前8 d鲫鱼一直处于暴露环境中,至第9 d换清水养殖,暴露浓度为0。给药初期,鲫鱼各组织中替米考星残留浓度均呈现上升趋势,说明在暴露初期替米考星不断被鱼体吸收并富集。鱼体在药浴暴露后,替米考星主要富集于鲫鱼内脏中,鳃中富集相对缓慢,肌肉和血液中未检测到有富集,原因是肾脏是药物代谢和排泄的重要器官,而肝脏是消化和代谢器官,特别是有机体中外源性物质的主要代谢器官,故肾脏及肝脏组织对替米考星具有较强的蓄积、富集作用。
(三)替米考星在鲫鱼组织中药代动力学特征分析鲫鱼鳃中替米考星药代动力学特征符合一级吸收一室开放模型,而肝脏和肾脏则符合一级吸收二室开放模型。在0.15 mg/L和1.50 mg/L替米考星暴露浓度下,鳃、肝脏、肾脏3种组织中最大药物浓度分别为0.089、0.544、6.780 mg/L和0.502、1.571、19.613 mg/L,消除半衰期分别为0.51、1.88、1.24 d和1.25、1.33、0.99 d。相比肝脏,替米考星在鲫鱼肾脏中残留量最高,消除半衰期短,消除速率较快,可在短时间内代谢完全。
已有的替米考星研究多集中在禽肉检测中,在水产品中的研究相对较少,主要涉及了替米考星对鱼类的毒性试验和检测方法的建立等,但尚未见替米考星在鱼体中代谢消减规律和药代动力学分析的研究报道。本文研究了替米考星在养殖水体和鲫鱼组织中的残留分布及代谢消减规律,并进一步分析了药代动力学特征,为替米考星在鱼肉中的代谢研究提供了数据基础。尽管鲫鱼肌肉中未检测到替米考星残留,但由于抗菌药在水产品及养殖水体中的暴露会间接影响人体健康,且抗菌药耐药性直接影响人类健康,抗菌药管控已在全球范围展开,在“健康中国”、减抗限抗背景下,替米考星作为抗菌类药物,应严格监管。
