肝内铁、脂沉积对ADC值评估慢性乙型肝炎患者肝纤维化的影响
2021-08-03盘中贤李主镜廖炯郝连涛孟凡琦胡元明黄嵘杨晓燕文武成陈玥瑶
盘中贤,李主镜,廖炯,郝连涛,孟凡琦,胡元明,黄嵘,杨晓燕,文武成,陈玥瑶*
作者单位:1.深圳市中医院(广州中医药大学第四临床医学院)放射影像科,深圳518033;2.北京大学深圳医院放射影像科,深圳 518036
肝纤维化是各种慢性肝病向终末期肝病进展的必经阶段,并有肝功能衰竭、肝癌等并发症的风险,而及早干预可以逆转肝纤维化进程。因此,肝纤维化的早期诊治及动态监测具有重要临床意义。肝活检是诊断肝纤维化的金标准,但具有有创性、取样误差、主观性强等临床应用限制[1]。无创性肝纤维化定量指标的开发备受关注,目前的影像学检查中,尽管超声及MR弹性成像诊断肝纤维化较受认可[2],但实际应用亦存在一些局限性。如超声弹性成像主观性强、依赖检查者水平,在肥胖、肋间隙狭窄患者中检查失败率高;MR 弹性成像需要额外配置昂贵设备而难以推广。因此,仍需探索其他可行性高、便于推广的无创性定量指标进行弥补。扩散加权成像(diffusion-weighted imaging,DWI)是一种检测活体组织内水分子扩散运动的MR 成像技术,现已广泛应用于肝脏MRI 检查中。Meta 分析显示DWI 诊断各级肝纤维化的合并曲线下面积(area under the curve,AUC)约0.8,具有良好的诊断性能,但这些纳入研究之间的诊断阈值及AUC差异较大[3]。主要原因可能是DWI 技术的不一致[4],现已逐步规范[5];此外,肝铁过载和脂肪肝对表观扩散系数(apparent diffusion coefficient,ADC)值的影响逐渐引起重视,但存在争议[6-7]。因此,本研究尝试探讨在慢性乙型肝炎患者中,肝铁过载和脂肪肝是否影响ADC值测量,并影响其诊断肝纤维化。
1 材料与方法
1.1 研究对象
本回顾性研究经过深圳市中医院医学伦理委员会批准(批准文号:K2019-070-01),免除受试者知情同意。
收集2018 年10 月至2019 年3 月在深圳市中医院进行肝脏MRI 检查的73 例慢性乙型肝炎患者,男61例,女12例,中位年龄50岁,范围14~75岁。纳入标准:(1)临床诊断慢性乙型肝炎:HBsAg 和(或) HBV DNA 阳性6 个月以上;(2)无合并其他病毒性肝炎、代谢性或自身免疫性肝病;(3)无肝脏手术史、遗传性血色病或反复输血史。排除标准:(1)合并大量腹水或直径>2 cm 的肝脏占位性病变;(2)有MRI 检查禁忌证(如安装心脏起搏器、体内金属植入物、幽闭恐惧症等);(3)图像伪影重,影响参数测量;(4)为确保测量数据的可靠性,剔除多回波Dixon序列后处理的拟合优度(goodness of fit)>5%的患者[8]。根据以上标准,本研究共排除了12 例患者:9 例患者多回波Dixon 序列的拟合优度>5%,2例患者有直径>2 cm的肝脏占位性病变,1例患者有肝右叶切除史。
1.2 肝纤维化分级
在MRI 检查前后2 周内行肝功能和血常规检查的患者,记录:丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天 冬 氨 酸 氨 基 转移 酶(aspartate aminotransferase,AST)、血小板(platelet,PLT),根据以下公式计算天冬氨酸氨基转移酶和血小板比率指数(aspartate aminotransferase-to-platelet ratio index,APRI):APRI=[(AST/AST 正常值上限)×100]/PLT (109/L)。在肝活检受限的情况下,APRI 是目前WHO 推荐的慢性乙型肝炎患者肝纤维化的替代标准[9]。一项纳入64 篇研究的Meta 分析显示,以病理检查为参考标准,APRI 诊断显著肝纤维化(≥F2)、肝硬化(F4)的AUC 均为0.76[10],相应的推荐阈值分别为0.5、1.0[11-13]。因此,根据APRI 进行肝纤维化分级:1 级,APRI<0.5,F0~1;2 级,0.5≤APRI<1,F2~3;3级,APRI≥1,F4。
1.3 MRI检查
1.3.1 检查方法
采用3.0 T 超导磁共振仪(MAGNETOM,Prisma,Siemens Healthcare,Erlangen,Germany),使 用16 通道体部相控阵线圈行肝脏MRI 检查。患者禁食4 h 以上,取舒适仰卧位,双手放于头部减少伪影,在腹部呼吸运动幅度最大处绑腹带以限制腹部运动,并放置呼吸传感器监测患者呼吸。主要检查序列包括轴位双回波Dixon、轴位多回波Dixon和轴位DWI。扫描参数如下:(1)双回波Dixon (T1WI VIBE):TR 3.97 ms,TE 1.29、2.52 ms,FOV 380 mm×380 mm,层厚3 mm,Averages 1,翻转角度9°;(2)多回波Dixon (T1WI VIBE):TR 9 ms,TE 1.1、2.46、3.69、4.92、6.15、7.38 ms,FOV 380 mm×380 mm,层厚3 mm,Averages 1,翻 转 角 度 4°;(3) DWI (EPI):TR 6700 ms,TE 46 ms,FOV 380 mm×380 mm,层厚5 mm,b值50、1000 s/mm2,Averages 为2、4,Noise level 10,iPAT 3,弥 散 模 式:4-Scan Trace,弥 散 方 案:monopoplar,压脂方法:SPAIR (spectrally adiabatic inversion recovery)。为了更好地评估肝纤维化,采用既往研究推荐的b 值(50、1000 s/mm2)[5];但高b 值会延长TE,降低图像信噪比,因此采用4-Scan Trace、monopoplar等技术将TE降至46 ms,保证图像信噪比。
1.3.2 图像分析
图像由2 名腹部影像诊断经验丰富的主治医师应用西门子Syngo.via工作站,在事先未知病理的情况下进行独立分析,不一致者经讨论达成统一。
多回波Dixon 技术是通过检测R2*和质子密度脂肪分数(proton density fat fraction,PDFF),无创性评估肝铁过载和脂肪肝的可靠方法[14-16],检查结束后可自动生成肝R2*图、PDFF 图。其中R2*是T2*的倒数,单位为1/s。关于测量R2*及PDFF 值时感兴趣区选取的方法,目前尚无统一标准。有研究显示,在9 个Couinaud 肝段均划取ROI、求均值的方法,具有较高的准确性和可重复性[17-18]。因此,阅片医师参考既往研究的方法[19],在PDFF 图上,尽量避开较大的血管及胆管、伪影及肝包膜等,9 个Couinaud 肝段分别划 取1 个 直径 约1 cm 的ROI 测 量PDFF 值,共 计9 个ROI,计算和记录PDFF均值。在R2*图和ADC图上每个肝段的对应位置划取ROI,测量R2*值和ADC 值,并分别计算和记录R2*均值、ADC 均值。参考与本研究采用相同厂家、场强和序列的既往研究结果[14-15],以R2*≥58.7 1/s 诊断肝铁过载,PDFF≥5.04%诊断脂肪肝。将患者分为非肝铁过载组与肝铁过载组、非脂肪肝组与脂肪肝组。
1.4 统计分析
应用SPSS 17.0 软件进行统计分析。采用Kolmogorov-Smirnov 检验评价计量资料是否符合正态分布,正态分布的资料以±s表示,偏态分布资料以M(QR)表示。根据有或无肝铁过载或脂肪肝进行分组,比较组间ADC 值及混杂因素的差异,其中计量资料采用独立样本t检验(正态分布)或Mann-WhitneyU检验(偏态分布),计数资料采用卡方检验或Fisher 确切概率法。采用Spearman 线性相关分析ADC值与R2*值、PDFF值、肝纤维化分级、年龄、性别的相关性,P<0.05 的变量进一步纳入多元线性回归分析,明确ADC值的独立影响因素。剔除肝铁过载患者或/和脂肪肝患者后,再采用Spearman线性相关分析ADC值与肝纤维化分级的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 纳入患者情况
本研究最终纳入了73 例慢性乙型肝炎患者,其中56 例在MRI 检查前后2 周内检查了肝功能和血常规。基本特征见表1。
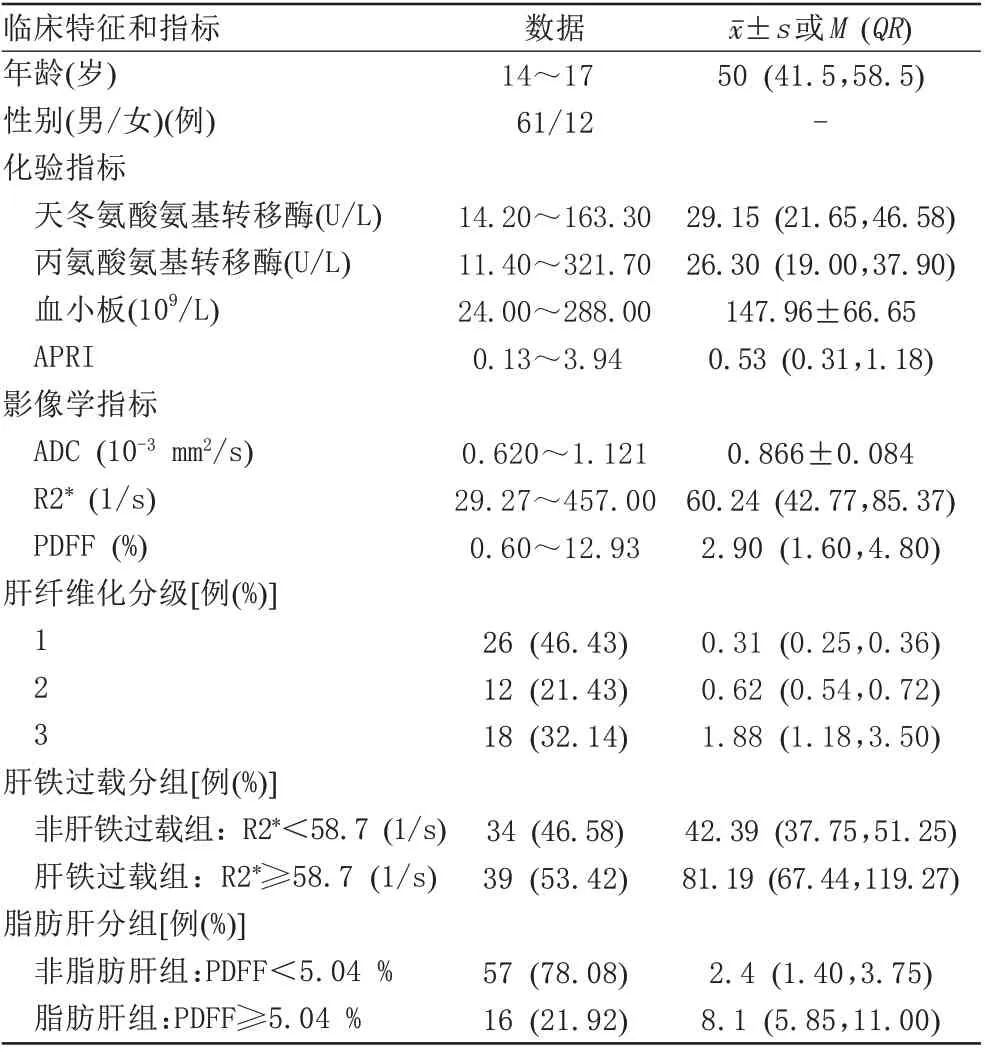
表1 73例纳入患者的特征Tab.1 Characteristics of the 73 included patients
2.2 ADC值的组间比较
对比非肝铁过载组,肝铁过载组的ADC值显著降低[(0.893±0.054)×10-3mm2/s 与(0.842±0.098)×10-3mm2/s,t=-2.807,P=0.007];组间年龄、性别、AST、ALT、PLT 及APRI 的差异均无统计学意义(P>0.05)。对比非脂肪肝组,脂肪肝组的ADC 值也显著降低[(0.878±0.083)×10-3mm2/s与(0.820±0.074)×10-3mm2/s,t=-2.522,P=0.014] (图1);组间年龄、性别、AST、ALT、PLT 及APRI 的差异均无统计学意义(P>0.05)。图2显示肝铁过载或(和)脂肪肝患者的ADC值降低。
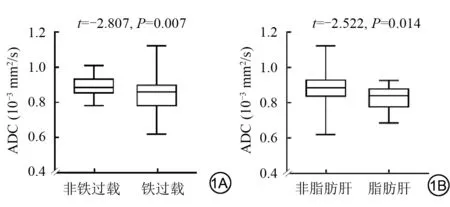
图1 肝铁过载组与非肝铁过载组(A)、脂肪肝组与非脂肪肝组(B)的组间ADC值比较箱式图Fig. 1 Boxplot of comparison of ADC values between liver iron overload group and non-liver iron overload group (A), fatty liver group and non-fatty liver group(B).
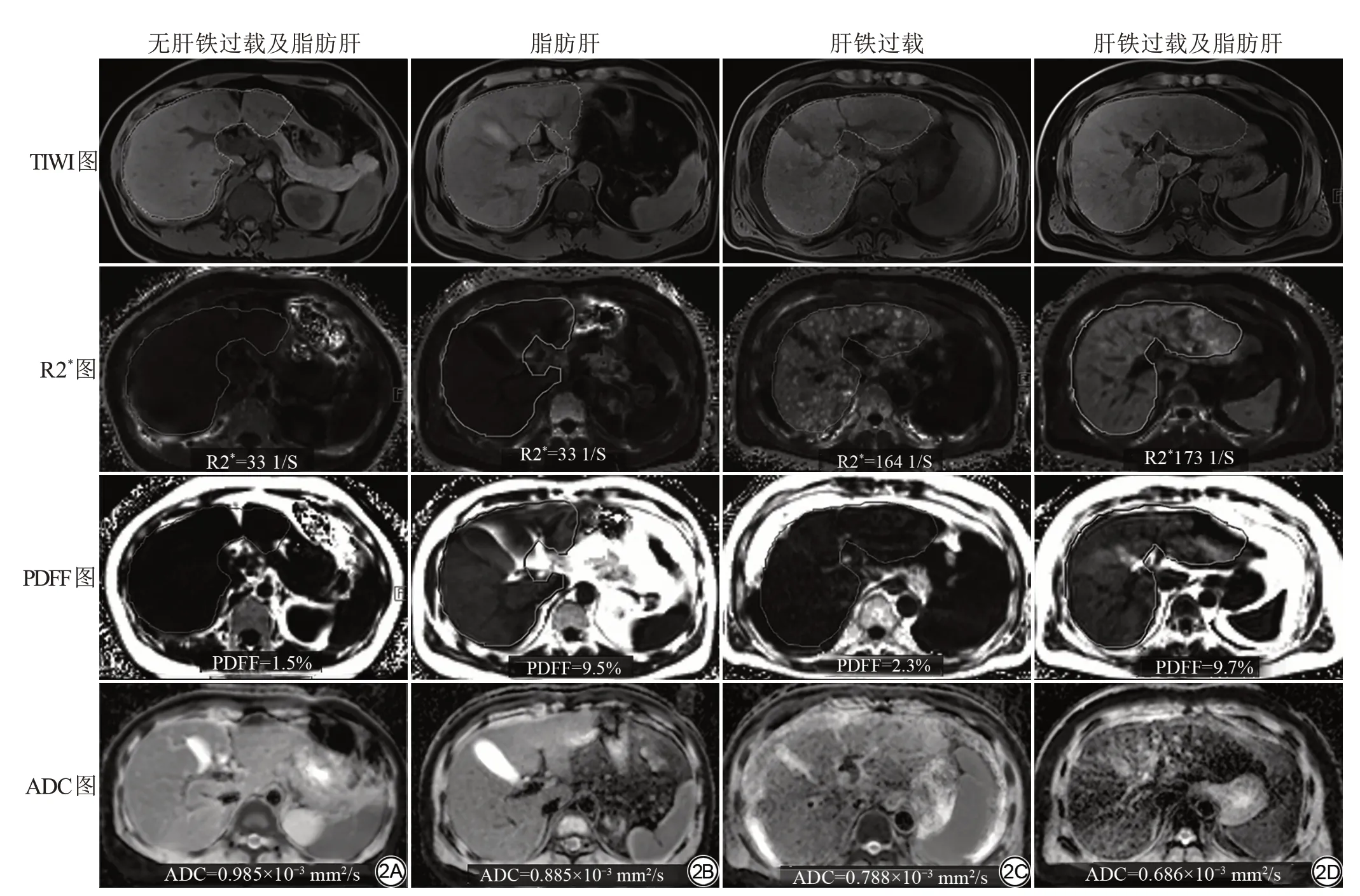
图2 有无肝铁、脂肪沉积的患者ADC图的信号对比。对比无肝铁过载及脂肪肝的患者(A),脂肪肝(B)、肝铁过载(C)和肝铁过载及脂肪肝(D)的患者ADC图的信号不同程度降低Fig.2 Comparison of ADC map signals in patients with or without hepatic iron and fat deposits.Compared to patients without hepatic iron overload and fatty liver(A),patients with fatty liver(B),hepatic iron overload(C),and hepatic iron overload and fatty liver(D)have differentially reduced signals in ADC maps.
2.3 ADC值与R2*、PDFF的相关性分析
Spearman相关分析示,ADC值与R2*值、PDFF呈负相关(r=-0.457,P<0.01;r=-0.298,P=0.01)(图3),与年龄、性别无相关性(P>0.05)。多元线性回归分析示,R2*及PDFF 是ADC 值的独立影响因素(R2*:标准化回归系数=-0.307,t=-2.666,P=0.010;PDFF:标准化回归系数=-0.382,t=-3.331,P=0.002);且容差≥0.1,方差膨胀因子≤5,无共线性。
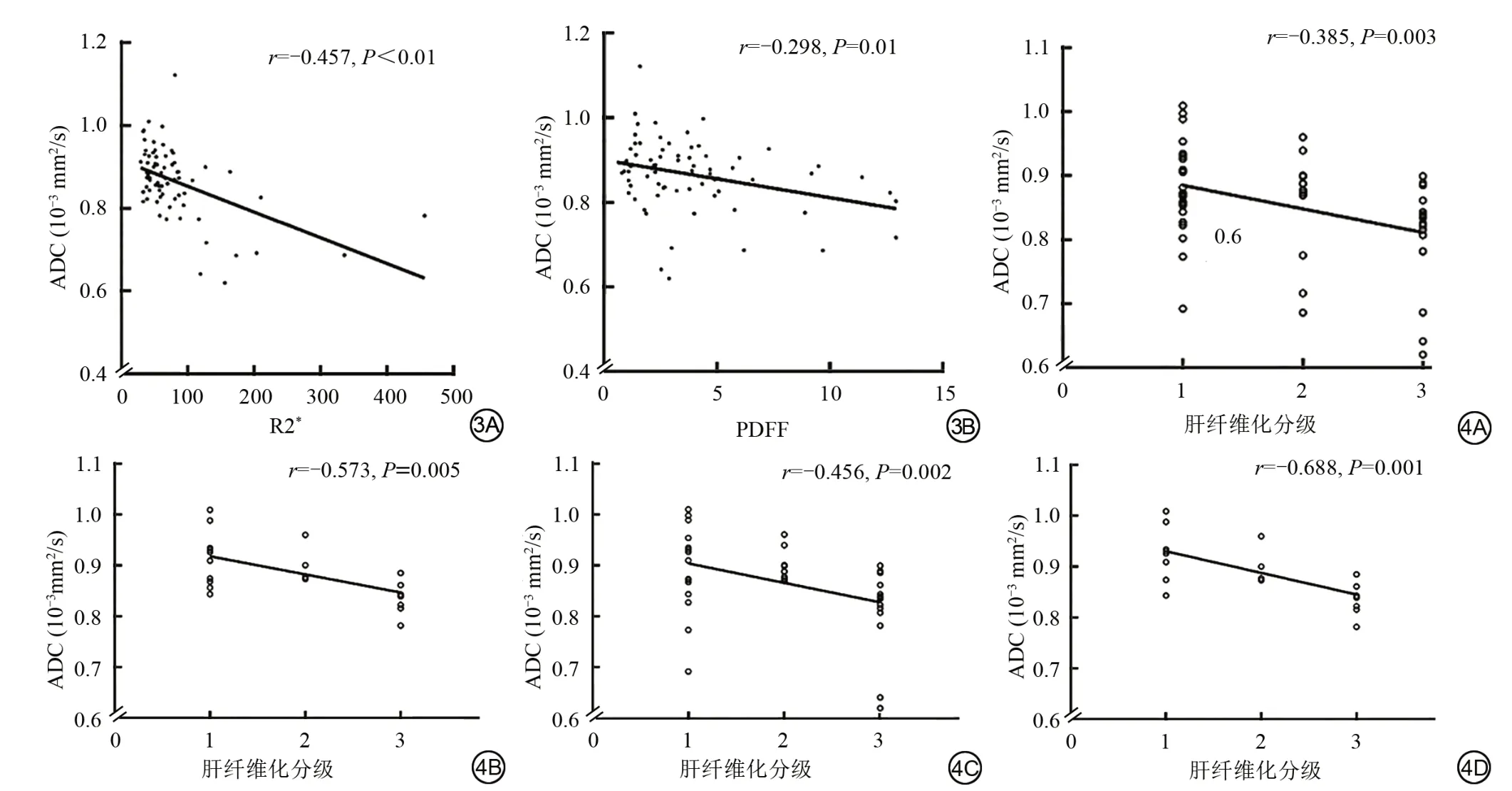
图3 ADC值与R2*值、PDFF值的相关性分析。ADC值与R2*值(r=-0.457,P<0.01)(A)及PDFF值(r=-0.298,P=0.01)(B)呈负相关。图4 ADC与肝纤维化分级的相关性分析。在所有纳入的患者中,ADC 值与肝纤维化分级呈弱的负相关(A);剔除肝铁过载(B)、脂肪肝(C)、肝铁过载和脂肪肝(D)的患者后,ADC值与肝纤维化分级的相关性明显提高Fig. 3 Correlation between ADC values and R2*, PDFF.ADC values were negatively correlated with R2* (r= -0.457, P<0.01) (A) and PDFF (r=-0.298, P=0.01) (B). Fig. 4 Correlation between ADC values and liver fibrosis grade. In all included patients, ADC values show a weak negative correlation with liver fibrosis grade(A).After excluding patients with liver iron overload(B),fatty liver(C),liver iron overload and fatty liver(D),the correlation between ADC values and liver fibrosis grade was significantly improved.
2.4 ADC值与肝纤维化分级的相关性分析
ADC 值与肝纤维化分级呈负相关(r=-0.385,P=0.003),肝纤维化分级也是ADC 值的独立影响因素(标准化回归系数=-0.412,t=-3.510,P=0.001)。剔除肝铁过载或(和)脂肪肝患者后,ADC 值与肝纤维化分级的相关性明显提高:剔除肝铁过载患者后的相关系数r=-0.573,P=0.005,剔除脂肪肝患者后的相关系数r=-0.456,P=0.002,剔除肝铁过载和脂肪肝患者后的相关系数r=-0.688,P=0.001 (图4)。
3 讨论
DWI 是一种通过检测活体组织内水分子扩散运动的成像技术。既往结果表明DWI 在诊断肝纤维化中具有一定的临床价值,但其诊断阈值及AUC差异较大[5-20]。有研究提出,慢性肝病患者的肝铁过载和脂肪肝影响ADC值的测量[6-7],可能是这些差异的原因之一,但存在争议[21]。因此,笔者尝试探讨慢性乙型肝炎患者的肝铁过载和脂肪肝是否影响ADC值测量,并影响ADC值诊断肝纤维化。
3.1 肝铁过载降低肝脏ADC值
本研究中,肝铁过载组患者的肝脏ADC值显著降低;R2*值与ADC 值呈负相关,且是ADC 值的独立影响因素。提示肝铁过载会导致ADC值降低,这与既往研究一致[22-23]。肝铁过载常见于遗传性血色病或反复输血的患者,然而研究发现病毒性肝炎、酒精性肝炎、非酒精性肝炎等慢性肝病患者也常合并肝铁过载[24]。病毒性肝炎患者肝铁过载的机制尚不明确,可能是机体正常防御及肝铁稳态失调的综合结果[24]。肝炎病毒感染的机体防御中,肝细胞通过与铁螯合来限制病原体的进入、抑制其扩散,会导致肝铁增多。病毒诱导的氧化应激导致铁调素的减少,可引起肝铁稳态失调。Chandarana 等[22]对不同铁浓度的体模进行研究,发现ADC 值随着铁浓度升高而降低;而且肝铁过载患者的ADC值显著降低,病理诊断的肝铁过载分级与ADC 值呈负相关。可能原因如下:首先,铁以铁蛋白和含铁血黄素的形式存在肝脏[24],两者均会缩短T2弛豫时间,降低T2*,导致肝脏DWI信噪比降低[22]。该研究证实,肝硬化患者的DWI 图像信噪比随肝铁含量的升高而降低,且在高b 值的DWI 更显著[22]。其次,铁诱导的磁场不均匀可导致ADC 值降低[25]。然而,一些研究显示肝铁过载分级与ADC 值的相关性无统计学意义[21],可能因为该研究中肝铁过载的患者较少(20.5%,18/88)且以轻度为主(66.7%,12/18);另外,采用肝穿刺活检评估肝铁过载,可能因取样误差对结果造成影响。因为肝穿刺活检的位置很难与ADC 测量ROI 的位置吻合,而肝铁沉积在肝内常呈不均匀分布[26]。因此,本研究采用多回波Dixon序列检测R2*及PDFF 分别评估肝铁过载和脂肪肝,确保其测量ROI 与ADC 的ROI 基本一致,并分布于全肝各段。通过全肝各段划取ROI的测量方法,再次验证了肝铁过载可导致ADC值降低。
3.2 脂肪肝降低肝脏ADC值
本研究中,脂肪肝组的肝脏ADC 值显著降低,PDFF 与ADC 值负相关,提示脂肪肝可导致肝脏ADC 值降低,这与既往的大部分研究结果一致[6-7,27]。早期研究发现,在非酒精性脂肪性肝病患者中,脂肪肝的肝脏ADC 值显著降低[27]。随后,Leitao 等[7]对多种病因的慢性肝病患者进行研究,也发现肝活检诊断的脂肪肝分级与ADC值中度负相关。由于肝铁过载、脂肪肝和肝纤维化均是ADC值的影响因素,可能会相互干扰。Bulow 等[6]在剔除肝纤维化及铁过载的患者后,发现肝活检诊断的脂肪肝分级与ADC值仍呈负相关。由于既往研究大多采用肝活检评估脂肪分级,存在取样误差和主观性强的不足;本研究采用PDFF 定量评估脂肪肝,确保其测量ROI 与ADC 的基本一致,并分布于全肝各段。研究结果也验证了脂肪肝会降低肝脏ADC值。然而,Bonekamp等[21]认为肝脂肪变性不会影响ADC值,因为使用选择性水激发脉冲技术可抑制DWI图像的脂肪信号。但事实上,即使采用该技术在临床场强下也不能完全抑制脂肪信号。因为有2 个脂肪峰(5.3 ppm 的烯酸和4.2 ppm 的甘油)的频率与水峰(4.7 ppm)的频率非常接近,如果不同时抑制水峰,则无法彻底抑制这些脂肪峰。而这些残留脂肪信号会引起缓慢的脂质扩散和伪影,导致ADC测值降低[28]。此外采用其他脂肪抑制技术,也获得了类似的结果。本研究及Bulow等[6]扫描DWI时采用SPAIR技术、Leitao 等[7]采用SPIR (spectral presaturation with inversion recovery)技术进行脂肪抑制,结果显示脂肪肝组的ADC值也显著低于非脂肪组。此外,许多研究认为,肝脂肪变性会增加肝细胞的大小,减少细胞外间隙,导致水分子的扩散受限,从而降低ADC值[6,27]。
3.3 肝铁过载及脂肪肝影响ADC值评估肝纤维化
本研究结果表明,肝纤维化分级与ADC值呈负相关,这与大多数既往研究一致[4,29]。因为肝纤维化组织的胶原纤维、蛋白聚糖等细胞外基质沉积可能会限制水分子扩散,从而降低ADC值。Taouli等[29]研究发现,ADC 值随着肝纤维化分期升高而降低。Sandrasegaran 等[4]也发现肝纤维化分期与ADC 值呈中度负相关。随后研究深入探讨了ADC 值诊断肝纤维化的性能。研究结果表明,ADC 值诊断肝纤维化方面具有良好的性能,其中检测显著纤维化(≥F2)的诊断阈值范围为(1.03~1.32)×10-3mm2/s、AUC 范围为0.69~0.93,肝硬化(F4)的诊断阈值范围为(0.96~1.23)×10-3mm2/s、AUC 范 围 为0.79~0.92[4-5,20]。但是这些研究的诊断阈值及AUC差异很大,主要原因可能是DWI 成像技术的不一致[4]。近期研究认为,b 值较低的肝脏DWI 容易受灌注影响,为提高ADC 诊断肝纤维的效能,推荐b 值采用50、1000 s/mm2[5-6]。但b值较高会延长TE,降低图像信噪比。因此本研究采用4-Scan Trace、monopoplar等技术将TE降至46 ms,显著低于既往相同场强的研究[20],保证了图像质量。然而,即使在成像技术相似的研究中,肝纤维化患者的ADC 值也存在较大差异[5,29]。因此,除了成像技术因素外,可能还存在其他值得关注的影响因素,如肝铁过载和脂肪肝[23]。有趣的是,本研究剔除肝铁过载和脂肪肝患者后,肝纤维化分级与ADC值的相关系数明显提高(-0.385与-0.688),表明肝铁过载和脂肪肝影响ADC 值诊断肝纤维化。因此,应用ADC 值诊断肝纤维化时,要注意肝铁过载和脂肪肝的影响;校正肝铁过载和脂肪肝对ADC 值的影响,有可能提高ADC 值诊断肝纤维化的准确性。由于脂肪肝在慢乙肝肝纤维化早期的发生率更高[30],校正脂肪肝影响后,可能更有利于ADC值诊断早期肝纤维化。
3.4 本研究的不足
首先,本研究未进行肝活检评估肝纤维化。由于肝活检的具有有创性、取样误差和观察者的主观差异等缺点[15],临床应用受限。此外,本研究评估脂肪肝对慢乙肝患者肝脏ADC值的影响,而脂肪肝在肝纤维化早期发生率更高[30],这些患者对肝活检接受度较差。因此,本研究采用了WHO推荐的肝纤维化诊断的替代性标准[9]。其次,由于样本量有限,无法根据肝铁过载和脂肪肝分级进行亚组分析。随后研究应扩大样本量和进行多中心研究。
综上所述,肝铁过载和脂肪肝会导致肝脏ADC值降低,影响ADC值与肝纤维化分级的相关性。在慢性乙型肝炎患者中,应用ADC 值评估肝纤维化时,需注意肝铁过载和脂肪肝的影响。
作者利益冲突声明:全体作者均声明无利益冲突。
