超低位去大骨瓣术联合亚低温对重症颅脑损伤患者氧化应激反应及炎症指标的影响
2021-08-03杜卫东
杜卫东
(乌兰察布市中心医院神经外科,内蒙古 乌兰察布 012000)
重症颅脑损伤具有起病急、发展快等疾病特征,发病后会引发神经功能损伤。临床治疗以手术手段为主,以降低颅内压、改善患者脑缺血缺氧状态、减轻脑组织损伤为治疗目的[1,2]。基于此,本研究旨在探讨针对重症颅脑损伤患者实施超低位去大骨瓣术联合亚低温对其氧化应激及炎症指标的影响。现结果如下。
1 资料和方法
1.1 一般资料
本研究符合我院医学伦理委员会相关规定。回顾性分析我院2017-07~2019-07接受治疗的重症颅脑损伤患者147例临床资料,将单纯实施超低位去大骨瓣术49例患者设为超低组,将单纯实施常规骨瓣减压术的49例患者设为常规组,将接受超低位去大骨瓣术联合亚低温治疗49例患者设为联合组。超低组中男26例,女23例;年龄44~81岁,平均年龄(61.47±9.63)岁;创伤至手术时间1~4h,平均(2.51±0.93)h;格拉斯哥昏迷评分(GCS)5~8分,平均(6.49±1.05)分。常规组中男27例,女22例;年龄43~83岁,平均年龄(61.74±9.70)岁;创伤至手术时间1~4h,平均(2.59±0.91)h;GCS评分5~8分,平均(6.53±1.01)分。联合组中男25例,女24例;年龄42~83岁,平均年龄(61.69±9.73)岁;创伤至手术时间1~4h,平均(2.57±0.89)h;GCS评分5~8分,平均(6.51±0.98)分。三组一般资料对比(P>0.05),有可对比性。
1.2 入选标准
(1)纳入标准:①经CT确诊颅内存在器质性病变;②临床资料完整者;③患者病历资料阅览均获取家属同意;(2)排除标准:①伴随重症原发疾病;②以往存在脑损伤史;③合并严重肝、肾、心等脏器功能衰退。
1.3 方法[3]
(1)超低组实施超低位去大骨瓣术:做1cm切口于颧弓上耳屏前,且顺耳廓上缘往后移动直至顶结节,随后根据正中线往前直至前发际下,走向呈大问号形,并于对应头皮切口下形成骨窗,随后将额骨颧突至颞骨鳞部与蝶骨嵴外1/3水平处咬除,将颅骨骨窗扩大,最后往后使之靠近横窦,形成超低位大骨瓣;待硬膜悬吊后,硬膜呈放射状剪开,对积血减压并排出脑脊液,彻底对失活脑组织及硬膜下血肿清除,最后对硬膜脑进行减张缝合,同时将松解颞肌筋膜切开,将引流管置于皮下;术后常规抗感染及对症治疗;(2)常规组实施常规去骨瓣术:手术切口同超低组,去除骨瓣后,采用放射状将硬脑膜剪开,将坏死脑组织、脑内及硬膜下血肿清除,减张缝合硬脑膜。术后常规抗感染及对症治疗;(3)联合组实施超低位去大骨瓣术联合亚低温治疗:亚低温治疗:实施降温床降温治疗,同时予以患者50mg盐酸哌替啶(青海制药厂有限公司,国药准字H63020022)、25mg氯丙嗪(天津金耀药业有限公司,国药准字H12020618)、25mg异丙嗪(西南药业股份有限公司,国药准字H50020140),以上药物肌内注射,8h/次,使患者体温持续保持34℃~35℃,共干预7天;超低位去大骨瓣术同超低组,术后接受常规抗感染及对症治疗。
1.4 观察指标
(1)氧化应激反应:取静脉血4mL,应用比色法(湖南德荣生物医学工程有限公司,湘械注准20162400302)对患者术前、术后7天一氧化氮(NO)、丙二醛(MDA)、超氧化物歧化酶(SOD)进行检测;(2)炎症指标:取术后7天静脉血,应用酶联免疫吸附法(苏州和锐生物科技有限公司,24人份/盒)检测两组患者白介素-6(IL-6)、C反应蛋白(CRP)、肿瘤坏死因子(TNF-α)水平;(3)预后:治疗3个月后,应用格拉斯哥预后评分(GOS)评价患者预后,1级:死亡;2级:植物生存;3级:意识清晰,生活需借助外人照顾;4级:可独自生活,但工作需借助外人保护,属轻度残疾;5级:不恢复日常生活。以3~5级为恢复良好,1~2级为无效;统计患者恢复良好率。
1.5 统计学方法
数据采用SPSS 17.0统计学软件分析。计量资料采用均数±标准差表示,多组间比较采用单因素方差分析;计数资料用(n,%)表示,采用χ2检验。检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 氧化应激指标
三组术前NO、MDA、SOD指标对比,差异尚无统计学意义(P>0.05);术后,联合组NO、MDA、SOD指标最低,超低组次之,常规组最高,差异有统计学意义(P<0.05)(见表1)。
表1 手术前后的氧化应激指标比较(±s)
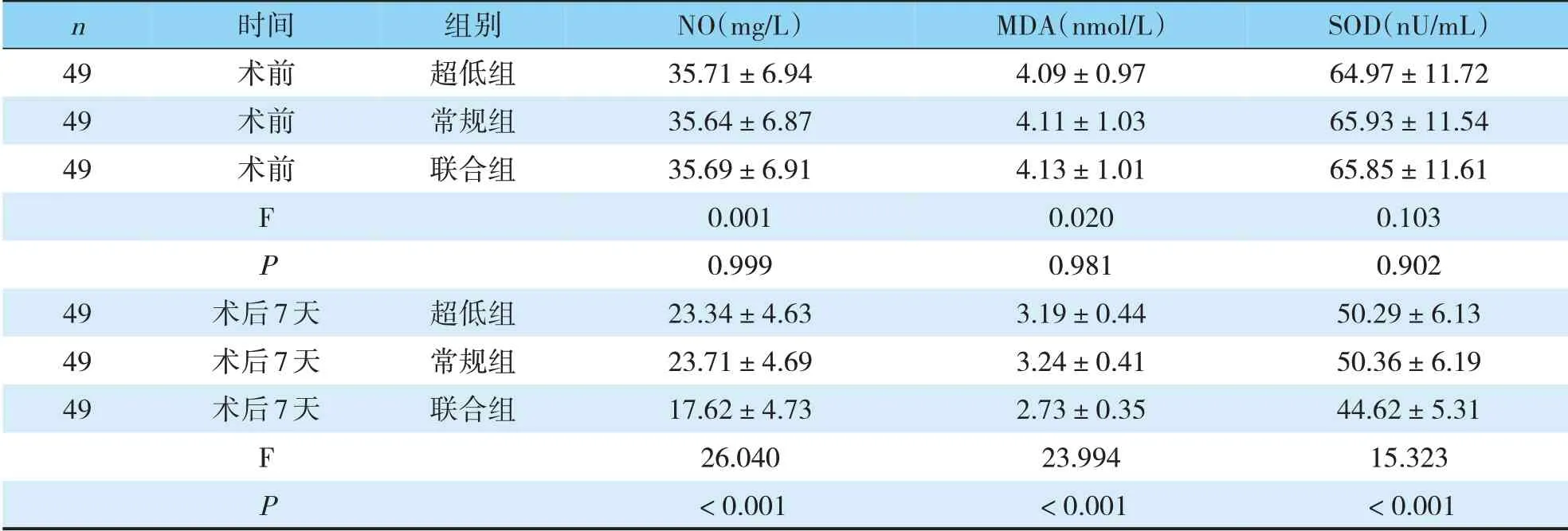
表1 手术前后的氧化应激指标比较(±s)
n 49 49 49时间术前术前术前组别超低组常规组联合组F P 49 49 49术后7天术后7天术后7天超低组常规组联合组F P NO(mg/L)35.71±6.94 35.64±6.87 35.69±6.91 0.001 0.999 23.34±4.63 23.71±4.69 17.62±4.73 26.040<0.001 MDA(nmol/L)4.09±0.97 4.11±1.03 4.13±1.01 0.020 0.981 3.19±0.44 3.24±0.41 2.73±0.35 23.994<0.001 SOD(nU/mL)64.97±11.72 65.93±11.54 65.85±11.61 0.103 0.902 50.29±6.13 50.36±6.19 44.62±5.31 15.323<0.001
2.2 炎症指标
三组术后IL-6、CRP、TNF-α炎症指标对比,联合组最低,超低组次之,常规组最高,三组间对比,差异有统计学意义(P<0.05)(见表2)。
表2 手术后炎症水平比较(±s)
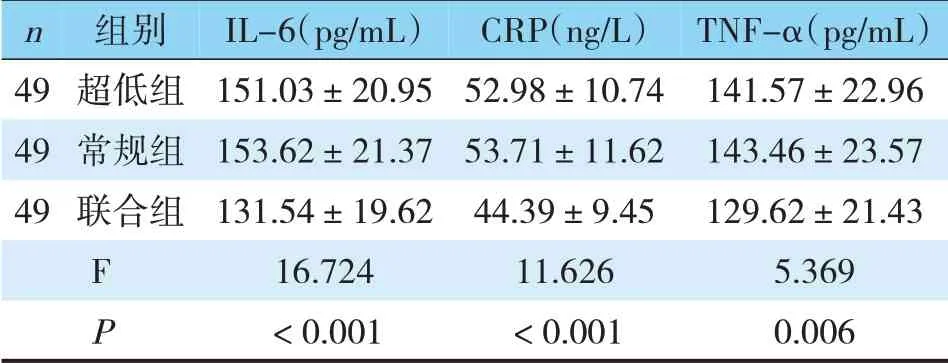
表2 手术后炎症水平比较(±s)
n 49 49 49组别超低组常规组联合组IL-6(pg/mL)151.03±20.95 153.62±21.37 131.54±19.62 16.724<0.001 F P CRP(ng/L)52.98±10.74 53.71±11.62 44.39±9.45 11.626<0.001 TNF-α(pg/mL)141.57±22.96 143.46±23.57 129.62±21.43 5.369 0.006
2.3 预后
三组预后对比,联合组预后良好率最高,超低组次之,常规组最低,三组间对比,差异尚无统计学意义(P>0.05)(见表3)。
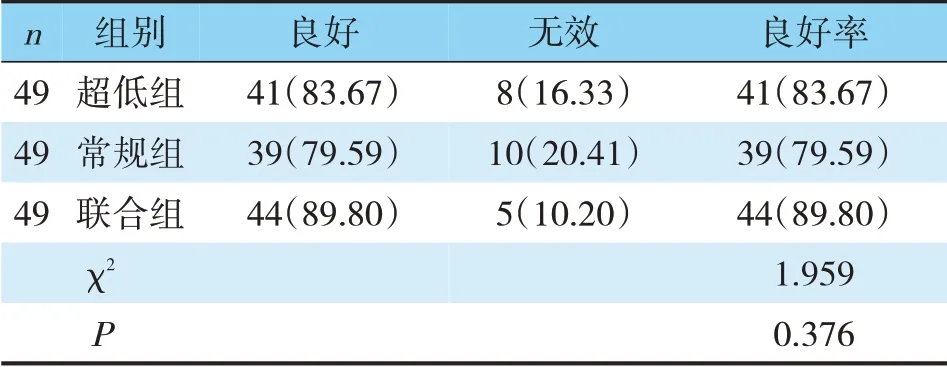
表3 手术后预后比较
3 讨论
重症颅脑损伤是由于患者遭受外界直接或间接暴力损伤,伴随病理、生理改变,使机体炎症反应亢进,诱发颅内高压、缺血缺氧等多种损伤,对患者生命安全带来严重威胁。且重症颅脑损伤发病后,会引起血管内皮因子过度释放,出现神经细胞毒性作用,使微血管炎性反应增高,且NO的升高,会促使血管炎症加重,进而强化氧化应激,造成脑组织损伤增加[4]。
在本次研究中,三组患者应用不同治疗手段,结果显示,联合组NO、MDA、SOD指标最低,超低组次之,常规组最高;三组术后IL-6、CRP、TNF-α炎症指标对比,联合组最低,超低组次之,常规组最高。提示超低位去大骨瓣术联合亚低温治疗更有助于减轻重症颅脑损伤患者应激反应,炎症改善程度更为明显。分析其原因在于,超低位去大骨瓣术较常规大骨瓣术暴露术野更广,能够拓宽颞低位减压骨窗空间,使术中能够更彻底对坏死脑组织进行清除,促使患者脑部组织往减压骨窗膨出,使脑疝恢复,进而缓解患者颅内压,促使脑血流量得到改善;且术中将患者中颅窝底暴露后,有助于解除脑干受压状态,加速改进患者脑脊液循环状况。而亚低温治疗属于该疾病辅助治疗常见方式,经药物、物理等手段促使脑水肿减轻、颅内压降低,使颅脑损伤得以改善,已被多项研究证明其能够对脑起到保护作用,可对机体自由基起到抑制作用。同时能够使脑代谢降低,促使患者脑组织氧化反应减轻,使脑组织氧耗降低,减少氧化应激带来的损伤,对脑起到保护作用[5]。另外,亚低温治疗能够持续对内源性炎症因子释放起到抑制作用,可保护神经元与血脑屏障,进而缓解脑组织损伤[6]。此外,本研究结果还显示,治疗3个月后,联合组预后良好率最高,超低组次之,常规组最低,但三组预后良好率对比未见明显差异。这可能与本次研究观察时间较短、样本量少有一定关系,未来仍需要临床开展大样本、长时间研究加以证实。
综上所述,针对重症颅脑损伤患者实施超低位去大骨瓣术联合亚低温治疗,能够有效降低氧化应激反应,减少炎症因子表达。
