180例重症药疹患者的回顾性分析
2021-08-02罗霞林新瑜
罗霞,林新瑜
(西南医科大学附属医院,四川 泸州 646000)
药疹指药物通过口服、吸入、注射、栓剂、灌注及外用药物吸收等各种途径进入人体引起的皮肤黏膜反应[1]。重症药疹主要包括剥脱性皮炎型(ED)、大疱性表皮坏死松解型(TEN)、重症多形红斑型(SJS)以及药物超敏反应综合征(DIHS)[2],临床表现复杂,病情进展快,常因严重并发症危及患者生命,临床治疗颇为棘手[3]。本文回顾性分析180例住院重症药疹患者的病历资料,为临床合理及安全用药提供进一步的参考。
1 资料与方法
1.1 一般资料 男110例(61.11%),女70例(38.89%),男女比例为 1.57∶1;年龄 4~82 岁,平均(51.6±18.2)岁。各年龄段重症药疹患者的分布情况见表1。各型重症药疹患者的基线资料比较,差异无统计学意义(P>0.05),见表 2。

表1 不同年龄段重症药疹患者的分布及构成比例(%)

表2 各型重症药疹患者的基线资料 例(%)
1.2 研究对象 2014年1月—2018年12月期间在我院皮肤科住院的180例重症药疹患者的病例资料。
1.3 纳入标准 参照赵辨主编的《临床皮肤病学》[4]第3版以及张学军主编的第8版《皮肤性病学》[5]制定的药疹诊断标准;按照Naranjo评分标准评判[6],选择评分≥5分的病例;诊断DIHS时,参考欧洲重症药物不良反应登记(RegiSCAR)标准[7]。
1.4 排除标准 病史中未明确详细用药名称及用药时间者;不能根据皮疹描述及临床表现判断药疹分型者;电话随访再次用可疑药物无反应者;不能完全排除其他原因导致疾病者。
1.5 疗效标准 痊愈:皮损完全消退,可遗留色素沉着,全身和局部自觉症状消失,重要实验室检查指标均恢复正常。好转:原有皮损减轻,无新发皮疹,全身和局部自觉症状好转,重要实验室指标基本正常。死亡:生命体征消失。总有效率=(痊愈例数+好转例数)/总病例数×100%。
1.6 统计学分析 采用21.0版SPSS统计学软件统计分析。计数资料以例数(n)和百分比(%)表示,计量资料经正态性检验,以均数±标准差(±s)表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 致敏药物分析 抗生素类药物致敏51例,多见于头孢类药物(32例)、磺胺类药物(15例);解热镇痛药致敏28例,多见于对乙酰氨基酚(16例);镇静抗癫痫药致敏39例,多见于卡马西平(17例)、苯巴比妥(14例);抗痛风药致敏34例,多见于别嘌呤醇(22例);降压药致敏8例;血液制剂致敏5例;中药制剂致敏6例;其他药物或致敏药物不明有9例。见表3。
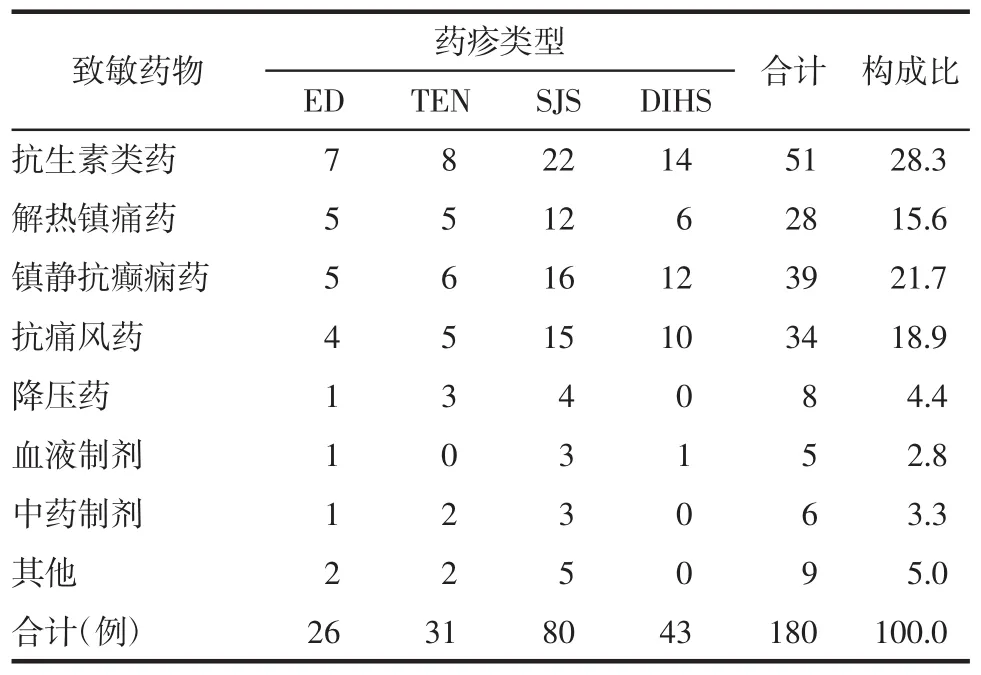
表3 各型重症药疹患者的致敏药物分析 例(%)
2.2 临床症状和实验室检查结果 出现发热106例,皮肤黏膜损害113例,浅表淋巴结肿大41例。伴随白细胞异常67例、低蛋白血症98例、肝功能异常84例、肾功能异常35例、电解质紊乱73例。见表4。
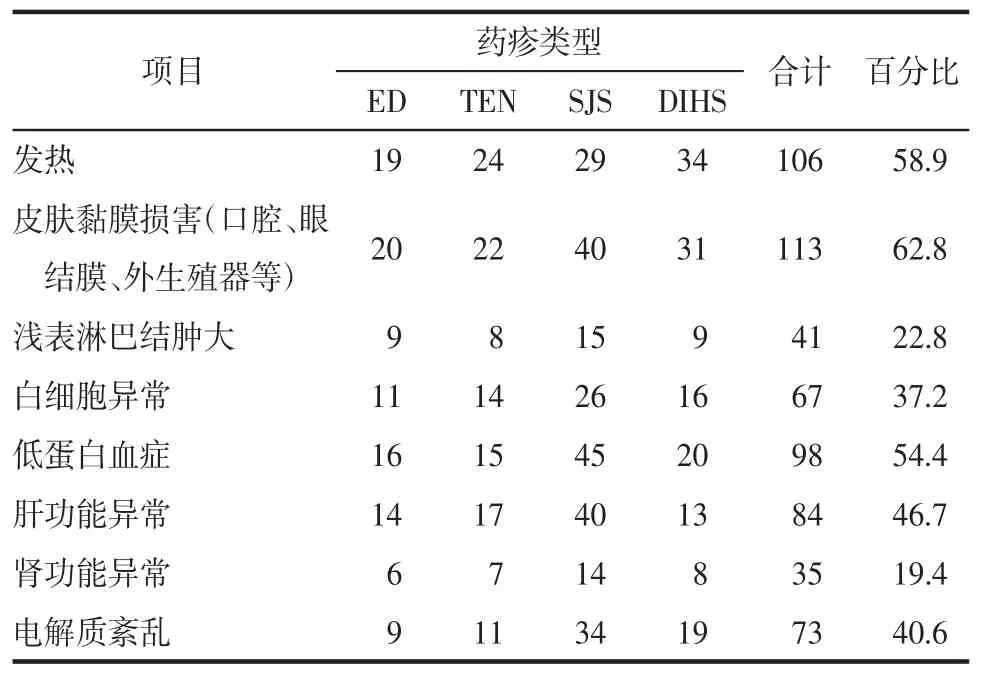
表4 各型重症药疹患者的特殊临床表现和异常实验室检查情况 例(%)
2.3 潜伏期、住院时间、皮疹控制时间、最大激素控制剂量维持时间所有重症药疹患者的潜伏期为(14.2±5.1)d,其中 ED 患者的潜伏期(24.5±6.9)d,显著大于其他3型(P<0.05)。4型重症药疹患者的平均住院时间差异无统计学意义(P>0.05)。DIHS患者的皮疹控制时间和最大激素控制剂量维持时间分别为(7.6±2.9)d 和(7.2±2.2)d,明显小于其他 3型(P<0.05)。见表5。
表5 各型重症药疹患者的临床资料 (d,±s)

表5 各型重症药疹患者的临床资料 (d,±s)
注:激素剂量换算为泼尼松剂量;*表示与其他3组比较,P<0.05。
最大激素控制剂量维持时间ED 24.5±6.9* 16.7±7.9 11.3±3.9 12.6±4.2 TEN 10.6±4.5 16.6±6.6 9.2±3.7 12.1±3.9 SJS 9.4±3.9 15.8±5.2 10.1±4.3 11.5±4.4 DIHS 10.1±3.9 14.8±6.8 7.6±2.9* 7.2±2.2*F 11.492 3.614 7.926 8.451 P <0.001 0.257 0.014 0.007药疹类型 潜伏期 平均住院时间皮疹控制时间
2.4 糖皮质激素用量 SJS患者的激素初始剂量和出院维持剂分别为(50.4±14.5)mg/d 和(40.9±12.4)mg/d,明显大于其他 3型(P<0.05)。ED 患者的最大激素控制剂量为(72.2±20.7)mg/d,明显小于其他3型(P<0.05)。见表6。
表6 各型重症药疹患者的激素用量 (mg/d,±s)

表6 各型重症药疹患者的激素用量 (mg/d,±s)
注:激素剂量换算为泼尼松剂量;*表示与其他3组比较,P<0.05。
药疹类型 激素初始剂量 最大激素控制剂量 出院维持剂量ED 44.7±13.9 72.2±20.7* 37.3±14.3 TEN 43.8±13.1 84.5±20.1 37.1±16.1 SJS 50.4±14.5* 80.5±19.6 40.9±12.4*DIHS 44.5±12.7 83.3±19.2 37.9±13.6 F 7.065 6.132 6.495 P 0.019 0.027 0.023
2.5 治疗及转归 所有患者入院后均立即停用可疑致敏药物,165例患者给予常规剂量甲泼尼龙治疗,15例给予常规剂量地塞米松治疗。42例患者症状控制不佳,改用大剂量甲泼尼龙静脉治疗,25例患者联合运用人血丙种球蛋白静脉注射治疗。180例患者中,痊愈125例,好转47例,死亡8例,总有效率为95.6%。
3 讨论
重症药疹可发生于各个年龄段,本研究中纳入的180例患者年龄跨度从4~82岁,其中以40~59岁年龄段例数最多,占36.1%,而18岁以下年龄段例数最少,占13.3%,与既往文献报道相符合[8]。
重症药疹患者常常以发热、皮肤黏膜损害和内脏受累三联征为主要表现[9],而内脏受累常常累及肝和肾。研究报道,超过一半的重症药疹患者存在肝功能异常,表现为转氨酶升高及白蛋白水平降低;更有甚者发生严重的黄疸性肝炎和内环境紊乱[10]。对于大多数重症药疹患者,在出现发热的同时,会伴有咽炎和颈部淋巴结增大。在反应初期,可能会发生非特异性淋巴细胞增多和嗜酸性粒细胞增多。皮疹的严重程度也因人而异,从散在发疹到严重爆发,例如剥脱性皮炎,部分患者甚至出现结膜炎和面部血管性水肿[11],如抗惊厥药物诱发的重症药疹患者会出现面部浮肿。中枢神经系统(无菌性脑膜炎)或呼吸系统(间质性肺炎、呼吸窘迫综合征等)的发生率则较少见[12]。
致敏药物分析结果显示,引起本研究中患者药疹发生的药物依次为抗生素类(28.3%)、镇静抗癫痫药(21.7%)、抗痛风药(18.9%)、解热镇痛药(15.6%)以及降压药等其他药物。各种药物引起重症药疹的机制不尽相同,例如抗生素类易致敏药物以头孢类药物和磺胺类药物居多,其中磺胺类药物的主要代谢途径是通过乙酰化过程生成无毒代谢物,然后经肾脏排泄。乙酰化酶也有可能促进羟胺生成,从而产生细胞毒性。大多数人能解毒这些物质,而对于无法解毒(如谷胱甘肽缺乏)的患者,就可能会出现DIHS[13]。其他芳香胺类药物,如普鲁卡因酰胺、氨苯砜,会与磺胺类药物产生交叉反应[14]。苯妥英钠、卡马西平和苯巴比妥等抗惊厥药物会被细胞色素P-450酶代谢,生成各种代谢物,这些有毒代谢产物通常会在环氧羟化酶作用下解毒,一旦解毒过程出现障碍,累积的代谢产物就会充当半抗原并启动免疫反应,通过直接或间接凋亡途径导致细胞坏死,诱发DIHS。最常用的抗痛风药——别嘌醇引起的药疹反应与汉族人的遗传易感性密切相关,HLA-B*5801等位基因在其中发挥重要作用。最近的研究表明,人类疱疹病毒(HHV)-6感染,无论是初次感染还是再次感染,与DIHS之间存在关联,抗惊厥药和别嘌呤醇诱发的药疹反应均与潜在的HHV-6感染重新激活密切相关。一项回顾性研究发现别嘌醇诱发的重症药疹患者的血液中HHV-6 DNA呈阳性,同样在脑脊髓液中也检测到HHV-6 DNA。
对于重症药疹的治疗,糖皮质激素是首选治疗药物,但全身性皮质类固醇治疗的作用尚存在争议。一些学者认为,皮质类固醇可能在疾病早期和相对较高剂量时有益,但其不会缩短恢复时间,并且可能增加并发症的风险,如继发感染和消化道出血等[15-16]。尽管如此,大多数临床医生仍然会选择以1~2 mg/(kg·d)的常规剂量开始泼尼松治疗。本研究中,运用甲泼尼龙或等效地塞米松静脉给药,甲泼尼龙起始剂量为0.8~2 mg/(kg·d),若常规剂量糖皮质激素不能控制,则予以大剂量糖皮质激素冲击治疗,最高剂量为甲泼尼龙300~500 mg/d,连用2~3 d,然后逐渐减量至常规剂量,直到皮损完全控制后再逐渐减量。病情较重患者联合应用人血丙种球蛋白静脉注射治疗,剂量为400 mg/(kg·d),连用3~5 d。有研究分析静脉注射免疫球蛋白剂量大于200 mg/(kg·d)时,ED和TEN患者中毒性表皮坏死溶解相关的死亡率会显著降低[17]。其余治疗以保肝、抗感染、纠正纠正内环境紊乱和酸碱失衡等对症支持治疗为主,并加强皮肤黏膜护理,促进创面修复。本研究中患者的有效率为95.6%,也低于其他学者的报道[18]。
综上,重症药疹是一种严重的药物不良反应,任何年龄患者都会发生,抗生素类药、镇静抗癫痫药、抗痛风药等是常见致敏药物。重症药疹在治疗上需及时足量使用糖皮质激素,视病情联合免疫球蛋白治疗,同时积极治疗并发症和加强皮肤黏膜护理是治疗成功的关键。
