高镉地质背景区设施菜地土壤镉生物有效性主控因子分析
2021-08-02柴冠群杨娇娇刘桂华罗沐欣键范成五
柴冠群,杨娇娇,刘桂华,罗沐欣键,范成五,秦 松①
(1.贵州省农业科学院土壤肥料研究所,贵州 贵阳 550006;2.贵州大学农学院,贵州 贵阳 550025)
设施大棚可以延长蔬菜生产时间,增加淡季蔬菜品种和产量[1],帮助群众脱贫攻坚。贵州作为全国脱贫攻坚主战场,近年大力发展设施蔬菜,截至2016年,贵州设施蔬菜面积约为1.7万hm2,约为2006年的10倍,而且面积仍在继续扩大[2]。随着设施蔬菜产业的蓬勃发展,高投入、高产出、高集约化的栽培模式会导致土壤与蔬菜重金属累积,其中以镉(Cd)超标最为严重[3],直接关系“菜篮子”安全,增加人体患病及致癌风险[4]。因此,防控设施蔬菜Cd污染,提高蔬菜安全品质,已成为改善民生、优化蔬菜生产格局的重要一环,受到政府和民众的广泛关注[5]。
土壤是蔬菜安全生产的物质基础,也是人类赖以生存的最基本和最重要的自然资源。贵州是我国典型的高Cd地球化学异常区[6],其耕层土壤Cd含量的算术平均值为0.659 mg·kg-1,远高于全国土壤Cd含量算术平均值(0.097 mg·kg-1)[7],研究区位于贵州省织金县,是典型富Cd碳酸盐岩区域[8]。影响土壤Cd生物有效性的因素很多,例如土壤pH、Eh、CEC、有机质、黏粒含量、速效磷等[5,9]。小气候特征及高复种指数等人为活动导致设施大棚土壤理化性质与露天土壤存在差异[10]。目前对设施菜地Cd的研究多是关于土壤Cd累积特征及不同蔬菜吸收Cd的差异性等方面[1,3,10],而对设施菜地Cd生物有效性影响因素研究相对较少,尤其是高Cd地质背景叠加农业活动区域的相关研究更少。
多元统计分析是辨识土壤重金属自然源和人为源的经典统计方法[11],土壤剖面重金属垂直分布也能指示重金属的可能起源[12],单独应用多元统计法或剖面分异法不足以有效区分土壤重金属来源,同时应用两种方法能更好地区分土壤重金属来源。因此,笔者采用剖面分异法与多元统计分析方法分析设施菜地土壤Cd累积成因,并运用路径分析模型分析设施菜地土壤Cd生物有效性的影响因素,为进一步在高镉地质背景区发展设施栽培和开展蔬菜Cd污染防治工作提供参考依据。
1 材料与方法
1.1 样品采集与处理
样品采集。于2019年在织金县某设施蔬菜基地采集设施大棚菜地土壤和蔬菜样品,分别采集设施大棚菜地0~20 cm(耕作层)和>20~40 cm(心土层)土壤样各20个,对应蔬菜样品20个(番茄8个,白菜6个,豇豆6个)。采样时,划定10 m×10 m采样区,用不锈钢土钻分别在4个顶点和中心处按0~20 cm和>20~40 cm土层采集土样,分别将不同层次土样混合均匀,用四分法保留1 kg土样作为代表该点不同层次的土壤样品,在中心处定位经纬度,记为该点的经纬度,同时对应采集各点果实,5点混合为1个样品。
样品处理。所有蔬菜样品经保鲜箱带回室内,用自来水冲洗3遍,用去离子水冲洗3遍,再用滤纸吸干水分,用粉碎机打成匀浆,冷藏备用。土壤样品在室内风干后,用四分法取一定量土壤样品研磨,过0.15 mm孔径尼龙筛,密封干燥保存。
1.2 土壤养分指标与重金属检测方法
土壤养分指标检测。pH采用电位法,有机质采用重铬酸钾外加热法,碱解氮采用碱解扩散法,有效磷采用Olsen法,速效钾采用NH4OAc浸提-火焰光度法测定[13]。
蔬菜与土壤重金属检测。蔬菜样品采用稀HNO3消解,用稀HCl定容;土壤样品采用HNO3-HClO4-HF-HCl消解,用稀HCl定容;土壤有效Cd用DTPA溶液浸提,采用电感耦合等离子体质谱仪测定。所有试验用品均经稀酸浸泡,减少器皿对重金属的吸附,试验用水均为去离子超纯水。同时检测3个空白样品和标准物质(GBW07403和GBW10014)控制试验准确度。
1.3 蔬菜Cd富集系数及安全性评价
1.3.1蔬菜Cd富集系数
生物富集系数(BCF,Fb,c)计算公式为
Fb,c=C蔬菜/C土壤×100%。
(1)
式(1)中,C蔬菜为蔬菜可食部位Cd含量,mg·kg-1;C土壤为土壤中Cd含量,mg·kg-1。
1.3.2蔬菜Cd安全性评价
采用单因子指数法进行评价,计算公式为
Pi=Ci/Li。
(2)
式(2)中,Pi为蔬菜i中重金属Cd的单因子超标指数;Li为蔬菜i中重金属Cd的食品安全国家标准限量值(GB 2762—2017)[14],番茄、白菜和豇豆Cd限量标准分别为0.05、0.2和0.1 mg·kg-1;Ci为农产品i中重金属Cd含量测定值(单位与Li保持一致)。根据Pi值大小,将蔬菜超标情况分为3级:Pi≤1.0,Ⅰ级(未超标);1.0
1.4 数据统计分析与制图
数据处理、分析和制图采用软件SPSS 20.0、AMOS 24.0和Sigmaplot 12.5。
2 结果与讨论
2.1 设施大棚土壤理化性质
用Kolmogorov-Smirnov检验方法对设施大棚耕作层和心土层各理化指标进行正态分布检验[15],渐进显著性(双侧)P值均大于显著水平(α=0.01),说明设施大棚耕作层和心土层各理化指标服从正态分布。设施大棚耕作层和心土层土壤理化性质统计结果见表1,由独立样本t检验可知,耕作层土壤有效Cd含量、碱解氮含量和有效磷含量显著大于心土层(P<0.05),耕作层土壤有效Cd平均含量较心土层增加0.036 mg·kg-1;耕作层土壤pH显著低于心土层(P<0.05),耕作层土壤pH较心土层降低0.389;耕作层土壤全Cd含量、有机质含量、速效钾含量与心土层差异不显著(P>0.05),与GB 15618—2018《土壤环境质量 农用地土壤污染风险管控标准》中土壤Cd筛选值相比[16],耕作层土壤全Cd平均含量超标264.67%,点位超标率为85.71%。与贵州省耕作层土壤背景值(0.659 mg·kg-1)相比[7],耕作层土壤全Cd平均含量超出贵州省耕作层土壤背景值的66.01%,大于贵州省耕作层土壤Cd背景值的点位占比为75.32%。
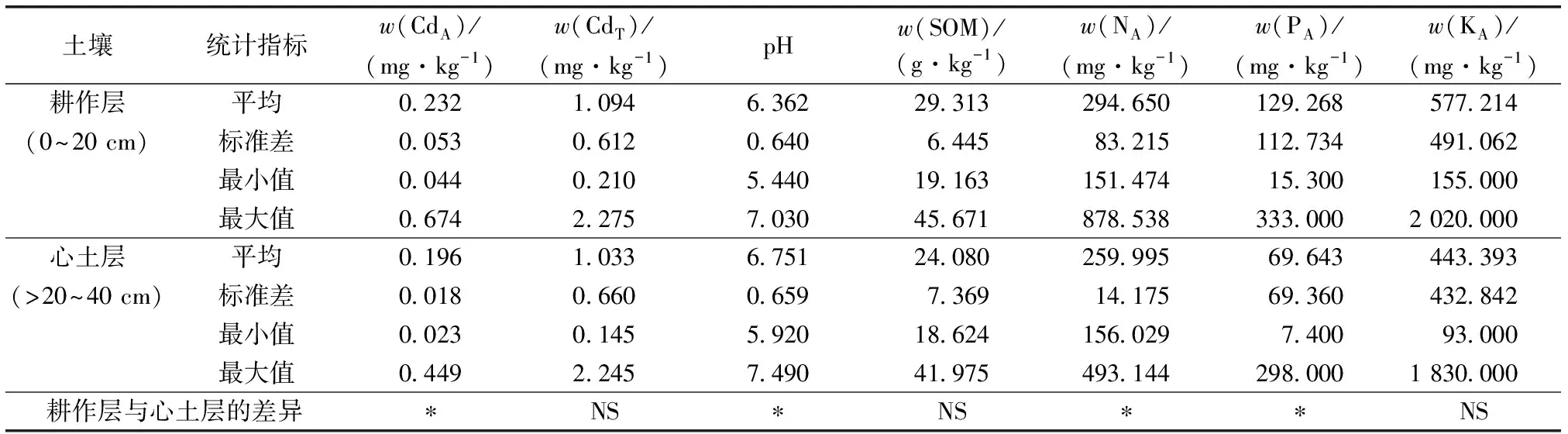
表1 设施大棚耕作层和心土层土壤检测指标统计结果
2.2 设施大棚蔬菜Cd含量
有研究表明,不同类型蔬菜对Cd的吸收累积特征不同,蔬菜对Cd的累积规律普遍表现为叶菜类>根茎类>茄果类(豆类)[17]。研究区设施大棚蔬菜Cd含量分析结果以鲜重计(表2),不同蔬菜Cd含量均值由大到小依次为白菜>番茄>豇豆,此与前人研究结果[17]一致。
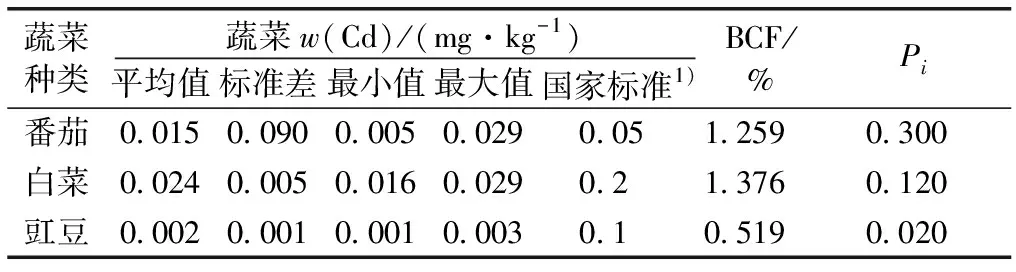
表2 设施大棚蔬菜(鲜基)Cd含量统计
番茄、白菜和豇豆BCF分别为1.259%、1.376%和0.519%,Pi分别为0.300、0.120和0.020,3种蔬菜均未超标,豇豆BCF和Pi均最低。也有研究者[18]发现,在10 mg·kg-1Cd浓度土壤上种植豇豆,豆荚Cd含量仍显著低于国家标准,这与其根部截留Cd、降低茎叶转运相关,豇豆可以作为重金属Cd污染地区农业种植结构调整的适宜作物[19]。
2.3 设施大棚土壤Cd含量对蔬菜可食部位Cd含量的影响
Cd在土壤中以不同形态存在,残渣态等形态不能被植物吸收利用[20]。有研究认为作物可食部位Cd累积量与土壤全Cd含量关系不显著,而与土壤有效Cd含量显著相关[21-23]。也有研究发现,作物可食部位Cd累积量与土壤有效Cd含量和土壤全Cd含量均呈显著正相关,但作物可食部位Cd累与土壤有效Cd含量相关性和显著性明显优于其与土壤全Cd含量的相关关系[9,24]。笔者研究采用回归分析方法分析了设施大棚蔬菜可食部位Cd含量与对应耕作层土壤有效Cd含量和土壤全Cd含量的关系,结果见图1。蔬菜可食部位Cd含量与耕作层土壤有效Cd含量呈极显著正相关(r=0.785**,P<0.01),蔬菜可食部位Cd含量与耕作层土壤全Cd含量呈显著正相关(r=0.508*,P<0.05),蔬菜可食部位Cd含量与耕作层土壤有效Cd含量拟合效果(R2=0.616)优于蔬菜可食部位Cd含量与耕作层土壤全Cd含量拟合效果(R2=0.258),说明耕作层土壤有效Cd含量对蔬菜可食部位Cd含量的影响强于土壤全Cd含量。相对于土壤全Cd含量而言,土壤有效Cd含量能更好地反映蔬菜可食部位Cd含量的潜在污染,预测食品中重金属安全性。
2.4 设施大棚土壤理化性质对土壤Cd生物有效性的影响
影响土壤Cd生物有效性的因素有很多,其中,土壤酸化是导致土壤Cd活化的重要原因之一[25]。也有研究认为,自然条件下,土壤pH和Cd含量的差异性不会对蔬菜吸收Cd的能力产生显著性影响[26]。设施大棚土壤理化性质与土壤有效Cd相关关系见表3。

表 3 耕作层土壤各指标与土壤有效Cd的相关关系
表3显示,土壤有效Cd与全Cd呈极显著正相关(0.834**,P<0.01);土壤全Cd与土壤养分指标均未呈显著相关,并且耕作层全Cd含量与心土层差异不显著(表1),说明研究区土壤Cd来源于肥料的可能性不大,可能主要来源于成土母质风化;土壤有效Cd与土壤碱解氮呈显著正相关(r=0.562*,P<0.05)。有研究发现随着土壤pH的降低,土壤中H+含量增加,导致土壤胶体螯合态、吸附态和静电结合态等稳定性降低,有效态含量增加[27],而氮肥过量施入又是导致土壤酸化的重要原因[28-29],进而活化土壤Cd,促进Cd在蔬菜中的富集。该研究发现土壤有效Cd含量与土壤pH呈极显著负相关(r=-0.780**,P<0.01),土壤pH与土壤碱解氮含量呈极显著负相关(r=-0.661**,P<0.01),初步证明研究区过量氮肥施入是导致土壤Cd生物有效性提高的重要原因。
2.5 设施大棚土壤Cd生物有效性的主控因子分析
为进一步揭示土壤高Cd地质背景和肥料施入对土壤Cd生物有效性的影响,以土壤全Cd、pH、有机质、碱解氮、有效磷、速效钾和有效Cd含量为影响因子,通过最大方差旋转法进行主成分分析,得出两个主成分(F1、F2),结果见表4。主成分F1和F2特征值分别为3.712和1.459,对各变量的方差贡献率分别为53.030%和20.836%,累积贡献率为73.866%。
以第1主成分F1为横坐标,以第2主成分F2为纵坐标,以其所对应特征向量的7个分量为数据点,得到这7个指标的二维因子载荷图(图2)。土壤因子在各主成分上的载荷量大小反映了因子在该成分上的影响力大小,载荷大的因子影响力大,是主要影响因子,其正负则反映了因子的复合性,从而可根据载荷量大小及正负评价土壤各因子之间的关系[9]。土壤有效Cd含量、土壤碱解氮含量与土壤全Cd含量在第1主成分上均有较大正载荷,土壤pH在第1主成分上有较大负载荷,此与相关性分析结果一致,说明研究区氮肥施用量和高Cd地质背景是影响土壤Cd生物有效性的主要因子。
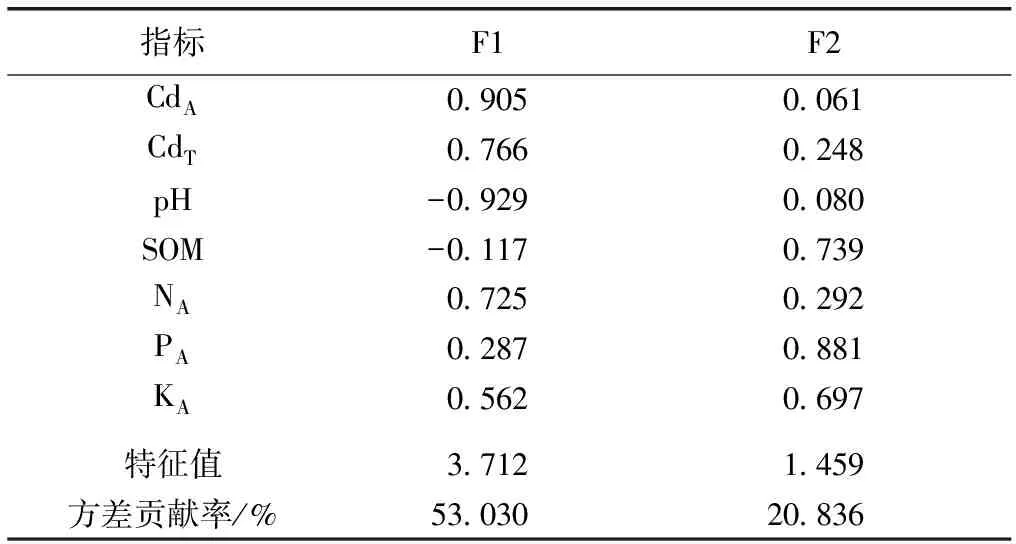
表4 最大方差旋转后的主成分因子载荷矩阵
传统的多元统计分析(相关分析和主成分分析)不能充分表征各因子交互性,易造成指标信息量缺失[30]。路径分析模型可以将因子相关系数分割成直接效应和间接效应,并检验各效应关系的显著水平[31]。通过路径分析模型进一步分析各因子与土壤Cd生物有效性变化间的效应关系(图3),模型对各变量解释程度较好,通过显著性检验(P<0.05)。土壤碱解氮含量与土壤有效Cd含量呈显著正相关(r=0.562*,P<0.05,表3),但土壤碱解氮含量对土壤有效Cd含量的直接作用并不显著(图3),而土壤碱解氮含量与pH呈极显著负相关(r=-0.661**,P<0.01,表3),土壤有效Cd含量与土壤pH呈极显著负相关(r=-0.780**,P<0.01,表3),说明氮肥施用量对土壤Cd生物有效性的影响是通过其对土壤pH的间接效应实现,这与前人研究结果[5]一致。有研究证明氮循环、盐基离子吸收和酸沉降3个关键致酸途径中,氮素循环致酸贡献率约为66.5%,其是导致土壤酸化的主要因子[32]。
土壤有效Cd与土壤全Cd呈极显著正相关(0.834**,P<0.01),土壤全Cd对土壤Cd生物有效性具有直接作用(图3)。研究区属于典型高Cd地球化学异常区[6],说明Cd高地质背景是提升土壤Cd生物有效性的直接决定因子。
3 结论
(1)研究区设施菜地耕作层全Cd含量与心土层差异不显著,与耕作层土壤养分指标相关性不显著,其主要来源为成土母质风化。
(2)研究区设施蔬菜对Cd的累积规律表现为白菜>番茄>豇豆,3种蔬菜均未超标。豇豆BCF和Pi均最低,其可以作为重金属Cd污染区农业种植结构调整的适宜作物。
(3)研究区设施菜地中,蔬菜Cd含量与土壤Cd有效态含量的相关性强于其与土壤Cd全量的相关性。相比于土壤全Cd含量而言,土壤有效Cd含量能更好地反映蔬菜中Cd的潜在污染和预测食品中重金属安全性。
(4)研究区设施菜地高Cd含量与高施氮量分别是提高土壤Cd生物有效性的直接因子和间接因子,土壤SOM、P、K等养分指标对土壤Cd生物有效性的影响不显著。
