miR-130a 对 IL-1β 诱导骨关节炎细胞模型的保护作用及机制研究
2021-08-02卢伟广汤善华王灿斌
卢伟广 汤善华 王灿斌
骨关节炎是中老年人群常见的关节退行性病变,以关节软骨进行性破坏、滑膜炎、骨质增生为特征,临床上表现为关节疼痛和功能障碍。目前,骨关节炎尚无根治手段,临床上主要进行镇痛、改善关节功能等对症治疗,疗效不佳时可进行关节清理、关节置换等外科治疗[1-2]。骨关节炎的发病涉及多因素、多环节、多基因,具体机制尚不十分明确。因为关节软骨的损伤及破坏是骨关节炎发病的重要病理特征,所以越来越多的研究开始关注骨关节炎发病过程中关节软骨损伤及破坏的机制。
微小 RNA(microRNA,miR) 是近些年备受关注的一类非编码小分子 RNA,在转录后水平调节基因表达并发挥相应的生物学作用。骨关节炎相关的研究证实,miR-130a 在骨关节炎患者软骨中表达降低,长链非编码 RNA HOTAIR 或 CIR 能够使 miR-130a 的表达下调并抑制软骨细胞的增殖[3-4],提示 miR-130a 可能在骨关节炎发病过程中参与软骨细胞损伤的调控,但 miR-130a 具体的调控作用及机制尚未明确。白介素-1β(interleukin-1β,IL-1β) 是重要的促炎细胞因子,在骨关节炎发病过程中参与关节软骨的损伤及破坏,多项骨关节炎相关的基础研究也用 IL-1β 刺激软骨细胞作为骨关节炎的细胞模 型[5-6]。基于此,本实验将以 IL-1β 诱导骨的关节炎细胞模型为研究对象,分析 miR-130a 的保护作用及分子机制。
材料与方法
一、细胞
大鼠骨关节软骨细胞 ATDC5 购自美国 ATCC 公司,液氮中冷冻保存。
二、试剂
miR-130a 及阴性对照(NC) miR、阴性对照腺病毒(Ad-NC) 及过表达 PTEN 的腺病毒(Ad-PTEN) 均购自上海吉玛公司,腺病毒滴度为 1×109PFU / ml; miR 提取分离试剂盒、miR cDNA 第一链合成试剂盒、miR 荧光定量检测试剂盒购自北京天根公司;MTS 细胞活力检测试剂盒、双荧光素酶报告基因及检测系统均购自 Promega 公司;TUNEL(红色荧光) 试剂盒购自上海碧云天公司;RIPA 裂解液、BCA 蛋白定量试剂盒购自北京索莱宝公司;人第 10 号染色体缺失的磷酸酶及张力蛋白同源蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN) 一抗购自 Abcam 公司,磷脂酰肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)、磷酸化 PI3K(phospho-PI3K,p-PI3K)、蛋白激酶 B(Protein kinase B,AKT)、磷酸化 AKT(phospho-AKT,p-AKT) 一抗购自 CST 公司。
三、仪器
细胞培养箱为 Thermo 公司(型号 BB15),荧光定量 PCR 仪为 Bio-rad 公司(型号 CFX96),显微镜购自 Nikon 公司(型号 MA100N),电泳系统及凝胶成像系统购自 Tanon 公司(型号 5200Multi)。
四、方法
1.细胞培养及分组:ATDC5 细胞用含有 10% 胎牛血清的 DMEM 培养,每 3 天更换 1 次培养基,待细胞密度生长至 80% 后用 0.25% 胰蛋白酶消化,按照 1∶3 比例传代。将细胞接种在培养板内并进行分组处理。
为了验证 IL-1β 对 ATDC5 细胞中 miR-130a 表达的影响,将细胞分为 0 ng / ml IL-1β 组、1 ng / ml IL-1β 组、5 ng / ml IL-1β 组、10 ng / ml IL-1β 组。分别用含有 0、1、5、10 ng / ml IL-1β 的培养基处理。
为了验证 miR-130a 对 IL-1β 诱导骨关节炎细胞模型的保护作用,将细胞分为对照组、miR-NC 组、IL-1β + miR-NC 组、IL-1β + miR-130a 组。对照组用不含药物的培养基处理,miR-NC 组转染 NC miR,IL-1β + miR-NC 组转染 NC miR 后用含有 10 ng / ml IL-1β 的培养基处理,IL-1β + miR-130a 组转染 miR-130a 后用含有 10 ng / ml IL-1β 的培养基处理。IL-1β + miR-NC 组与 miR-NC 组比较,细胞活力降低、细胞凋亡率增加,表明细胞发生损伤、骨关节炎细胞模型造模成功。
为了验证 PTEN 在 miR-130a 减轻 IL-1β 诱导骨关节炎细胞模型损伤中的作用,将细胞分为 Ad-NC 组、Ad-NC + IL-1β 组、Ad-NC + IL-1β + miR-130a 组、Ad-PTEN + IL-1β + miR-130a 组。Ad-NC 组转染 NC 腺病毒,Ad-NC + IL-1β 组转染 NC 腺病毒并用含有 10 ng / ml IL-1β 的培养基处理,Ad-NC + IL-1β + miR-130a 组共转染 NC 腺病毒、miR-130a 并用含有 10 ng / ml IL-1β 的培养基处理,Ad-PTEN + IL-1β + miR-130a 组共转染过表达 PTEN 的腺病毒、 miR-130a 并用含有 10 ng / ml IL-1β 的培养基处理。
2.miR-130a 表达水平的荧光定量 PCR 检测:用 miR 提取试剂盒提取细胞中的 miR,用 miR cDNA 第一链合成试剂盒将细胞中的 miR 反转录为 cDNA,用 miR 荧光定量 PCR 检测试剂盒配置 PCR 反应体系,分别扩增 miR-130a 及 U6,扩增反应的程序为 95 ℃ 预变性 3 min 后按照 95 ℃ 15 s 及 60 ℃ 34 s 的循环重复 40 次,反应完成后生成循环曲线及循环阈值(Ct),以 U6 为内参、按照公式 2-ΔΔCt计算 miR-130a 的表达水平。
3.细胞活力的 MTS 检测:用 MTS 细胞活力检测试剂盒对细胞进行染色,3~4 h 后将培养板放入多功能酶标仪,将波长设定在 490 nm 并测定吸光值、记录为 A490。
4.细胞凋亡的 TUNEL 检测:用 TUNEL 细胞凋亡检测试剂盒对细胞进行染色,避光孵育后 60 min 用抗荧光猝灭封片液(含 DAPI) 进行封片,在显微镜下观察激发波长 550 nm、发射波长 570 nm 的绿色荧光及激发波长 364 nm、发射波长 454 nm 的蓝色荧光,随机观察 3 个高倍视野,对绿色荧光细胞及蓝色荧光细胞进行计数,按照绿色荧光细胞数 / 蓝色荧光细胞数计算细胞凋亡率。
5.PTEN / PI3K / AKT 的 western blot 检测:用 RIPA 裂解液提取细胞中的蛋白,用 BCA 蛋白定量试剂盒检测蛋白含量,取含有 30 μg 蛋白的样本进行 western blot 检测,将蛋白样本与上样缓冲液混合后加入 SDS-聚丙烯酰胺凝胶,电泳分离后电转移至 PVDF 膜,5% 脱脂牛奶封闭 PVDF 膜 1 h,1∶1000 稀释的 PTEN、PI3K、p-PI3K、AKT、p-AKT 一抗或 1∶5000 稀释的 β-actin 一抗孵育 PVDF 膜过夜, 1∶2000 稀释的二抗室温孵育 PVDF 膜 1 h,加入 ECL 显影液并在凝胶成像系统中显影得到 PTEN、PI3K、p-PI3K、AKT、p-AKT、β-actin 的蛋白条带,计算 PTEN / β-actin、PI3K / p-PI3K、AKT / p-AKT 灰度值的比值作为蛋白表达水平。
6.双荧光素酶报告基因实验:构建野生型 PTEN 双荧光素酶报告基因,含有野生型 PTEN 基因 mRNA 的 3’UTR,与 miR-130a 或 NC miR 共同转染进入细胞,其后 48 h 采用双荧光素酶报告基因检测试剂盒测定细胞中萤火虫及海参的荧光活力,计算萤火虫与海参荧光活力的比值作为双荧光素酶报告基因的荧光活力;在 Targetscan 网站中进行生物信息学预测,根据预测结果将野生型 PTEN 基因 mRNA 3’UTR 中 miR-130a 结合的碱基进行突变、得到突变型 PTEN 双荧光素酶报告基因,采用与野生型双荧光素酶报告基因相同的方法检测荧光活力。
五、统计学处理
采用 SPSS 21.0 软件录入数据,计量资料以x-±s表示,多组间比较采用方差分析、两两比较采用 LSD-t检验,P< 0.05 为差异有统计学意义。
结 果
一、IL-1β 诱导骨关节炎细胞模型中 miR-130a 表达的变化
与 0 ng / ml IL-1β 组比较,1 ng / ml IL-1β、 5 ng / ml IL-1β、10 ng / ml IL-1β 组 ATDC5 细胞中 miR-130a 的表达水平均明显降低且随着 IL-1β 浓度的增加,ATDC5 细胞中 miR-130a 的表达水平逐渐降低(P< 0.05)。
二、miR-130a 对 IL-1β 诱导骨关节炎细胞模型活力及凋亡的影响
荧光定量 PCR 检测显示,与对照组、miR-NC 组比较,IL-1β + miR-NC 组 ATDC5 细胞中 miR-130a 的表达水平明显降低(P< 0.05),与 IL-1β + miR-NC 组比较,IL-1β + miR-130a 组 ATDC5 细胞中 miR-130a 的表达水平明显增加(P< 0.05)(图 2a)。
MTS 检测显示,与对照组、miR-NC 组比较,IL-1β + miR-NC 组 ATDC5 细胞的 A490 水平明显降低(P< 0.05),与 IL-1β + miR-NC 组比较,IL-1β + miR-130a 组 ATDC5 细胞的 A490 水平明显增加(P< 0.05)(图 2b)。
TUNEL 检测显示,与对照组、miR-NC 组比较,IL-1β + miR-NC 组 ATDC5 细胞的凋亡率明显增加(P< 0.05),与 IL-1β + miR-NC 组比较,IL-1β + miR-130a 组 ATDC5 细胞的凋亡率明显降低(P< 0.05)(图 2c、2d)。

图2 miR-130a 对 IL-1β 诱导骨关节炎细胞模型活力及凋亡的影响 a:4 组细胞 miR-130a 表达水平的比较;b:4 组细胞活力 A490 水平的比较;c:4 组细胞 TUNEL 染色图;d:4 组细胞凋亡率的比较。与对照组比较,*P < 0.05,与 miR-NC 组比较,#P < 0.05,与 IL-1β + miR-NC 组比较,&P < 0.05Fig.2 Effects of miR-130a on the activity and apoptosis of osteoarthritis cell model induced by IL-1β a: Comparison of miR-130a expression among 4 groups; b: Comparison of A490 level among 4 groups; c: TUNEL staining of 4 groups; d: Comparison of apoptosis rate among 4 groups.Compared with the control group, *P < 0.05; compared with miR-NC group, #P < 0.05; compared with IL-1β + miR-NC group, &P < 0.05
三、miR-130a 对 IL-1β 诱导骨关节炎细胞模型中 PTEN / PI3K / AKT 的影响
Western blot 检测显示,与对照组、miR-NC 组比较,IL-1β + miR-NC 组 ATDC5 细胞中 PTEN 的表达水平明显增加,p-PI3K、p-AKT 表达水平明显降低(P< 0.05);与 IL-1β + miR-NC 组比较,IL-1β + miR-130a 组 ATDC5 细胞中 PTEN 的表达水平明显降低,p-PI3K、p-AKT 表达水平明显增加(P< 0.05)(图 3a、3b、3c)。
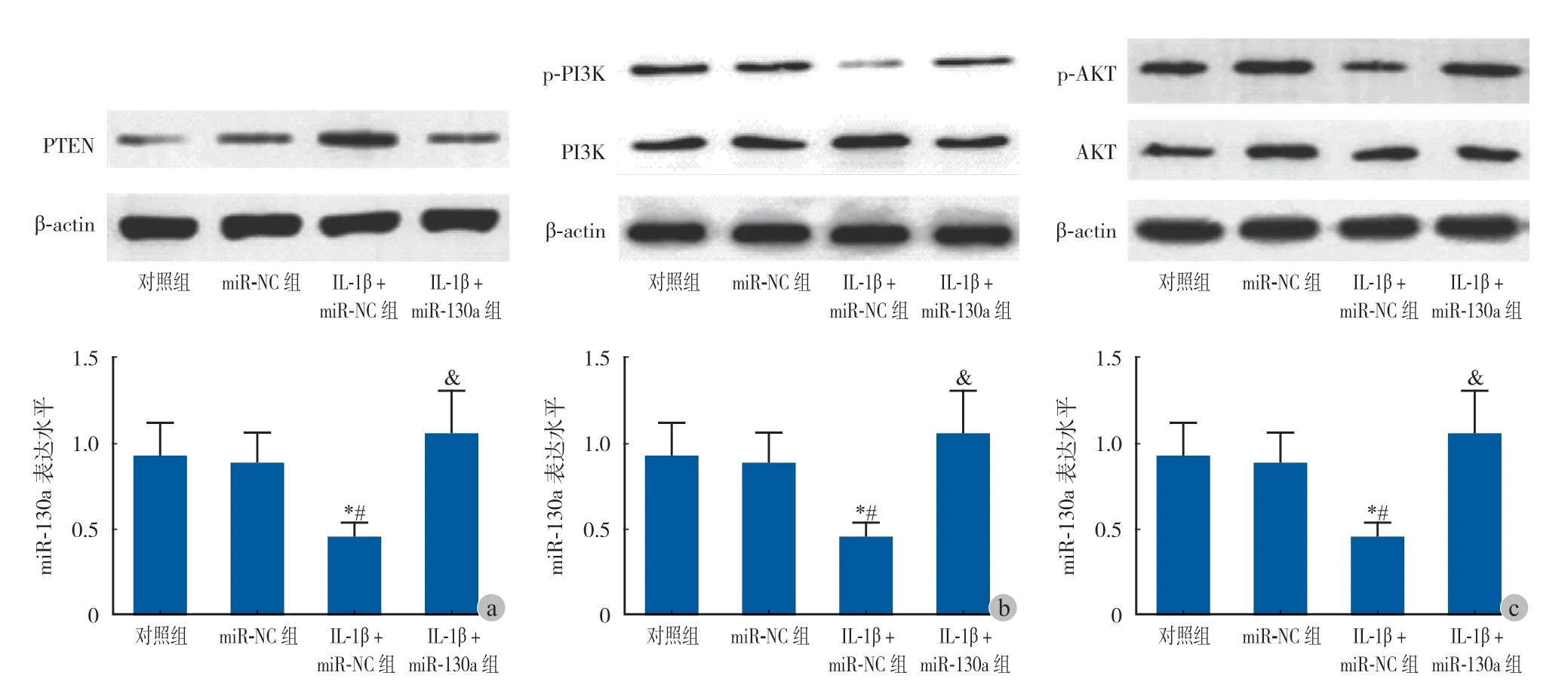
图3 miR-130a 对 IL-1β 诱导骨关节炎细胞模型中 PTEN / PI3K / AKT 的影响 a:4 组细胞中 PTEN 表达水平的比较;b:4 组细胞中 p-PI3K 表达水平的比较;c:4 组细胞中 p-AKT 表达水平的比较。与对照组比较,*P < 0.05,与 miR-NC 组比较,#P < 0.05,与 IL-1β + miR-NC 组比较,&P < 0.05Fig.3 Effects of miR-130a on PTEN / PI3K / Akt in osteoarthritis cell model induced by IL-1β a: Comparison of PTEN expression among 4 groups; b: Comparison of p-PI3K expression among 4 groups; c: Comparison of p-AKT expression among 4 groups. Compared with the control group, *P < 0.05; compared with miR-NC group, #P < 0.05; compared with IL-1β + miR-NC group, &P < 0.05
四、miR-130a 靶向调节 PTEN 表达
Targetscan 生物信息学分析显示,PTEN 基因 mRNA 3’UTR 中含有 miR-130a 的结合位点(图 4a); 与 miR-NC 组比较,miR-130a 组 ATDC5 细胞中野生型 PTEN 双荧光素酶报告基因的荧光活力明显降低(P< 0.05)(图 4b),突变型 PTEN 双荧光素酶报告基因的荧光活力无明显变化(P> 0.05)(图 4c)。
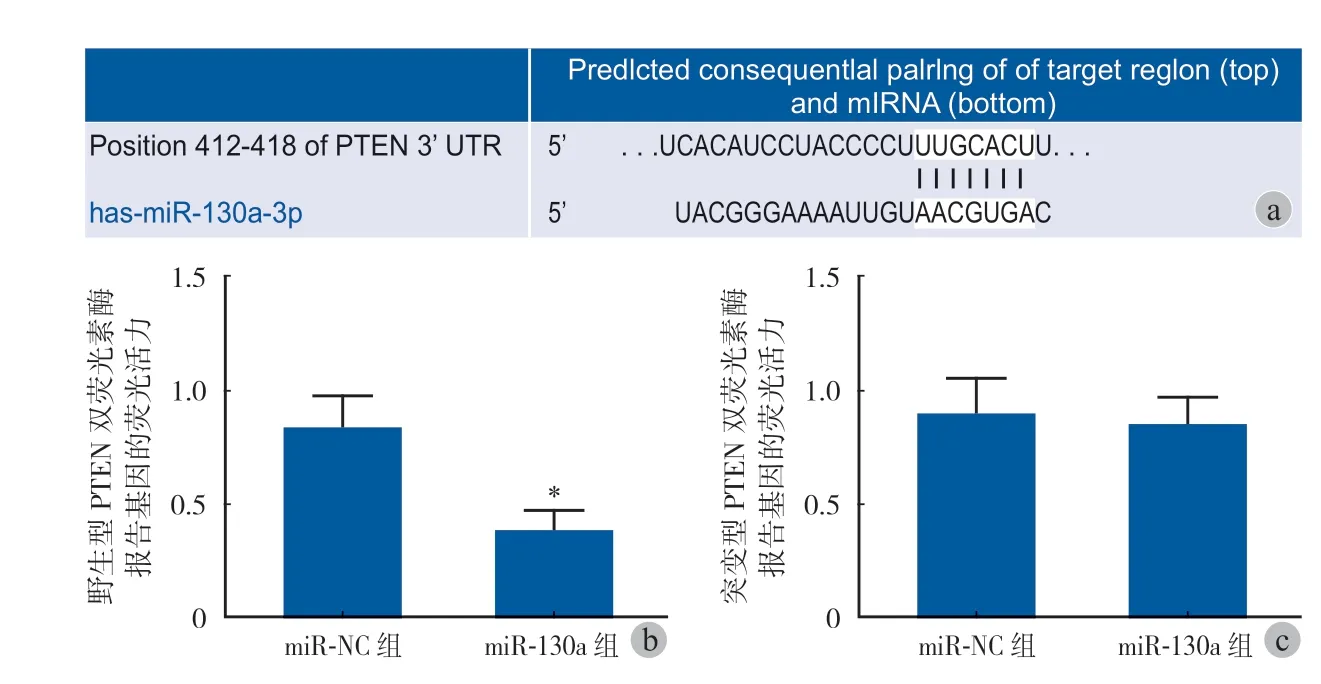
图4 miR-130a 靶向调节 PTEN 表达 a:miR-130a 靶向调节 PTEN 的生物信息学分析;b:野生型 PTEN 双荧光素酶报告基因荧光活力的比较;c:突变型 PTEN 双荧光素酶报告基因荧光活力的比较。与 miR-NC 组比较,*P < 0.05Fig.4 miR-130a targeted PTEN expression a: Bioinformatics analysis of miR-130a targeted regulation of PTEN b: Comparison of fluorescence activity of wild-type PTEN double luciferase reporter gene; c: Comparison of fluorescence activity of mutant PTEN double luciferase reporter gene.Compared with miR-NC group, *P < 0.05
五、过表达 PTEN 对 miR-130a 减轻 IL-1β 诱导骨关节炎细胞模型损伤的影响
Western blot 检测显示,与 Ad-NC 组比较, Ad-NC + IL-1β 组 ATDC5 细胞中 PTEN 的表达水平明显增加(P< 0.05);与 Ad-NC + IL-1β 组比较, Ad-NC + IL-1β + miR-130a 组 ATDC5 细胞中 PTEN 的表达水平明显降低 (P< 0.05);与 Ad-NC + IL-1β + miR-130a 组比较,Ad-PTEN + IL-1β + miR-130a 组 ATDC5 细胞中 PTEN 的表达水平明显增加(P< 0.05)(图 5a)。
MTS 检测显示,与 Ad-NC 组比较,Ad-NC + IL-1β 组 ATDC5 细胞的 A490 水平降低(P< 0.05);与 Ad-NC + IL-1β 组比较,Ad-NC + IL-1β + miR-130a 组 ATDC5 细胞的 A490 水平明显增加(P< 0.05);与 Ad-NC + IL-1β + miR-130a 组比较,Ad-PTEN + IL-1β + miR-130a 组 ATDC5 细胞的 A490 水平明显降低(P< 0.05)(图 5b)。
TUNEL 检测显示,与 Ad-NC 组比较,Ad-NC + IL-1β 组 ATDC5 细胞的凋亡率明显增加(P< 0.05);与 Ad-NC + IL-1β 组比较,Ad-NC + IL-1β + miR-130a 组 ATDC5 细胞的凋亡率明显降低(P< 0.05);与 Ad-NC + IL-1β + miR-130a 组比较,Ad-PTEN + IL-1β + miR-130a 组 ATDC5 细胞的凋亡率明显增加(P< 0.05)(图 5c、5d)。

图5 过表达 PTEN 对 miR-130a 减轻 IL-1β 诱导骨关节炎细胞模型损伤的影响 a:4 组细胞 PTEN 表达水平的比较; b:4 组细胞活力 A490 水平的比较;c:4 组细胞 TUNEL 染色图;d:4 组细胞凋亡率的比较。与 Ad-NC 比较,*P < 0.05,与 Ad-NC + IL-1β 组比较,#P < 0.05,与 Ad-NC + IL-1β + miR-130a 组比较,&P < 0.05Fig.5 Effects of overexpression of PTEN on miR-130a attenuates IL-1β-induced osteoarthritis cell model injury a: Comparison of PTEN expression among 4 groups; b: Comparison of A490 level among 4 groups; c: TUNEL staining of 4 groups; d: Comparison of apoptosis rate among 4 groups.Compared with Ad-NC, *P < 0.05; compared with Ad-NC + IL-1β group, #P < 0.05; compared with Ad-NC + IL-1β + miR-130a group, &P < 0.05
讨论
骨关节炎的发病机制未明、临床缺乏有效的根治或靶向治疗手段。关节软骨细胞损伤及破坏、细胞外基质的进行性丢失在骨关节炎的发病中起重要作用,可逐步导致关节软骨丧失弹性和强度、引起骨质增生或骨赘形成并出现关节疼痛、功能障碍等临床表现。miR 是近些年多种骨科疾病研究的热点,多种 miR 在骨关节炎的发病过程中存在异常表达[5-9],其中 Sun 等[5]和 Jia 等[6]的研究均报道了 miR-130a 与骨关节炎发病过程中关节软骨细胞损伤存在密切关系,在骨关节炎患者的软骨细胞中 miR-130a 表达明显下调,外源性使用长链非编码 RNA 抑制 miR-130a 的表达后、软骨细胞的增殖也受到抑制,提示 miR-130a 可能具有关节软骨保护作用,骨关节炎发病过程中 miR-130a 表达减少会削弱其保护作用并引起软骨细胞损伤。但 miR-130a 对骨关节炎发病过程中软骨细胞的保护作用及分子机制仍有待进一步研究证实。
IL-1β 是与骨关节炎发病密切相关的促炎细胞因子,IL-1β 诱导关节软骨细胞损伤是研究骨关节炎常用的细胞模型[3-4]。本研究为了阐明 miR-130a 对骨关节炎发病过程中软骨细胞的保护作用,首先在 IL-1β 诱导的骨关节炎细胞模型中验证了 miR-130a 表达的变化,不同浓度 IL-1β 刺激关节软骨细胞后、miR-130a 的表达均明显降低,与骨关节炎患者软骨细胞中 miR-130a 表达的变化趋势一致,提示 miR-130a 低表达可能与骨关节炎发病过程中软骨细胞的损伤有关、外源性增加 miR-130a 的表达可能具有软骨细胞保护作用。
细胞活力减弱、凋亡激活是骨关节炎发病过程中软骨细胞损伤的特征,多项骨关节炎相关的细胞研究表明,IL-1β 刺激软骨细胞后细胞活力减弱、凋亡率增加[10-12]。在本实验中,在转染 NC miR 的基础上用 IL-1β 诱导骨关节炎细胞模型后观察到:细胞活力减弱、凋亡率增加,与既往研究报道的 IL-1β 引起软骨细胞活力降低、凋亡激活的结果[10-12]一致;而在转染 miR-130a 的基础上用 IL-1β 诱导骨关节炎细胞模型后观察到:与转染 NC miR 的 IL-1β 诱导骨关节炎细胞模型比较,细胞活力增强、凋亡率降低,表明 miR-130a 对 IL-1β 诱导骨关节炎细胞模型具有保护作用,能够增强细胞活力、抑制细胞凋亡。
miR-130a 不仅在软骨细胞中发挥增强细胞活力、抑制细胞凋亡的作用,在神经元缺血缺氧损伤、肾小球内皮细胞炎症损伤中 miR-130a 能够抑制凋亡[13-14],在恶性肿瘤生长过程中能够抑制癌细胞增殖活力、促进癌细胞凋亡[15-16],并且多项研究均证实 miR-130a 通过靶向抑制 PTEN 基因来介导增强细胞活力、抑制细胞凋亡的作用。PTEN 具有去磷酸化酶的活性,能够使 PI3K 及 AKT 发生去磷酸化并失活,抑制 PI3K / AKT 激活所介导的促进增殖、抑制凋亡作用[17-18]。在本实验中,IL-1β 诱导骨关节炎细胞模型中 PTEN 表达水平增加、p-PI3K 及 p-AKT 表达水平降低,转染 miR-130a 后 PTEN 表达水平降低、p-PI3K 及 p-AKT 表达水平增加,表明 miR-130a 能够在 IL-1β 诱导骨关节炎细胞模型中抑制 PTEN 表达并促进下游 PI3K / AKT 激活,这可能是 miR-130a 在 IL-1β 诱导骨关节炎细胞模型中发挥保护作用的分子机制。
miR 的生物学作用是在转录后水平调控基因表达,发挥调控作用的机制是与靶基因 mRNA 3’UTR 结合并促进 mRNA 降解或抑制 mRNA 翻译,最终实现对靶基因表达的负调控。本实验在发现 miR-130a 能够在 IL-1β 诱导骨关节炎细胞模型中抑制 PTEN 的表达后,进一步通过双荧光素酶报告基因实验验证了 miR-130a 能够靶向 PTEN 基因 mRNA 3’UTR,并且将 3’UTR 中 miR-130a 结合的碱基突变后、 miR-130a 不再影响双荧光素酶报告基因的荧光活力。在此基础上,本实验设计了过表达 PTEN 的腺病毒,在转染 miR-130a 的同时用过表达 PTEN 的腺病毒进行感染,在增加 PTEN 的表达后、miR-130a 在 IL-1β 诱导骨关节炎细胞模型中增强细胞活力、抑制细胞凋亡的作用丧失,由此证实靶向抑制 PTEN 基因表达是 miR-130a 在 IL-1β 诱导骨关节炎细胞模型中发挥保护作用的可能分子机制。
综上所述,miR-130a 对 IL-1β 诱导骨关节炎细胞模型具有保护作用,靶向调控 PTEN 表达并增强细胞活力、抑制细胞凋亡是可能的分子机制,未来 miR-130a 可能成为研究骨关节炎发病机制及靶向治疗手段的分子靶点。
