氧化苦参碱通过激活Nrf2/HO-1通路减轻肝硬化大鼠肠道氧化应激损伤
2021-07-31文志勇刘伟华谭松龄江丽萍陈卫国文剑波
文志勇,刘伟华,谭松龄,冉 云,陈 杰,肖 娜,江丽萍,李 兴,陈卫国,文剑波
(赣南医学院附属萍乡市人民医院,江西 萍乡 337000)
肝硬化是由不同肝损伤机制引起的坏死性炎症和纤维化,组织学特征为弥漫大小不一的假小叶形成。当肝硬化发展为临床失代偿期,1 年的死亡率为1%~57%不等,全球每年导致103万人死亡[1]。失代偿肝硬化患者发生急、慢性肝功能衰竭(ACLF)等并发症与较高的医疗费用相关,包括感染、腹水、门静脉血栓形成、手术、肝细胞癌和肝昏迷[2]。有研究发现在肝硬化患者中肠道损害包括红斑、糜烂、血管扩张、静脉曲张和绒毛水肿(7%)[3]。在肝硬化大鼠模型中,发现肠道大量破坏、炎症浸润黏膜上皮、腺上皮中的圆柱形结构消失、绒毛严重肿胀和黏膜结构松散[4]。肠道细菌易位(Bacterial translocation,BT)在肝硬化并发症的发病机制中起重要作用,而肠上皮屏障在肝硬化患者抗BT生理功能的维持中起重要作用。在病理条件下,肠上皮屏障完整性破坏导致肠上皮屏障功能障碍,从而促进BT,导致失代偿性肝硬化[5]。
胃肠道(GI)是活性氧(Reactive oxygen species,ROS)的主要来源,而活性氧与许多胃肠道疾病有关[6]。过度的氧化应激将导致肠道炎症和肠黏膜上皮细胞凋亡,从而进一步损害肠黏膜屏障[6]。有研究发现肝硬化大鼠,特别是具有腹水和细菌易位的大鼠,在回肠和盲肠黏膜中氧化应激ROS 产物丙二醛水平升高,且与门脉压力之间存在直接相关性[7]。
核转录因子红系2相关因子(Nuclear factor-erythroid 2-related factor 2,Nrf2)是细胞针对环境应激应答的主要调节器。在肠道应激条件下,Kelch 样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)诱导Nrf2 磷酸化从细胞质转运到细胞核,从而激活解毒和抗氧化酶的表达。Nrf2 靶基因包括编码血红素加氧酶-1(Heme oxygenase-1,HO-1)、抗氧化酶、药物代谢酶和转运体的基因[8]。Nrf2/HO-1 通路在抵抗严重的肠道黏膜氧化损伤中起关键作用。用葡聚糖硫酸钠(Dextran sulphate sodium,DSS)处理6 d的Nrf2基因缺陷小鼠,结肠组织中的脂质过氧化水平显著高于野生型小鼠,包括丙二醛和4-羟基烯[9]。有研究发现,与健康人类相比,溃疡性结肠炎(ulcerative colitis,UC)患者结肠炎症组织中Nrf2 基因的表达水平升高,且UC 患者结肠组织中谷胱甘肽转移酶的表达也增加[10]。
氧化苦参碱(Oxymatrine,OMT)是一种源自传统中草药苦参的喹嗪生物碱,具有广泛的药理学活性。研究证明OMT 可通过RNA 干扰技术将病毒pgRNA 包装到核衣壳中或抑制病毒DNA 聚合酶的活性来抑制肝炎病毒的复制[11-12]。其抗氧化活性已用于治疗肝纤维化、急性肝衰竭、皮肤疾病、心脏毒性、胃溃疡和肺动脉高压[13-16]。有研究发现OMT 可能在急性肝衰竭(ALF)中参与Nrf2/HO-1 通路的活化,减轻肝纤维化[13]。我们已经证明,氧化苦参碱可通过调节NF-κB 介导的信号通路来改善肝硬化肠屏障功能,从而减少炎症[4]。然而,OMT是否通过Nrf2/HO-1 通路改善肝硬化肠屏障功能尚不清楚。因此,我们在具备肠黏膜损害的肝硬化大鼠模型中,研究OMT 治疗是否能够激活肠道Nrf2/HO-1 通路减轻肠道氧化应激损伤,维持肠道屏障完整性。
1 材料和方法
1.1 动物及材料28 只雄性SD 大鼠(200~250 g)购自长沙斯莱克景达实验动物有限公司。将所有动物饲养在含木屑的塑料笼中,并在22 ℃~25 ℃的房间中饲养,12 h 光照/夜间循环,自由获取标准实验室饲料和水。动物研究方案获得本院动物实验伦理委员会的批准(批号:BE201602132,批准日期:2019-8-6)。主要实验材料包括:CCl4分析纯溶液(500 mL/瓶,国药集团化学药业公司),苦参素注射液(正大天晴药业公司),GSH 试剂盒、MDA试剂盒、CAT 试剂盒(碧云天),SOD试剂盒、T-AOC试剂盒(上海素尔实验技术公司),核蛋白分离试剂盒(Merk),Nrf2(Avivasysbio, OAAJ03246,1∶500)、P-Nrf2(Avivasysbio,OABF00897,1∶200)、HO-1(Abcam,ab13243,1∶100)、Claudin 4(Abcam,ab53156,1∶500)、H3(Abcam,ab1791,1∶4 000)及GAPDH(Abcam,ab125247,1∶4 000),HRP-羊抗鼠IgG(boster,1∶5 000)。
1.2 方法
1.2.1 分组 SD大鼠随机分为3 组:正常大鼠为空白对照组(Control 组)、具备肠屏障破坏的肝硬化模型组(Model 组)和氧化苦参碱治疗肝硬化大鼠实验组(OMT 组)。实验方案分两步:模型制备期、动物实验期。
1.2.2 模型制备期在模型制备阶段,随机选取20 只SD 大鼠作为模型制备鼠,模型制备方法为皮下注射40% CCl4浓液(2∶3 橄榄油混合物),注射剂量为0.3 mL·kg-1,每周2 次,共12 周。密切观察各组肝硬化模型大鼠进食、进水、活动量、皮毛及体重变化,大鼠重量下降超过10 g 时,暂停模型方案,自由进食及饮水,待体重恢复到减轻小于10 g后,再继续造模方案[17-18]。在模型制备期间,于4、8、12 周分别随机抽取1 只大鼠处死,取肝脏行病理检查以观察肝脏硬化进展情况,取回肠末端组织行病理检查观察肠道屏障破坏情况。经病理切片验证,共成功制备出肝硬化合并有肠道黏膜屏障破坏模型大鼠16只。
1.2.3 动物实验期实验组大鼠根据体重肌注生理盐水配制的OMT注射液,剂量为6.3 mg·100 g-1,持续4 周,每天1 次;正常对照组、肝硬化模型组大鼠则根据体重肌注生理盐水溶液(0.5 mL·100 g-1),持续4 周,每天1 次;动物实验前测量每只大鼠体重作为原始体重,实验中监测各组大鼠体重,每周2次,使用体重百分比用于统计体重变化,体重百分比=所测体重/原始体重×100%。为有效防止模型及治疗组大鼠在实验期间肝硬化缓解,在动物实验13~16 周期间,模型组及实验组大鼠将继续予以浓度为40% CCl4橄榄油溶液皮下注射(注射剂量为0.3 mL·kg-1),每周2 次。如果体重下降10%或出现明显的症状,如黏膜苍白、颤抖、对刺激反应迟钝、勃起毛发蓬乱、发声困难,大鼠将被处死。在16周,所有大鼠使用高浓度的二氧化碳麻醉安乐死。收集回肠末端组织(5 cm)标本保存,做进一步分析。
1.3 组织病理学收集回肠末端标本(5 cm)进行常规组织病理学检查。病理医师在光镜下(Nikon Eclipse 50i;Kanagawa,日本)观察黏膜损伤。回肠黏膜损伤的病理指标包括:肠上皮结构紊乱、黏膜层破坏、绒毛萎缩、腺体减少、上皮及肌层炎性细胞浸润等。
1.4 氧化应激评价将组织样品在裂解缓冲液中均浆后离心(10 000 g,4°C)10 min 以分离上清液,上清液用于测定抗氧化酶及MDA水平检测。使用 试 剂 盒(BioVision Scientific INC,Shanghai,China)根据生产商说明书测定肠道超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)和总抗氧化能力(T-AOC)的含量。
1.5 Western-blot 分析使用试剂盒(NucBuster TM蛋白提取试剂盒,Merckmipore,货号:71183-3)根据生产商说明书提取回肠末端组织细胞质及细胞核蛋白。根据市售试剂盒提取回肠末端组织细胞蛋白,BCA 试剂盒蛋白定量,以每孔20 μg 总蛋白进行SDS-PAGE 凝胶电泳并转移至NC 膜中。T-TBS 漂洗,5%脱脂牛奶封闭2 h,T-TBS漂洗,一抗4°C 孵育过夜,T-TBS 漂洗,二抗室温孵育1 h,T-TBS 漂洗,ECL 显色。用Imag J 分析目的蛋白条带和内参条带灰度值,计算目的蛋白相对表达量。
1.6 统计学方法数据使用SPSS 16.0 进行分析。GraphPad Prism(美国,GraphPad 软件)进行绘图。数据采用均数±标准差表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 肝硬化肠道屏障破坏模型制备镜下改变在模型制备期间,于4、8、12 周分别随机抽取1 只大鼠行肝脏及末端回肠行病理检查以观察肝脏及肠道上皮屏障硬化进展情况。镜下观察显示,4 周大鼠可见肝脏肝细胞均匀排列,无假小叶形成,可见正常肝窦、汇管区及胆管。肠上皮形态维持基本完整。8 周肝脏明显弥漫性纤维基质增多,增生的致密纤维化隔膜将肝细胞重新包绕,形成假小叶。肠上皮形态受到不同程度破坏,上皮绒毛出现断裂,不同程度炎性细胞浸润。12 周肝脏除可见假小叶形成外,还可见肝实质消退和肝脏周围组织结构塌陷,肝脏血管结构明显扭曲,肝细胞排列紊乱,脂肪细胞浸润,肝细胞坏死。12 周肠黏膜上皮屏障形态严重破坏,绒毛萎缩、断裂,炎性细胞浸润。由此可见具备肠黏膜屏障破坏的大鼠肝硬化模型建立成功。见图1。
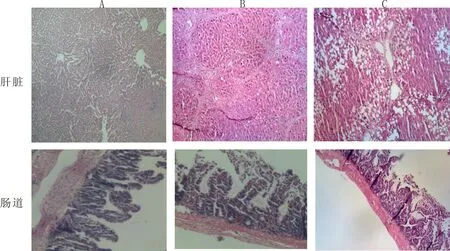
图1 具有肠黏膜破坏肝硬化模型制备4、8、12周肝脏及肠道HE染色
2.2 OMT 治疗能够增加肝硬化大鼠体重为观察OMT 治疗后对肝硬化大鼠体重的影响,3 组大鼠在13~16 周每周监测体重2 次,使用体重百分数进行统计分析。结果显示,与模型组相比,实验组肝硬化大鼠体重百分比增加更多,差异有统计学意义(P<0.01)。见图2。
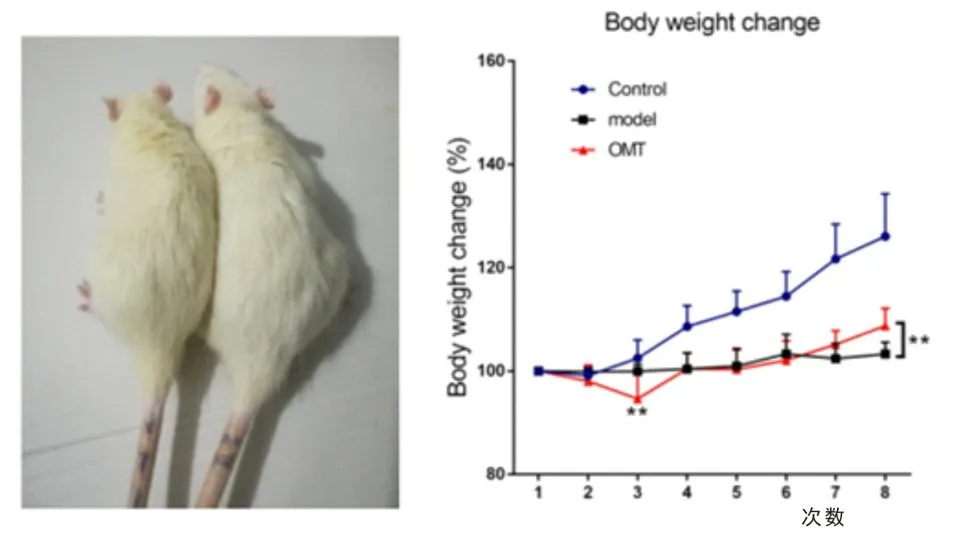
图2 3组大鼠体重百分比统计分析
2.3 OMT 改善CCl4诱导的肝硬化大鼠回肠组织的组织学变化空白对照组大鼠的回肠组织可见黏膜(Mucosa,m)和黏膜肌层(Muscularis mucosae,mm)(图3A,图3D)。在肝硬化模型大鼠中,肠黏膜层已被大量破坏,伴有萎缩、较短和断裂的绒毛,炎症细胞浸润至固有层和肌层,上皮腺体减少以及黏膜结构松散(图3B,图3E)。而经OMT 治疗后,实验组肠黏膜绒毛修复,黏膜完整性得到改善。腺上皮中圆柱状结构数量显著增加(图3C,图3F)。提示OMT可修复肝硬化大鼠肠屏障损伤。
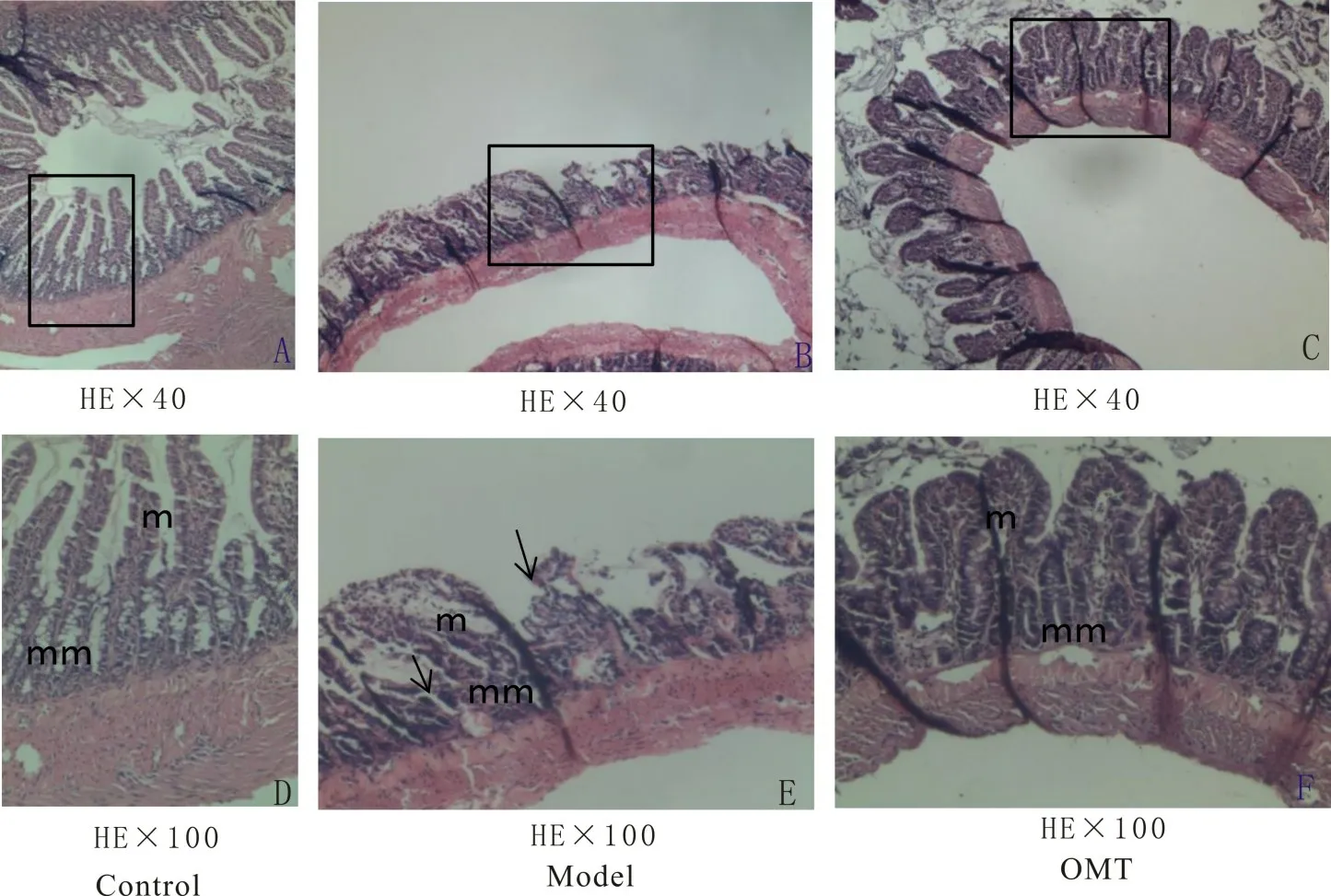
图3 3组大鼠回肠HE染色
2.4 OMT 降低了肝硬化大鼠回肠黏膜屏障的氧化应激损伤与模型组肝硬化大鼠相比,实验组大鼠抗氧化酶SOD、CAT、GSH、T-AOC 和HO-1 的表达显著增加,MDA含量显著降低。见表1、图4。

图4 3组大鼠抗氧化酶(SOD、CAT、GSH、T-AOC、MDA)及HO-1表达条带灰度值比较
表1 3组大鼠抗氧化酶(SOD、CAT、GSH、T-AOC、MDA)及HO-1的表达/±s

表1 3组大鼠抗氧化酶(SOD、CAT、GSH、T-AOC、MDA)及HO-1的表达/±s
注:a:对照组vs模型组,P<0.000 1;b:模型组vs实验组,P<0.05;c:模型组vs实验组,P<0.000 1;d:模型组vs实验组,P<0.001。
HO-1 DPI 0.86±0.36 0.21±0.11 0.37±0.21d 17.29组别对照组模型组实验组F值SOD/U·mg-1 1.81±0.47 0.57±0.12a 0.95±0.20b 35.14 CAT/U·mg-1 12.86±3.55 3.53±1.19a 6.91±1.08b 35.35 GSH/uM·mg-1 186.7±27.48 51.15±11.09a 111.2±15.9c 97.97 T-AOC/mmol·μL-1 0.13±0.012 0.04±0.01a 0.07±0.01c 119.5 MDA/μmol·mg-1 1.61±0.32 7.08±1.22a 3.98±0.93c 73.48
2.5 OMT 治疗能够影响肝硬化大鼠肠道Nrf2/HO-1通路p-Nrf2 蛋白的表达在细胞质和细胞核中均显著增加,Nrf2的表达在细胞核中也显著增加,Nrf2在细胞质中的表达无差异。进一步检测结果表明,细胞质、细胞核p-Nrf2/总Nrf2 蛋白经OMT 治疗后,在细胞质及细胞核pNrf2/总Nrf2 比值均升高,提示OMT 能够促进细胞质Nrf2 活化为磷酸化Nrf2。见图5、图6。

图5 3组大鼠胞质及胞核中Nrf2、p-Nrf2 的表达
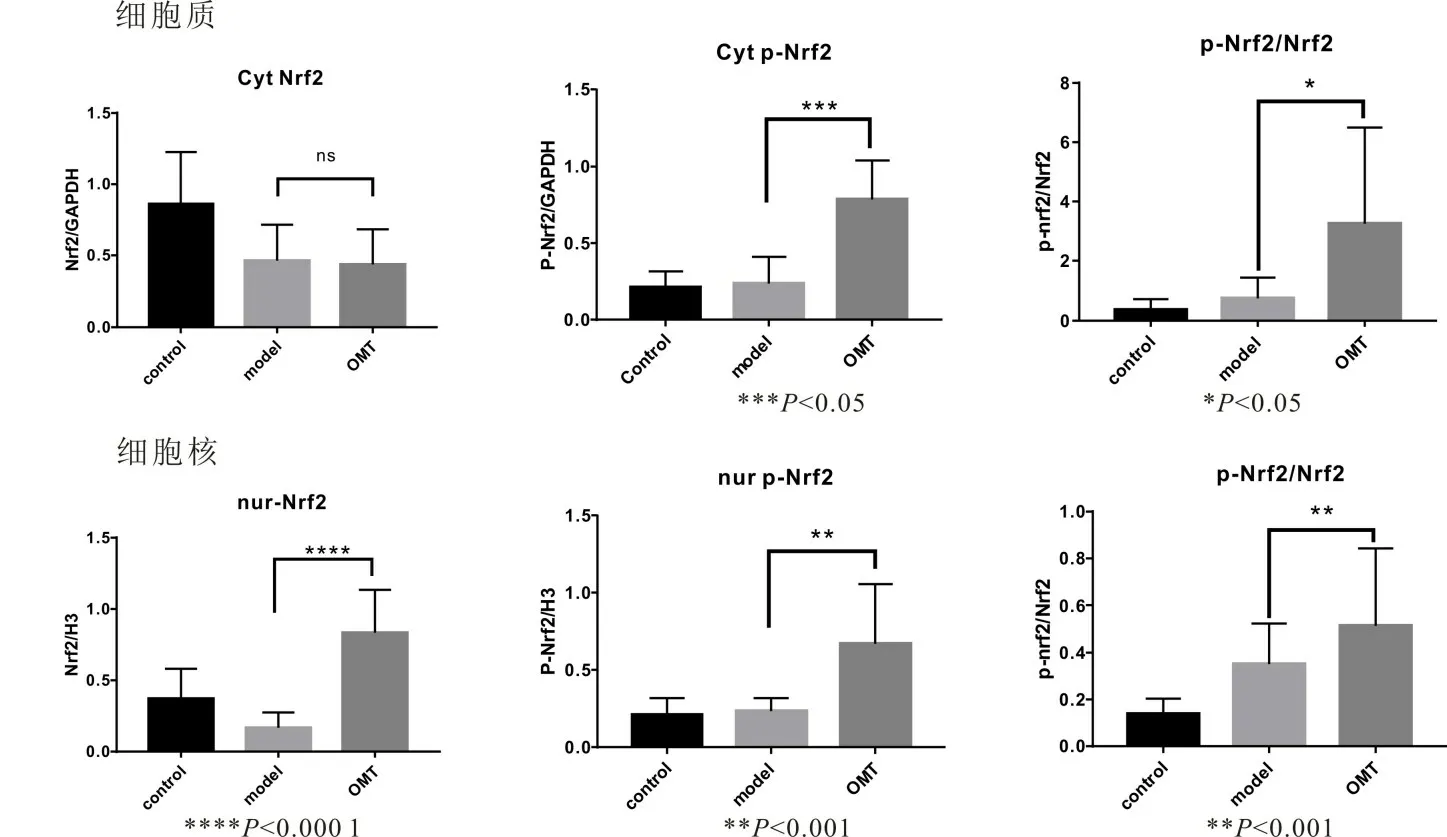
图6 3组大鼠胞质及胞核Nrf2、p-Nrf2表达条带灰度值比较
3 讨 论
由于肝硬化的各种并发症的严重性,临床医生不断探索有效的治疗方法,以改善患者生活质量并降低治疗费用。肠上皮屏障功能破坏、肠道细菌的过度生长和易位在肝硬化及其并发症的发病机制中起重要作用[19-20]。然而,肠上皮屏障功能的破坏可能是肠道细菌移位的始动因素。在本研究中,我们发现OMT 可恢复CCl4诱导的肝硬化大鼠肠上皮屏障的完整性和功能。这些获益至少部分可归因于OMT 通过影响Nrf2/HO-1信号通路减轻肠道氧化应激损害。
在肝硬化患者中,肠道异常较为常见。一项研究[3]发现,代偿期肝硬化患者中67%存在小肠异常,包括红斑(53%)、糜烂(17%)、血管扩张(15%)、静脉曲张(7%)和绒毛水肿(7%)。在组织学形态学改变中,CCl4诱导的肝硬化大鼠肠道大量破坏、炎症细胞浸润固有层和肌层、腺上皮的圆柱形消失、绒毛严重肿胀和黏膜结构松散[4-5]。在本研究中,我们观察到相似的形态学变化,经OMT 治疗后可修复肝硬化大鼠肠道形态学改变以维持肠上皮屏障的完整性。
胃肠道过度生成活性氧(Reactive oxygen species,ROS)将破坏肠黏膜屏障[6]。且ROS 对上皮细胞的影响增加了大肠杆菌的体外细菌移位速率,调节了对细菌刺激的反应并改变了刷状缘糖基化,增加了细菌粘附,促进了细菌易位[5]。门静脉高压导致的氧自由基代谢产物生成增加可改变肠屏障的功能完整性,进一步促进肝硬化大鼠中的细菌易位[21]。CHIVA M 等发现,在肝硬化大鼠中,回肠和盲肠黏膜氧化损伤可能有利于细菌易位[7],ASSIMAKOPOULOS SF 等研究发现晚期肝病患者肠道氧化应激显著升高[21],与研究结果一致。我们还发现与对照组相比,CCl4诱导的肝硬化模型大鼠的SOD、CAT、GSH、T-AOC 及HO-1 显著降低,MAD 显著增加(P<0.05)。实验组与模型组相比,SOD、CAT、GSH、T-AOC及HO-1显著增加,MAD显著降低(P<0.05)。提示OMT 治疗后提升了肠道黏膜抗氧化能力。
有研究证实[22],激活肠道Nrf2 蛋白能够减轻肠道氧化应激损伤。生物纳米硒(Biogenic nanoselenium,BNS)能够减轻除草剂诱导的小鼠肠道上皮屏障损伤,其通过激活肠道Nrf2 蛋白减少细胞凋亡、降低氧化应激,并以剂量和时间依赖性方式改善细胞氧化还原状态。然而,敲除小鼠Nrf2基因后,BNS保护小鼠肠道的作用消失。有文章总结激活肠道Nrf2蛋白转位不仅能够减轻肠道各种活性氧化对肠壁破坏,还能减轻肠道炎症反应,增加肠道紧密连接蛋白表达及调剂肠道免疫反应[23]。由此可见,肠道Nrf2 蛋白对肠道有保护作用。在本次研究中,我们检测细胞质、细胞核Nrf2及p-Nrf2的表达情况发现,OMT 治疗肝硬化大鼠能够影响Nrf2 蛋白磷酸化并促进转位至细胞核,增加磷酸化Nrf2 蛋白在细胞质及细胞核的含量,并可能通过此通路增加相应抗氧化酶的表达从而减轻抗氧化损伤。但本研究现有证据不能直接将OMT 与Nrf2的激活联系起来,我们仅仅发现使用OMT 能够对Nrf/HO-1通路产生影响。需进一步探讨OMT对Nrf2蛋白的直接影响。
总之,本研究可以得出以下结论:在CCl4诱导的肝硬化合并肠道屏障破坏大鼠中,OMT 治疗能够减轻肠道氧化应激损伤,并且增加大鼠体重,修复破损黏膜;其对肝硬化肠道的保护作用机制可能与肠道Nrf2/HO-1信号通路激活有关。
